百迈客合作单位中山大学在化学期刊Angew. Chem. Int. Ed上发表关于偶联临床铁螯合剂的线粒体靶向铼(I)配合物,以期达到同时破坏线粒体代谢和细胞内铁稳态的目的,并从表观组学揭示其抗肿瘤效果,该研究提供了一种通过干预线粒体代谢和铁稳态来调节癌症表观基因组的抗癌新策略。其中RNA-seq数据差异及功能富集分析等由百迈客完成,此外百迈客业务还包括单细胞转录组、空间转录组、单细胞ATAC&GEX、单细胞免疫组库等,有兴趣的老师可以联系当地销售。

英文题目:Recoding Cancer Epigenome by Intervening Metabolism and Iron Homeostasis with Mitochondria-Targeted Re(I) Complexes
中文题目:通过线粒体靶向Re(I)复合物干预代谢和铁稳态来记录癌症表观基因组
期刊杂志:Angew. Chem. Int. Ed
影响因子:15.336
合作单位:中山大学
原文链接:https://international.biocloud.net/zh/article/detail/32634290
导读
表观遗传修饰主要包括翻译后组蛋白修饰、DNA甲基化修饰和RNA修饰,这些修饰通过调节转录和染色质结构影响基因表达。表观遗传修饰机制包括修饰转移酶、修饰识别蛋白和去修饰转移酶,分别用于添加、识别和去除这些修饰位点。其中组蛋白去乙酰化酶(histone deacetylases, HDACs)和DNA甲基转移酶(DNA methyltransferases, DNMTs)抑制剂已被证实可用于临床。组蛋白和RNA去甲基化酶也成为有前景的抗癌靶点。有趣的是,DNMTs和HDACs的抑制剂表现出协同抗癌作用,和组蛋白甲基化引导m6A修饰共转录,表明这些表观遗传修饰密切相关。三阴性乳腺癌(TNBC)以雌激素、孕激素和HER-2基因缺失为特征,因其死亡率高、预后差,是乳腺癌死亡的主要原因。最近的研究表明,表观遗传修饰在TNBC(三阴乳腺癌)的进展和治疗中发挥重要作用。
研究表明组蛋白和RNA去甲基酶有希望成为有效的抗肿瘤靶标。表观遗传调节涉及到多种组蛋白、DNA和RNA修饰相关蛋白的协同作用,同时调控这些修饰有可能发挥协同抗癌作用。然而,许多表观遗传调节蛋白尚无有效的抑制剂/激活剂,因此,发挥这些修饰的协同作用面临巨大挑战。最近研究发现,干扰线粒体代谢和铁稳态是非常有前景的抗癌策略。线粒体代谢中的中间产物是组蛋白/DNA/RNA去甲基化酶的辅因子或天然的抑制剂;而铁则是这些生物大分子Fe(II)/2-氧代戊二酸依赖性去甲基酶的活性中心。
本文设计了偶联临床铁螯合剂的线粒体靶向铼(I)配合物,以期达到同时破坏线粒体代谢和细胞内铁稳态的目的。其中,DFX-Re3可以将细胞中的铁重新定位到线粒体,并干扰线粒体代谢,包括与表观遗传修饰密切相关的关键代谢物,并对三阴性乳腺癌表现出高选择性杀伤效果。此外,铁的重新定位导致Fe(II)/2-氧代戊二酸依赖性去甲基酶的下调。结果显示,DFX-Re3可以同时提高DNA、RNA和组蛋白的甲基化水平,最终改变RNA聚合酶II的活性以及基因表达图谱(RNA测序)。机制研究表明DFX-Re3可以诱导细胞免疫原性凋亡,并在体内表现出显著的抗肿瘤活性。该研究提供了一种通过干预线粒体代谢和铁稳态来调节癌症表观基因组的抗癌新策略。
研究方法与材料
研究方法:
(1)线粒体靶向铼(I)配合物合成与表征,主要加入临床铁螯合剂脱铁石(DFX);
(2)DFX-Re3在 MDA-MB-231 cells中定位实验;
(3)ICP-MS测定MDA-MB-231细胞内铁的分布;
(4)WB检测DFX-Re3对甲基化组蛋白H3表达影响;
(5)通过RNA-seq检测FX-Re3对MDA-MB-231 cells转录组表达谱的改变;
研究材料:
MDA-MB-231 cells(三阴乳腺癌)、MCF-7 cells(乳腺癌) 、MCF-10A cells(正常乳腺上皮细胞)
研究结果
1、线粒体靶向铼(I)配合物DFX-Re3合成与表征
文章设计了三个线粒体靶向铼(I)配合物,其中加入了一种临床铁螯合剂脱铁石(DFX),以同时干扰线粒体代谢和铁稳态。其中,DFX-Re3可以将细胞铁迁移到线粒体,干扰线粒体代谢,包括与表观遗传修饰相关的关键代谢物。
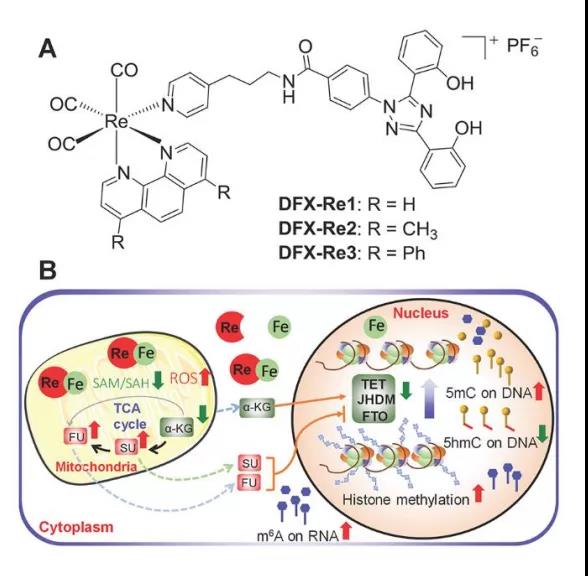 图1.线粒体靶向靶向铼(I)配合物干扰线粒体和铁稳态调控表观修饰
图1.线粒体靶向靶向铼(I)配合物干扰线粒体和铁稳态调控表观修饰
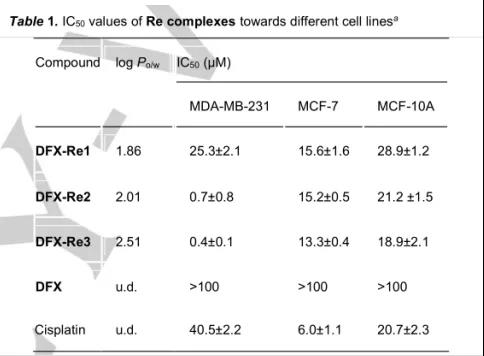
在三阴乳腺癌细胞、乳腺癌细胞、正常乳腺上皮细胞毒性实中进一步表明DFX-Re3对TNBC细胞具有选择性细胞毒性。
表1. DFX-Re3对细胞毒性实验
2. DFX-Re3影响线粒体代谢和关键表观遗传代谢物
基于以上研究,以活性最强的化合物DFX-Re3为模型化合物,研究其抗癌机制。共聚焦显微镜显示,DFX-Re3能有效穿透MDA-MB-231细胞。DFX-Re3和MitoTracker Deep Red具有较高共定位系数(94%) 。电感耦合等离子体质谱实验显示DFX-Re3在线粒体中逐渐富集,并且DFX-Re3影响表观关键代谢物在线粒体中富集。DFX-Re3处理影响多种代谢途径,包括丙氨酸、天冬氨酸和谷氨酸代谢、嘧啶代谢、嘌呤代谢和戊糖磷酸代谢。
DNA/RNA去甲基化酶和大部分组蛋白去甲基化反应以α- kG为辅助因子,琥珀酸(SU)和富马酸(FU)为抑制因子。SAM是组蛋白/DNA/RNA甲基转移酶的甲基供体,SAH是反应产物,是组蛋白/DNA/RNA甲基转移酶的竞争性抑制剂。在DFX-Re3处理的细胞中,α-kG(约1.36倍)和SAH(约21.2倍)下调,而SU(约1.57倍)和FU(约4.3倍)上调。超高效液相色谱-质谱(UHPLC-MS)显示,DFX-Re3处理组细胞α-KG水平较对照组降低0.87倍。酶联免疫吸附试验(ELISA)显示,DFX-Re3处理的细胞中SAM/SAH的比例增加了25.7倍(5 M, 6 h)。有趣的是,这些代谢物的变化都有利于甲基化水平的提高,DFX-Re3对糖酵解能力和糖酵解储备具有明显的剂量依赖性抑制作用。DFX-Re3不仅影响线粒体代谢平衡,还使得细胞内整体甲基化修饰水平上调,那DFX-Re3如何影响线粒体调控表观修饰呢?这背后的机理如何呢?继续看下文解读

图2. DFX-Re3影响线粒体代谢和关键表观遗传代谢物
3. DFX-Re3调控机制
(1)ICP-MS实验:DFX-Re3将细胞中铁转移到线粒体
用DFX-Re3孵育细胞后,ICP-MS显示线粒体中铁含量增加,而细胞质中铁含量减少。全细胞和细胞核中铁含量均无明显变化。未加DFX的Re3对铁的亚细胞分布无明显影响。并且,正如预期的那样,DFX-Re3在线粒体中积累Fe产生大量ROS,导致细胞生存力下降。
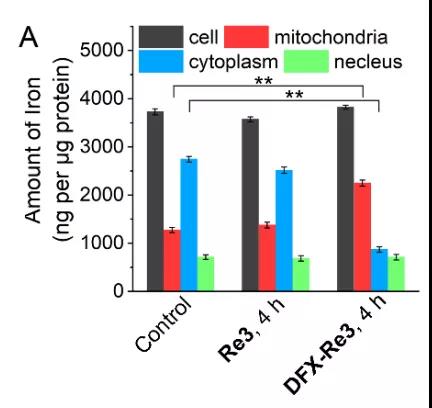
图3. DFX-Re3调控铁稳态平衡
(2)质谱实验:DFX-Re3使甲基化水平上升
由于DFX-Re3可以影响铁和关键表观遗传代谢物的细胞分布,而这些代谢产物与Fe(II)/2-氧戊二酸依赖性去甲基化酶的活性密切相关,进一步探索DFX-Re3对甲基化水平的影响。DFX-Re3处理后,H3在5个最常见位点的甲基化水平均升高。DFX-Re3处理导致5mC增加。发现TNBC全基因组低甲基化,但DNA甲基化状态改变在TNBC发生中的作用尚需进一步研究。在DFX-Re3的作用下,[34]5hmC(5-羟甲基胞嘧啶)明显降低,这与文献报道TET的抑制会阻止5hmC的形成相一致。在DFX-Re3处理的细胞中检测到m6A(m6a, mRNA上最普遍的甲基化形式)的增加,这可能归因于FTO活性的降低。
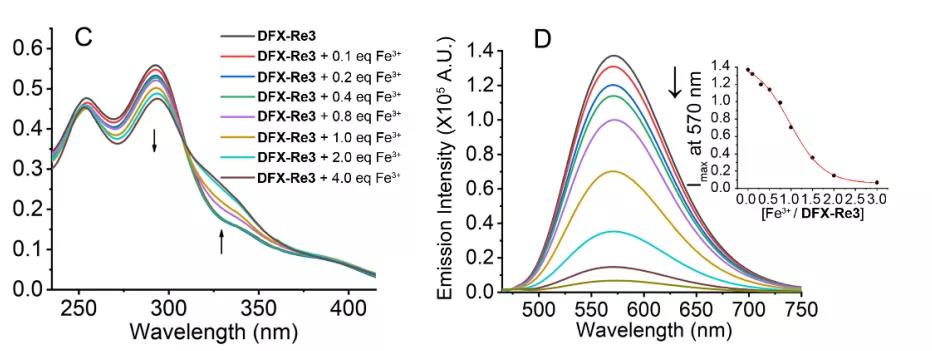
图4. DFX-Re3调控甲基化水平
(3)WB实验:DFX-Re3改变铁稳态影响修饰酶的活性
通过免疫印迹实验发现DFX-Re3处理后抑制甲基化组蛋白H3、JMJD2A、TET2、FTO等甲基化修饰酶的表达。细胞质中铁含量的降低,同时这些结果表明,铁在细胞内转移到线粒体可以增加DNA、RNA和组蛋白甲基化水平。

图5. DFX-Re3改变铁稳态影响修饰酶的活性
4. RNA-seq: DFX-Re3改变细胞的转录组表达谱
组蛋白/DNA/ RNA甲基化可以影响染色质状态和基因转录,作者使用RNA-seq研究DFX-Re3对转录组的影响。实验结果表明754个基因表达水平发生显著变化,其中上调基因470个,下调基因284个。功能富集分析(GO、KEGG)显示,DFX-Re3主要影响与线粒体[37]和表观遗传调控[38]密切相关的信号通路,包括肿瘤坏死因子(tumor necrosis factor, TNF)、forkhead box O, FoxO、细胞凋亡、p53、PIK3/Akt和MAPK信号通路。
基因本体分析显示,在DFX-Re3处理后,RNA聚合酶II启动子、染色质、生长因子活性、细胞内受体信号通路等均发生了显著变化。
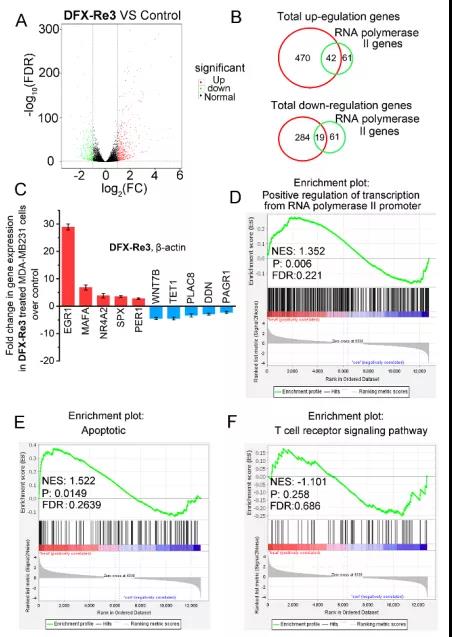
图6. DFX-Re3改变细胞的转录组表达谱
5. DFX-Re3体内体外功能验证实验:抗癌活性
在体内和体外评估了DFX-Re3的抗癌机制。透射电镜观察显示,DFX-Re3 (2 M, 24 h)处理后线粒体明显膨胀,提示MMP缺失。浓度较高时,细胞核边缘和中心出现染色质凝聚,细胞核碎裂,提示晚期凋亡。Annexin V/碘化丙啶(PI)双染色显示,在DFX-Re3处理的样品中,凋亡早期和晚期细胞比例呈剂量依赖性增加(图S36)。DFX-Re3激活caspase 3/7, Z-VAD-FMK(泛caspase抑制剂)预处理可抑制细胞死亡率。与之前的RNA-seq结果一致,DFX-Re3可以诱导多种免疫相关基因的表达改变,DFX-Re3诱导免疫相关基因表达改变。诱导钙网蛋白调控,这是免疫原性死亡的重要分子标记。这些结果表明,DFX- Re3可诱导caspase依赖的免疫原性凋亡。体内抗肿瘤实验中,DFX-Re3未见小鼠死亡或体重明显减轻,治疗结束时,DFX-Re3未见脏器明显病理改变。这些数据表明,DFX-Re3在体内具有高的抗癌作用和低的全身毒性。
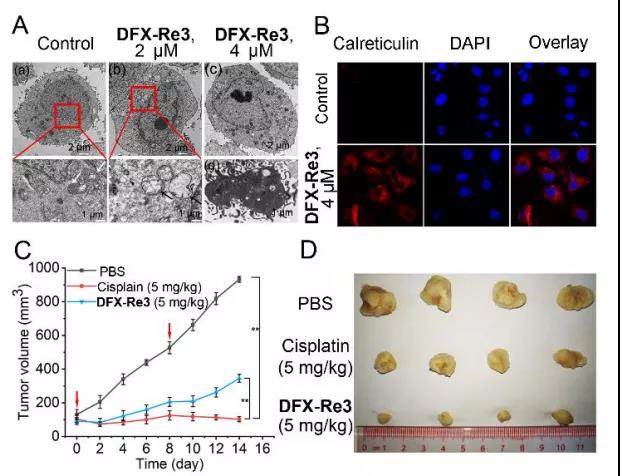 图7. DFX-Re3体内体外抗癌活性验证
图7. DFX-Re3体内体外抗癌活性验证
研究结论
该作用机制研究发现,本设计具有以下几个显著优势:(1) DFX-Re3影响线粒体代谢中与表观遗传修饰相关的代谢物;(2) DFX-Re3将细胞铁富集于线粒体并诱导线粒体产生大量活性氧;(3) DFX-Re3同时提高组蛋白、DNA和RNA的甲基化水平;(4) DFX-Re3改变转录组,尤其是RNA聚合酶II的活性;(5) DFX-Re3诱导细胞免疫原性凋亡并在体内表现出很高的抗癌活性和低的全身毒性。
本研究提出了一种新的策略来编码癌症表观基因组,并开发对传统化疗耐药的肿瘤治疗。
推荐阅读
【成功案例】II型糖尿病患者肠道菌群改变与miR-122-5p表达的相关性研究
【成功案例】-中医药研究-代谢组学和微生物多样性联合测定葛根素对蛋氨酸胆碱缺乏膳食诱导的非酒精性脂肪性肝炎的治疗潜力
[成功案例]-中医药之微生物多样性-咖啡酸调节小鼠肠道微生物群预防高脂肪饮食诱导的非酒精性脂肪肝
【成功案例】中药研究之微生物多样性-柚皮苷对高脂饮食诱导的小鼠非酒精性脂肪肝和肠道细菌失调的影响
[成功案例]中药研究之转录组-揭示凉血解毒汤治疗银屑病活动性的转录标志物
【成功案例】中药研究第二弹-转录组测序助力雷公藤提取物T-96抗胶质瘤作用研究
【成功案例】中山眼科中心应用nanopore平台进行中国汉族人口结构变异研究
【成功案例】四川大学华西医院利用ONT测序平台进行新冠病毒全基因组测序
【成功案例】ONT全长转录组联合代谢组解读酰化和非酰化花色苷对Zucker糖尿病肥胖型大鼠肝脏代谢产物和基因表达的影响
【成功案例】百迈客转录组学助力鼻咽癌转移研究再创新高 —15+








 京公网安备 11011302003368号
京公网安备 11011302003368号