2020年11月,百迈客和成都中医药大学附属医院检验科合作文章“Correlation between alterations of gut microbiota and miR-122-5p expression in patients with type 2 diabetes mellitus”发表于期刊Annals of Translational Medicine(IF:3.279)。作者利用16s全长微生物多样性技术和miRNA测序技术,解析了II型糖尿病患者肠道菌群改变与miR-122-5p表达的相关性。其中miRNA数据差异及功能分析、16s全长微生物多样性测序分析等由百迈客完成,此外百迈客业务还包括单细胞转录组、空间转录组、单细胞ATAC&GEX、单细胞免疫组库等,有兴趣的老师可以联系当地销售。
导读
研究背景
II型糖尿病(T2DM)是世界范围内的主要公共卫生问题。目前,全球估计有3.66亿人患有II型糖尿病;这一数字到2030年预计将达到4.22亿,到2045年将增至7亿。其中90%以上的病例是T2DM。II型糖尿病是一种代谢性疾病,其特征是胰岛素分泌缺陷和/或由于胰岛素抵抗引起的慢性高血糖。
II型糖尿病影响生理生化活动的所有领域,包括遗传学、代谢组学和蛋白质组学。目前,血糖监测是T2DM的主要诊断方法,T2DM发生的发病机制尚未完全阐明。目前还没有能够改善胰岛功能的特殊治疗方法,因此预防和早期诊断至关重要。阐明T2DM初期宿主体内各种复杂的相互作用机制,迫切需要新的思路和策略来确定T2DM的关键治疗靶点。
肠道微生物群是宿主胃肠道中的一个极其庞大的微生物群,它可以与人类共同进化并控制营养吸收和能量转换,形成和调节肠粘膜屏障,并协助肠道免疫防御系统维持体内平衡。肠道微生物群与宿主之间共生关系的破坏可能导致代谢性疾病的发生,如T2DM。MicroRNAs(miRNAs)是一类非编码单链分子,其表达具有组织特异性和发育调控性。miRNA已被证明与广泛的生理和病理过程密切相关。miRNAs的主要功能是通过切割靶基因转录物或结合靶信使RNA(mRNAs)的3′-UTR来负向调控基因表达,从而在转录后水平上抑制mRNA翻译。
越来越多的证据表明,肠道微生物群的失衡和miRNA表达水平的变化参与了人类疾病的发生和发展;两者都可能作为各种疾病的触发因素。然而,由于缺乏系统的临床人群研究,这种相互作用在T2DM病理生理机制中的作用尚未得到很好的评估。
结论
作者选择II型糖尿病患者和正常对照组,使用16S全长微生物多样性技术分析两组肠道微生物群的变化,并使用miRNA高通量测序筛选两组之间miRNA的差异表达。与正常对照组相比,T2DM患者的HAlbc、FBG、TG、TC、LDL、HDL和胰岛素的生化指标有显著性差异(分别为P<0.001、P<0.001、P=0.0125、P=0.98、P<0.001、P=0.022和P=0.0013)。这两组人的肠道微生物群分布和miRNA表达特征也有显著差异。研究发现了初步诊断为T2DM患者的肠道微生物群和miRNA特征:miR-122-5p与肠道细菌类群(Bacteriodes. uniformis and Phascolarctobacterium. Faecium)呈负相关。这个发现提示miRNA和肠道微生物群之间的相互作用可能通过控制T2DM发展过程中葡萄糖代谢的关键基因来调节胰岛素分泌和信号转导。
英文题目:Correlation between alterations of gut microbiota and miR-122-5p expression in patients with type 2 diabetes mellitus.
中文题目:II型糖尿病患者肠道菌群改变与miR-122-5p表达的相关性研究
期刊:Annals of Translational Medicine
IF:3.279
发表时间:2020.11
作者:Lisha Li
材料与方法
材料:肠道微生物:粪便标本取自正常对照组(n=30)和T2DM组(n=30)的受试者;
miRNA测序:5名T2DM患者和5名正常对照的循环血浆
Keywords:PB-MCD;miRNA-seq
实验结果
一、肠道微生物群16s rRNA的全长微生物多样性分析结果
从测序的60个样本中,共获得514080个CCS序列。每个样本产生至少428个CCS序列,平均8568个CCS序列。两组的OTU数量、chao和ACE指数在统计学上存在显著差异(分别为P=0.01、0.007和0.037),这表明T2DM可能引起肠道微生物多样性的变化。Shannon和Simpson指数分析表明,测序深度足以捕获所有细菌物种,样本具有代表性。通过分析α多样性和β多样性,初步解释了两组间差异的构成。在门水平上,厚壁菌、类杆菌、变形菌和放线菌是这两组肠道微生物群的优势种,且比例相对较高。在正常对照组中,厚壁菌、类杆菌和变形菌分别占肠道微生物群的40.5%、45.1%和18.7%,而在T2DM组中,分别占47.4%、25.8%和21.4%。在T2DM组,类杆菌作为优势菌群的差异具有统计学意义(P=0.0049),类杆菌与厚壁菌的比例降低。LEfSe分析确定了两组之间53种显著不同的物种(生物标记物筛选标准:LDA评分>4,P<0.05)(图1B,C)。不同肠道微生物群水平与基本指标之间相关性的CCA典型相关分析结果如图1D所示。
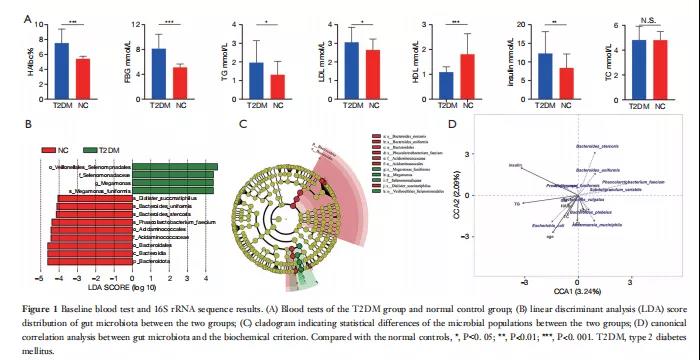
图1
二、miRNA高通量测序分析结果
通过miRNA高通量测序分析,从所有样本中获得4542个miRNA,包括1913个已知的miRNA和2629个新预测的miRNA。正常对照组新预测的miRNA数量显著高于T2DM组。使用火山图筛选了405个组间差异表达的循环miRNA,并排除了检测不到的miRNA和非人类miRNA。与对照组相比,新诊断T2DM组88个miRNA的表达显著下调,22个miRNA的表达显著上调(图2A)。筛选出9个在T2DM组有显著差异表达的候选miRNA;其中包括显著下调的miR-1225p、miR-193a、miR-3151、miR-582-3p和miR-184,以及上调的miR-200a-3p、miR-487A、miR-34c-3p和miR-449a。
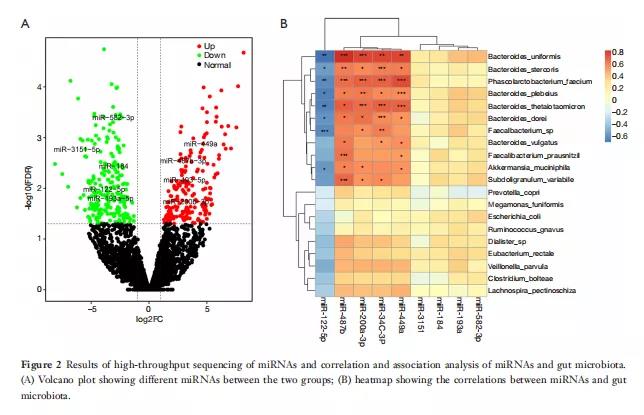
图2
三、关联分析
通过行Spearman相关分析。图2B显示了一个热图,描绘了五个与某些微生物区系具有统计显著正相关和负相关的miRNA(P<0.05)。在这五种miRNA中,miR-122-5p在哺乳动物的进化过程中高度保守,与八种肠道细菌相关,包括两种肠道细菌B.uniformis和P.faecium,它们有显著差异(分别为P=0.023和0.031)。
四、生物信息学预测结果
作者利用PICRUSt软件获得与OTU相对应的KEGG信息(图3A)。观察到肠道细菌功能基因代谢途径的一些差异,如B.uniformis、B.plebeius、B.taiotaomicron、P.faecium和 Faecalibacterium.sp。这些肠道细菌在氨基酸、碳水化合物、多糖、维生素、辅助因子、膜转运和能量转换的代谢中起着重要的调节作用。由于正常对照组和II型糖尿病组之间的B.uniformis 和P.faecium存在显著差异,因此对肠道微生物群和血液指标进行了CCA分析,结果表明B.uniformis 和 P.faecium与胰岛素、FBG、LDL和TG呈负相关。
接下来,使用TargetScan软件预测miR122-5p靶基因。共预测了226个靶基因。通过GO富集分析(图3B)。针对与背景相关的目标基因,获得了45条具有统计学意义(P<0.01)的生物对应代谢途径(图3C)。发现miR-122-5p在糖代谢相关信号通路中显著富集(P<0.01),包括糖异生和糖酵解途径。调控信号通路的靶基因包括葡萄糖6-磷酸酶(G6PC)、G6PC3、PDK、KAT2A和许多其他基因;这些基因已被证明对糖代谢和能量代谢有直接的调节作用。此外,显著富集的HIF信号通路还涉及多个miR-122-5p靶基因。HIF信号通路已被证明与葡萄糖产生酶基因的表达有关,如Pepck、G6PC和葡萄糖转运蛋白2(GLUT2),它们可以通过增加GLUT1摄取的表达促进细胞代谢,并上调PDK和其他酶的表达以增加糖酵解。
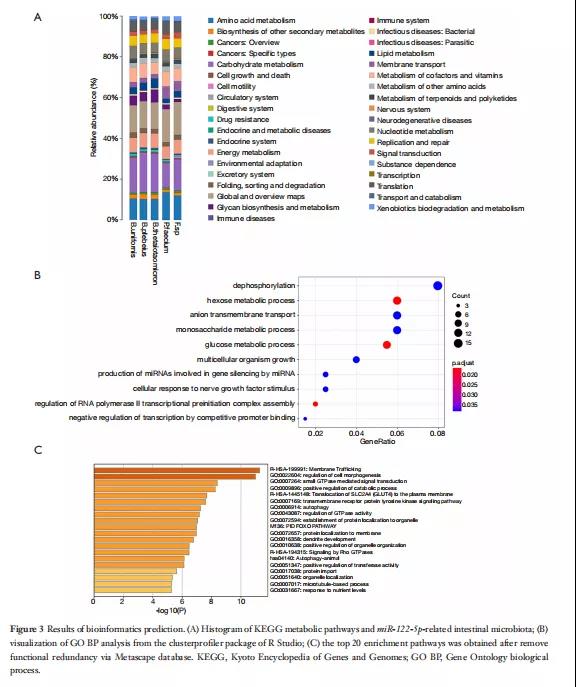 图3
图3
讨论
研究数据显示,新诊断的II型糖尿病患者具有特定的肠道微生物群分布和miRNA表达特征,一些显著不同的miRNA与某些微生物群呈统计学显著正相关或负相关(P<0.05)。以此可以推断,这些miRNA可能作为细菌基因转录和生长的选择性调节因子,促进宿主对肠道微生物群的控制。其中,miR-122-5p在哺乳动物进化中高度保守,并与多种肠道细菌显著相关,包括T2DM前后显著不同的两种肠道细菌。
miR-122-5p在脊椎动物肝脏发育过程中持续表达并高度保守,在肝脏葡萄糖和脂质代谢的内稳态中起着至关重要的作用。在本研究对miR-122-5p靶基因集的生物信息学分析中,发现许多信号转导途径与糖代谢途径密切相关,包括糖异生和糖酵解途径。这些途径与参与糖代谢的关键基因G6PC、PEPCK、PDK、KAT2A和GLUT2相关。
综上所述,作者的研究揭示了T2DM患者发病前后宿主肠道微生物群和miRNA的不同表达特征。在miRNA和肠道微生物之间存在相互关联的循环的前提下,有理由相信miR-122-5p和B.uniformis在调节糖异生基因和胰岛素信号传递的过程中相互调节,在控制糖代谢和胰岛素分泌的内环境平衡中发挥权威作用。循环miRNA和肠道微生物群的串扰网络是维持宿主身体稳定和状态的一种方式,以及形成另一种调节T2DM的机制。然而,还需要进一步研究确定参与糖代谢的基因,这些基因由二者共同控制,以及影响胰岛细胞功能和胰岛素合成与分泌的特定信号通路。因此,考虑到T2DM发病率持续增加和缺乏特异性治疗,肠道微生物群和miRNA作为潜在治疗靶点的价值需要进一步研究,以便在分子作用水平上获得更有力的证据,并为T2DM的早期诊断和√确治疗带来新的机遇。







 京公网安备 11011302003368号
京公网安备 11011302003368号