近日,中国医学科学院老年医学研究所在Food Research International (IF=5.0)杂志发表了Caffeic acid prevents non-alcoholic fatty liver disease induced by a high-fat diet through gut microbiota modulation in mice一文,探讨了咖啡酸在小鼠肠道中对微生物菌群的影响,从而为非酒精性脂肪性肝病的预防提出新的见解理论基础。其中微生物多样性检测由百迈客协助完成。
研究背景
非酒精性脂肪性肝病(NAFLD)已成为全世界关注的主要健康问题;它是一种主要的隐性疾病,会增加罹患多种慢性疾病的风险,如2型糖尿病和心血管疾病。NAFLD患者有发展为脂肪肝、肝硬化甚至肝细胞癌的风险。然而,NAFLD的诱导和进展的病理机制复杂,目前还没有明确的靶向药物。改变生活方式和改变饮食是目前缓解NAFLD的主要策略。因此,确定NAFLD的新靶点和治疗方法仍然是一个挑战。
NAFLD是由肝细胞内脂肪过度堆积引起的,新生脂肪生成是脂肪储存的重要途径。肝脏脂肪生成主要由固醇调控元件结合蛋白1 (Srebp1)调控,Srebp1增强脂肪生成基因的后续激活,包括脂肪酸合成酶(Fas)、乙酰辅酶a羧化酶(Acc)和硬脂酰辅酶a去饱和酶1 (Scd1),导致肝脏脂质积累。此外,NAFLD的发病和进展是众所周知的与炎症有关。肠道衍生毒素,如脂多糖(LPS),被认为在肝脏炎症中具有致病作用,并与NAFLD密切相关。一方面,有报道称LPS可促进Srebpl激活和肝脏脂质积聚。相反,LPS通过激活肝脏toll样受体4 (TLR4)/核因子-κB (NF-kB)信号通路触发炎症反应。
近年来,肠道菌群与NAFLD的关系引起了广泛关注。肠道微生物群产生促炎LPS并进一步影响肝脏脂质代谢,已成为NAFLD发展的重要参与者。研究表明,高脂肪饮食(HFD)喂养的无菌小鼠肝脏中的脂质水平低于传统饲养的小鼠。此外,将从高脂饮食诱导的肥胖供体中分离出的肠道微生物移植到无菌动物中,会导致受体小鼠体重显著增加和代谢综合征。因此,肠道菌群的稳态对维持健康至关重要,确定肠道菌群的组成对于研究NAFLD与失调之间的致病关系和潜在致病联系是必要的。
咖啡酸(CA),也被称为3,4 -二羟基肉桂酸,是最常见的酚酸之一,存在于大多数植物中,包括咖啡、水果和丹参。CA在人类饮食中广泛使用。越来越多的证据证实CA具有多种生物功能,包括抗氧化和抗炎活性。与此同时,据报道,CA减少alcohol-fed老鼠的肝脏脂质含量,抑制油的段脂肪生成人类HepG2细胞,和改善小鼠的肝脂肪变性和内质网应激通过增加自噬。然而,CA作用于脂质积累的机制尚不清楚。枸杞叶提取物含有多种酚酸,包括CA,有研究表明,枸杞叶提取物可以通过调节代谢谱和肠道菌群组成来改善大鼠2型糖尿病。然而,目前尚无关于CA对NAFLD肠道菌群影响的研究报道。本研究旨在探讨CA对NAFLD的降脂作用及其机制,尤其关注其对肠道菌群的影响。

英文名称: Caffeic acidprevents non-alcoholic fatty liver disease induced by a high-fat
diet through gut microbiota modulation in mice
中文名称: 咖啡酸通过调节小鼠肠道菌群预防由高脂肪饮食引起的非酒精性脂肪肝
杂 志:Food Research International
影响因子:5.0
材料方法
1、实验材料:
6周龄雄性C57BL/6J小鼠,正常鼠粮(ND, 1025)、ND添加0.08%或0.16% CA 、HFD(合成饲粮添加0.15%胆固醇,w/w, H10141),HFD添加0.08%或0.16% 。
2、研究方法:
在ND适应1周后,将小鼠随机分为2组:ND组(n = 30)和HFD组(n = 30),治疗8周。
ND组小鼠随机分为3组(n = 10),饲喂特定饲料,为期8周。这些组包括:1)喂食正常食物的ND小鼠;2)低ND+CA,喂食CA含量为0.08%的正常鼠粮;3)高ND+CA,喂食CA含量为0.16%的正常饲料。同时,高脂饮食组按以下饲
随机分为3组(n = 10),饲养期8周。这些组包括1)高脂饮食小鼠;2) HFD+CA-low组,高脂日粮中添加0.08% CA;3) HFD+CA高组,饲喂添加0.16% CA的高脂饲粮,每2周测量体重。
最后用戊巴比妥(30 mg/kg)麻醉小鼠。小鼠经心脏穿刺采血后处死,取肝脏称重。回肠、盲肠和结肠内容物无菌收集,立即置于- 80°C保存至使用。
研究结果
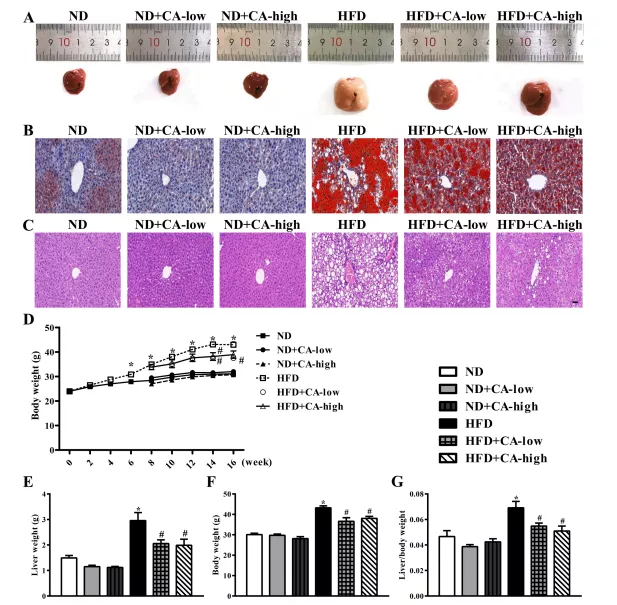
1.补充CA可降低高脂喂养小鼠的脂质积累
本研究旨在评估CA治疗高脂喂养小鼠的潜在益处,重点关注在NAFLD发病机制中,除了调节内毒素相关炎症信号机制和脂代谢改变外,恢复肠道菌群平衡可能与之有关。为了研究CA对脂质积累的影响,我们分别用低浓度和高浓度的CA喂养小鼠。肝脂肪变性是主要的组织病理学表现;在其他研究中观察到,高脂饲料喂养小鼠的肝脏比三组ND小鼠的肝脏出现更多的脂肪变性,宏观上黄色和坚硬的纹理证明了这一点(图1A)。值得注意的是,添加0.08%或0.16% CA的HFD小鼠肝脏表面呈红褐色,质地柔软。肝切片HE染色(图1B)和油红O染色(图1C)证实了这一点。与ND组相比,高脂饲料喂养的小鼠脂肪滴更多、更大,而CA处理的小鼠脂肪滴更少。与ND组相比,HFD干预8周后小鼠体重显著增加,并持续增加至16周。然而,从第8周开始,饲粮中添加0.08%或0.16%的CA可以有效地缓解hfd诱导的体重增加,特别是在第14周(CA浓度均为)和第16周(仅添加0.08% CA)时(图1D)。在肝脏重量(图1E)、体重(图1F)和肝脏/体重(图1G)以及两种浓度的CA处理中也可以观察到类似的结果,这降低了hfd诱导的肝脏重量、体重和肝脏/体重的增加。与只喂食ND组相比,添加CA的ND组对这些指标没有任何差异。
图1
2.CA的补充影响hfd喂养小鼠的生化标记物
血清TC、TG、HDL-C和LDL-C升高是HFD组小鼠的主要特征。同样,HFD组小鼠血清TC、HDL- C、LDL-C水平明显升高,提示小鼠出现高脂血症。CA处理在低和血清TC、TG、HDL-C和LDL-C升高是HFD组小鼠的主要特征。同样,HFD组小鼠血清TC、HDL- C、LDL-C水平明显升高,提示小鼠出现高脂血症。CA处理在低和低浓度的TC、HDL-C和LDL-C对hfd诱导的血清高脂血症有缓解作用。但各组间血清TG水平无显著差异(图2A-D)。在HFD组中,ALT、AST、葡萄糖和hsCRP水平均升高,而在喂食HFD的小鼠中,添加两种浓度的CA只恢复了血清中ALT和葡萄糖(图2E-H)。添加CA的ND小鼠与只添加ND的小鼠表现出几乎相同的结果。
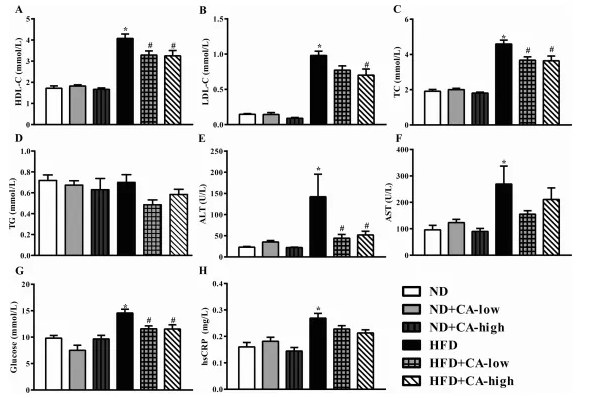
图2
3.补充CA可调节高脂喂养小鼠脂肪生成相关蛋白表达
Srebp1是大多数肝脂合成基因的主调控基因,包括Fas、Acc和Scd1。Fas为TG提供非酯化脂肪酸底物,导致脂肪酸合成和TG积累增强。Acc将乙酰辅酶a转化为丙二酰辅酶a,参与脂肪酸合成。Scd1有助于脂肪酸去饱和。Srebp1及其靶基因Fas、Acc和Scd1在NAFLD中上调,抑制Srebp1活性可抑制Fas、Acc、Scd1和TG的积累。接下来,我们评估了CA对高脂喂养小鼠新生脂肪形成相关蛋白表达的影响。我们的结果表明,与对照组相比,HFD显著上调了肝组织中Srebp1、Fas、Acc和Scd1的表达,而低浓度和高浓度CA的补充均不同程度地减弱了该表达。添加CA的ND小鼠与只给ND小鼠没有明显差异(图3A-E)
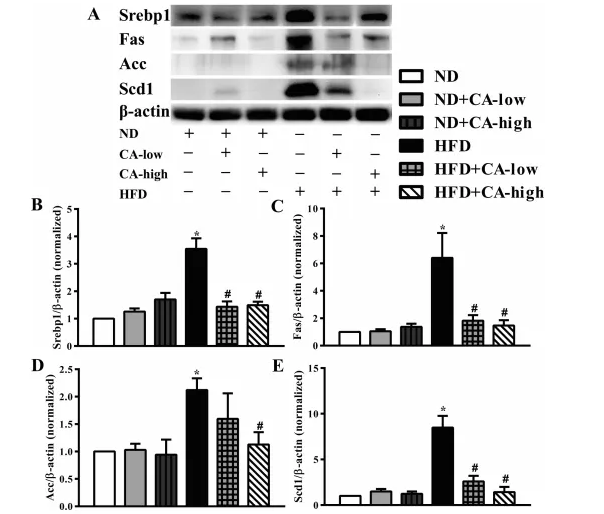
图3
4.补充CA可减轻高脂喂养小鼠的内毒素血症和随后的促炎反应
有报道称,NAFLD的特征是肠道菌群改变、炎症和肠道屏障破坏。肝组织炎症被认为是肝脂肪变性发展的驱动因素,肠道源性脂多糖被认为在肝脏炎症中具有致病作用。最近的动物实验研究关注了肠道菌群LPS在NAFLD发生中的作用。肠道源性LPS是革兰氏阴性菌外膜的主要成分,通过TLR4信号通路和下游炎症级联反应促进炎症反应。有报道称,在NAFLD模型中,与野生型小鼠相比,tlr4缺陷小鼠的肝损伤、炎症和脂质积累减少。此外,阻断肠道菌群与宿主细胞之间的脂多糖- tlr4相互作用可以阻止高脂喂养小鼠NAFLD的启动和发展,这证实了脂多糖- tlr4通路在诱导NAFLD中具有非常重要的作用。与之前的研究结果一致,我们的研究表明,16周高脂饮食导致血清LPS和肝脏TLR4表达显著增加,肝组织中磷酸化的NF-kB p65被激活,表明炎症开始。同时,高脂喂养小鼠血清TNF-a、IL-6水平升高,肝脏mpo阳性细胞浸润。所有剂量的CA补充均显著扭转了上述现象;在添加ca的ND组中没有观察到显著差异(图4A-G)。
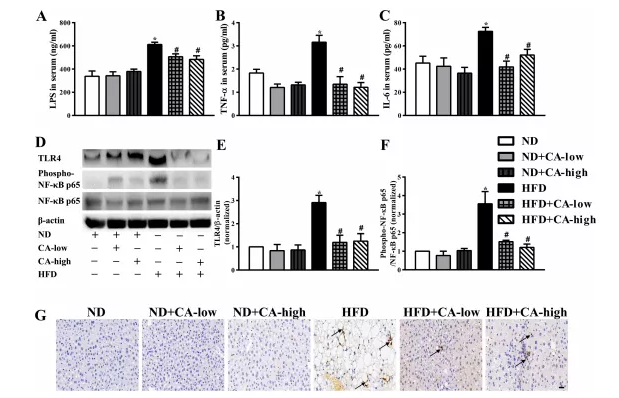
图4
5.补充CA可减少高脂饲料喂养小鼠的肠道菌群失调
越来越多的证据表明,肠道微生物群是NAFLD发展和进展中的一种新的生物标志物,它通过涉及炎症反应激活和代谢调节的机制促进其发展。肠道菌群失调导致NAFLD的可能机制可归纳为:干扰能量收获和支出之间的平衡,促进肝脏炎症(损害肠道完整性、促进内毒素和启动与细胞因子释放炎症级联),并改变生物化学代谢和肠道microbiota-related代谢物(如胆汁酸,短链脂肪酸,芳香族氨基酸衍生品,支链氨基酸,等等)。因此,调节肠道菌群组成及其代谢功能具有抑制NAFLD发展的潜力。此前的研究表明,多酚具有类似益生元的作用,能够改变肠道微生物平衡,改善肠道黏膜炎症和通透性。因此,我们分析了不同区域的肠道菌群组成研究结果表明,CA可能参与调节肠道细菌组成。
研究了6组中回肠、盲肠、结肠3个肠段内容物中肠道菌群组成的变化。如图5A所示,与ND组相比,HFD小鼠回肠肠道菌群中观察到的OTUs明显降低,同时盲肠和结肠的OTUs也有下降趋势。添加0.16% CA的HFD组小鼠回肠和结肠OTUs显著增加。有趣的是,在添加0.08% CA的ND组中,除了结肠OTUs的减少外,添加CA可导致正常饲粮小鼠OTUs的减少。进行Alpha多样性分析,包括ACE(图5B)、Chao1(图5C)、Shannon(图5D)和Simpson指数(图5E)。ACE、Chao1、Shannon和Simpson的变化与OTUs的变化平行,表明HFD破坏了肠道菌群的丰富度和多样性。同时,添加CA可在一定程度上恢复植物区系的丰富度和多样性,尤其是在HFD中添加0.16% CA时。在ND组中添加CA导致了微生物群落丰富度和多样性的降低,表明其作用可能与HFD组不同。此外,已知多酚可以下调微生物多样性,显著抑制致病菌的生长;因此,添加CA的ND组细菌OTU、丰富度和多样性的降低可能与CA的抑菌作用有关。利用Beta多样性分析分析肠道菌群整体结构的变化。主成分分析显示不同的微生物群组成和单独的集群之间HFD老鼠和ND老鼠,和HFD老鼠和HFD之间补充高浓度的CA。然而,HFD小鼠的肠道微生物群补充CA浓度较低的不是明显不同于回肠HFD老鼠,盲肠和结肠。此外,ND处理组间的微生物菌群组成没有差异(图5F、G和H)。PCA识别出回肠、盲肠和结肠中两个最易变的菌群——Allobaculum和Faecalibaculum,这意味着它们导致了组间观察到的差异。PCA结果显示,PC1(48.59%)具有a盲肠总方差高于PC2(21.36%),说明CA处理可使hfd诱导的肠道菌群组成与ND组相似。通过beta多样性分析,我们发现CA处理组(特别是添加0.16% CA)和HFD处理组具有不同的菌群组成,提示CA对肠道菌群的修饰作用。
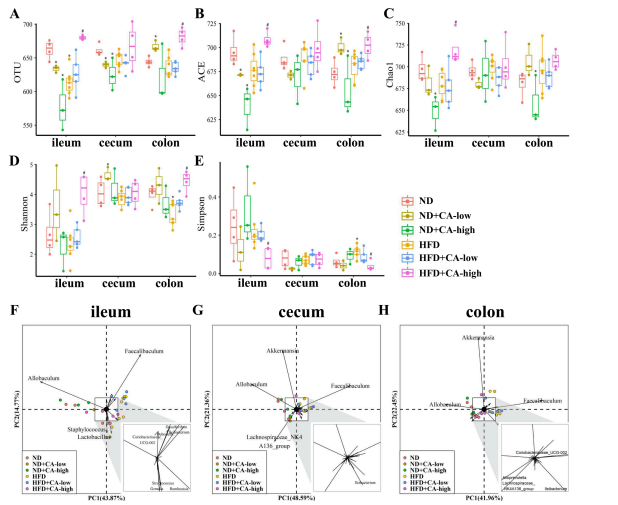
图5
6.肠道菌群与NAFLD相关参数的相关性
CA对hfd诱导小鼠肠道菌群组成、体增重、内脏肥胖、血脂水平、炎症等有保护作用。我们进一步采用Spearman秩相关法对上述过滤后的粪便细菌与NAFLD相关参数进行相关性分析。我们观察到肝脏重量、体重、肝脏/体重、血清TC、HDL-C、LDL-C、LPS、TNF-a和IL- 6水平与Allobacul^n、Barne- siella、Faecalibacterium和uncultured_bact:erium_f_Muribaculaceae的相对丰度(属水平)呈显著负相关。此外,相对丰度(在属级)的弯曲杆菌,Faecalibaculum,梭菌属,Lachnospiraceae_XPB1014_group和uncultured_bacterium__p – 251 o5呈正相关,与上面的非酒精性脂肪肝相关参数,其中弯曲杆菌,Lach nospiraceae_XPB1014_group和uncultured_bacterium__p – 251 o5显示最重要的正相关与非酒精性脂肪肝相关参数(图6)。与这一结果一致,Allobaculum, Barnesiella,与ND组相比,高脂喂养小鼠的粪杆菌和未培养的细菌^Muribaculaceae减少。同时,HFD组Campylobacter、Faecalibaculum、Fusobacterium、Lachno- spiraceae_XPB1014_group和uncultured_bact:erium_f_p-251-o5的相对丰度增加,CA处理显著降低了上述肠道菌群的相对丰度。
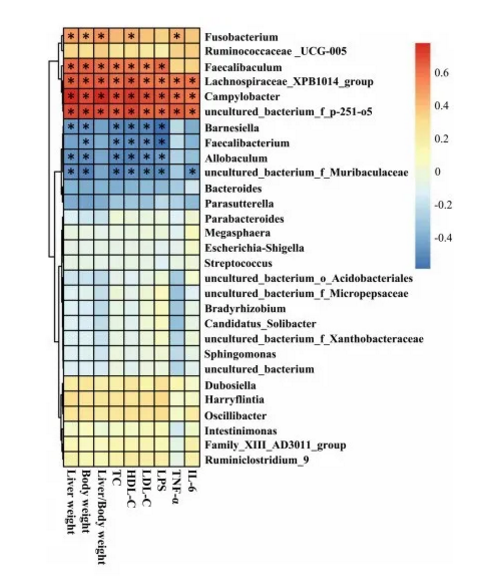
图6
以上结果表明,HFD组的脂多糖抑制属明显减少。同时,HFD组的脂多糖产生属增加,ca处理HFD组的脂多糖产生属减少。例如,Allobaculum, Barnesiella和Faecalibacterium被报道为短链脂肪酸产生菌。短链脂肪酸可能刺激上皮细胞增殖,并在改善肠道屏障完整性方面发挥重要作用,可能抑制LPS释放和抗肥胖活性。弯曲杆菌是一种影响宿主健康的机会致病菌。大肠杆菌志贺氏菌(escherichia -志贺氏菌)是一种革兰氏阴性菌,其细胞壁中含有LPS,在HFD组中显著增加。众所周知,当肠道屏障受损时,革兰氏阴性菌释放LPS到血液中,它们与小肠细菌过度生长密切相关。粪钙杆菌(Faecalibaculum)和梭杆菌(Fusobacterium)均为促炎菌,可能破坏肠道屏障,并与恶化的肝脏脂肪变性有关。它们也可能有助于NAFLD患者血清LPS和TNF-a的高表达。因此,我们得出结论,CA有助于平衡肠道脂多糖相关菌群失调,并有助于预防NAFLD中低级别慢性炎症。
在这项研究中,我们表明,补充低和高浓度的CA HFD不仅减少HFD-induced肥胖、改善血清脂质,ALT, AST,葡萄糖,hsCRP,有限合伙人,TNF-a和il – 6和钝化脂肪生成,而且还改变了在非酒精性脂肪肝小鼠肠道微生物群组成,表明CA除了可以作为新策略来抑制非酒精性脂肪肝的发展。在大多数情况下,HFD中添加0.16% CA比低浓度CA更能有效地降低NAFLD相关参数。这些结果提示,肠道微生物群可能参与了CA对脂质代谢和NAFLD的影响。
7.结论
本研究采用高脂饮食诱导的C57BL/6J小鼠NAFLD模型,首次证实了CA对NAFLD小鼠肠道菌群的影响。我们报道CA显著改变了肠道微生物的群落组成结构,并降低了NAFLD参数。此外,我们还发现一些微生物群的相对丰度与NAFLD参数密切相关。我们的研究结果表明,CA通过抑制肠道失调、促炎症LPS释放和随后的脂质合成等综合反应,对高脂饮食诱导的NAFLD发展发挥保护作用。








 京公网安备 11011302003368号
京公网安备 11011302003368号