英文题目:Genomic monitoring of SARS-CoV-2 uncovers an Nsp1 deletion variant that modulates type I interferon response
导读
研究背景
-
非靶向宏基因组序列:11个样本使用Illumina NextSeq 500测序 -
多重PCR +纳米孔测序,制备MinION文库 -
转录组测序、Sanger测序 -
Nsp1过表达和qRT-PCR、免疫共沉淀、ELISA、荧光素酶检测、空斑试验
研究结果
与20家医院和研究机构合作,分析了在2020年1月22日至2月20日期间在中国四川省收集的流行病学、遗传和临床数据。2020年1-2月底,四川省经qPCR检测确诊病例538例,其中成都病例占28.8%(图1A)。四川确诊病例呈指数增长,2020年1月30日达到高峰,每天新增确诊病例38例(图1B)。若人员更密集,发生病例的频率更高(图1C),表明社交距离可能是防止病毒传播的一个关键因素。
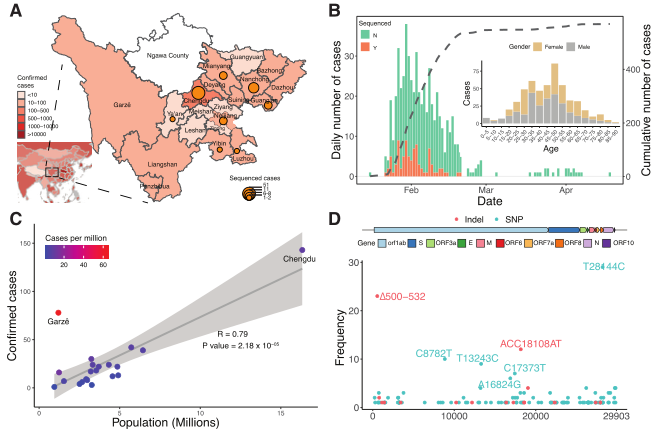
图1 四川省SARS-CoV-2的时空流行病学研究
为了鉴定SARS-CoV-2病毒的遗传变异,利用ARTIC生信分析流程鉴定单核苷酸多态性(SNPs)和插入和缺失(indels)。在四川队列的88个SARSCoV-2基因组中共发现104个snp和18个indel(图1D)。大多数变异是单例,即只在一个基因组中观察到。在鉴别出的变异中,31个SNPs和4个indels存在于2个以上的患者中(图2A)。
对截至2020年11月9日存放在GISAID上的81391个高质量公共基因组序列进行分析,其中35个snp中有29个(82.8%)来自其他大洲;一些变异(C3037T、G26144T、C8782T、T28144C、G11083T和C18060T)在欧洲、非洲、大洋洲和美国流行,表明大多数snp已经在世界范围内流行。与武汉人群的比较显示,四川和武汉都存在另外四种变体,这些复发型包括三个Indels:Δ500-532, ACC18108AT和Δ729-737;一个SNP:T13243C(图2A),表明这些变异可能是从武汉输入的,与四川患者的旅行记录一致。

图2A 在不同大陆或地区研究的35个重复遗传变异的样本百分比
值得注意的是,在Nsp1编码区有两个缺失,Δ500-532和Δ729-737,在四川观察到23例(26%)和2例(2.2%);在武汉观察到39例(24%)和4例(3%)。对Δ500-532的基因组进行了研究,发现它在系统发育树的不同簇中分布稀疏(图2B)。结果表明Δ500-532发生在多个城市,并可能从武汉多次输入,这与缺失Δ500-532的四川患者中有83.3%的人有去过武汉的旅行史相一致。
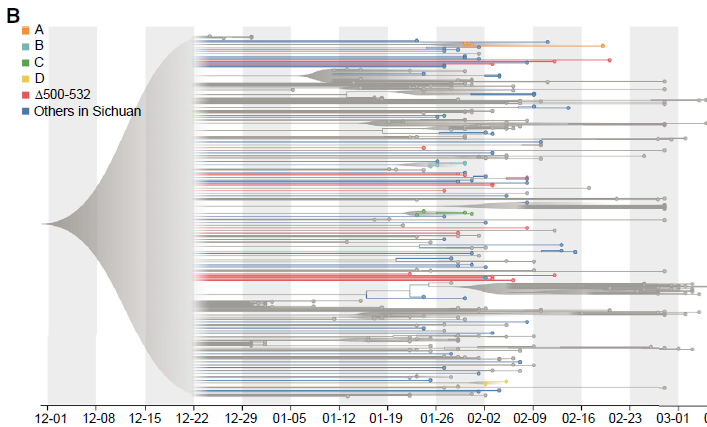
图2B SARS-CoV-2基因组系统发育分析
为了研究鉴定出的35个SARS-CoV-2复发遗传变异(31个snp和4个indel)的潜在临床意义,比较了出现严重或非严重症状的患者的临床表型,将19个严重相关表型分为(11个)严重表型和(8个)非严重表型(图3A)。
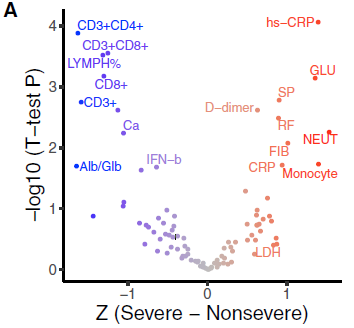
图3A 与COVID-19严重程度相关的显著特征的火山图
采用类似GSEA的分析方法,来鉴定一个突变体是否富集严重/非严重的临床表型。发现Δ500-532与ESR等严重相关表型呈负相关。基于有/没有某种变异类型,将病例分为两组,发现感染Δ500 -532病毒的患者在所有检测的35种变异中Ct值最高(图3E)。

图3D Δ500 -532的性状富集情况;
图3E qPCR检测中,有或没有某一Ct值变体的组之间的NES和p值
计算了SARS-CoV-2基因组中每个碱基对的缺失频率,Δ500-532位点是第五大最常见的缺失区域(图4A)。测序结果支持高序列深度的缺失,并通过Sanger测序验证了缺失(图4B)。从GISAID的37个国家的922例病例中,在Δ500-532位点找到了24种缺失变异(图4C)。其中62.5%和19.8%分别来自欧洲和北美(图4D),主要变种为Δ518-520 (Δ1aa), Δ518-523 (Δ2aa)和Δ509-523(Δ5aa)(图4E)。因此,研究结果显示SARS-CoV-2基因组中存在一个缺失热点,相关病例数量在全球范围内稳步上升。
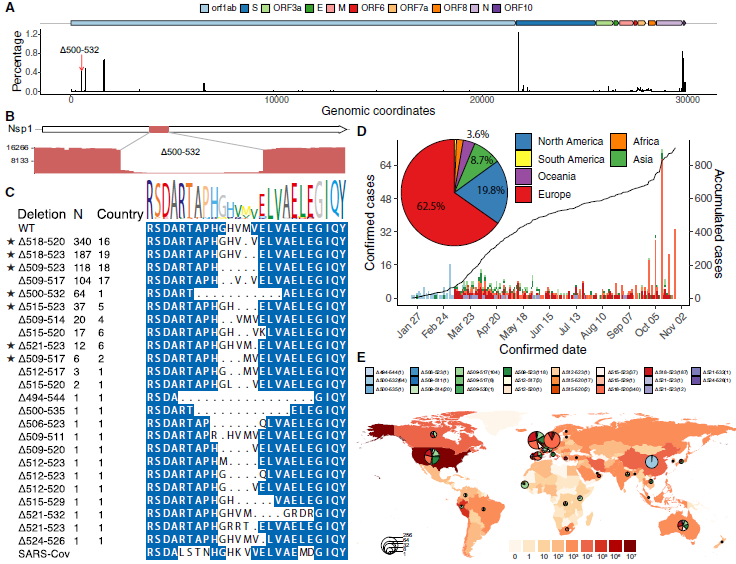
图4 SARS-CoV-2基因组Δ500-532位点缺失变异的患病率
Δ500-532导致SARS-CoV-2 Nsp1 N端A79PHGHVMVELV89缺失11个氨基酸残基,在预测的模型中,Δ500-532对应区域的残基形成一个中央β链,如果去除该β链,可能会导致桶状折叠的完全破坏(图5A)。
SARS-CoV-2 Nsp1的C端结构域与40S核糖体亚基结合并干扰mRNA的进入,但实验发现突变的SARS-CoV-2 Nsp1保留了与40S核糖体亚基的结合能力(图5B)。
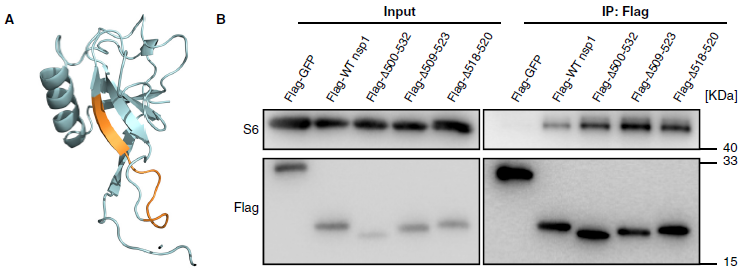
图5 A Δ500-532基因座(橙色)在SARS-CoV-2 Nsp1 N端预测三维结构上的映射;
图5 B SARS-CoV-2 Nsp1突变蛋白结合40S核糖体亚基
GO富集分析发现,与WT Nsp1相比,突变体Nsp1在生“肽的生物合成/代谢过程”,“核糖核蛋白复合生物发生”,“靶向膜/内质网的蛋白质”,“mRNA代谢过程”和“无意义介导的衰变”等方面显著上调,符合报道的SARS-CoV-2 Nsp1的功能(图5D)。
值得注意的是,与GFP对照相比,WT中编码核糖体蛋白(RPs)的mRNA代谢过程通路中的许多基因下调。相比之下,有两个缺失组表现出不同于WT更类似于GFP对照的表达模式(图5E)。这些结果表明,Nsp1中这些N端缺失可能影响其在mRNA和蛋白质代谢过程中的功能
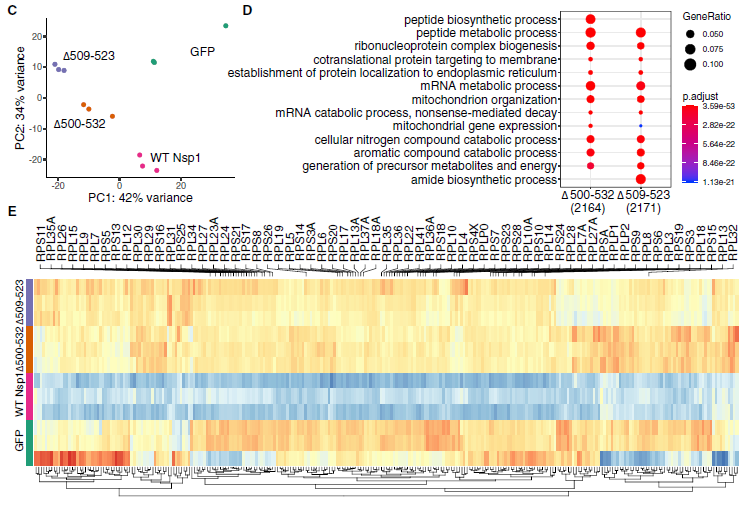
图5 C-E
由于Δ500-532在感染患者中与血清 IFN-β水平呈负相关,下一步评估缺失如何影响I型干扰素(IFN-I)应答。转染了HEK293T和A549(人肺细胞系)的细胞中,所有缺失变异均显示IFN-I反应降低。进一步进行了IFNB1启动子控制的荧光素酶报告基因检测和对转染的A549细胞进行转录组测序,系列接过说明IFN-I信号在缺失突变体中被下调。
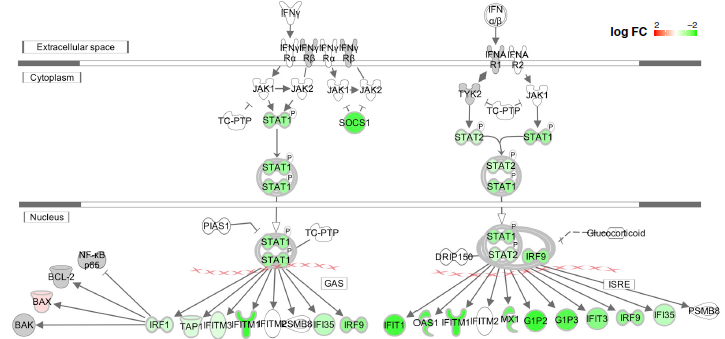
图6G 与表达WT Nsp1的A549细胞相比,Δ500-532突变体中干扰素信号通路显著下调(绿色表示下调,红色表示上调)
为了研究Nsp1缺失对SARS-CoV-2病毒的影响,我们从临床样本中分离出WT、Δ518-520 (Δ1aa)和Δ509-517 (Δ3aa) Nsp1的毒株,实验感染Calu-3细胞。实验发现,Nsp1缺失突变体具有复制能力,在Calu-3细胞中表现出与WT病毒相似的生长动力学,并诱导较低的IFN-I反应。这些结果支持在关联研究中观察到的Δ500-532与血清IFN-b降低之间的关联。
文献下载:






 京公网安备 11011302003368号
京公网安备 11011302003368号