2025年1月,空军军医大学(第四军医大学)陈志南教授、秦卫军教授、耿杰杰博士等人在学术期刊Journal for ImmunoTherapy of Cancer发表文章,题为:Spatial and single-cell transcriptomics reveal cellular heterogeneity and a novel cancer-promoting Treg cell subset in human clear-cell renal cell carcinoma。在该文章中,研究者利用百创S1000空间转录组技术、百创DG1000单细胞转录组测序技术等,探索透明肾细胞癌异质性,发现IL-18通过ERK/NF-κB通路促进一种具有强免疫抑制功能的终末效应调节性T细胞产生,其与MRC1+FOLR2+ TAM(肿瘤相关巨噬细胞)相互作用,导致患者生存率降低、肿瘤细胞免疫逃逸增加和肿瘤生长。该研究为认识透明肾细胞癌(ccRCC)Treg细胞异质性以及潜在治疗靶点提供新见解。

文章标题:Spatial and single-cell transcriptomics reveal cellular heterogeneity and a novel cancer-promoting Treg cell subset in human clear-cell renal cell carcinoma
期刊名称:Journal for ImmunoTherapy of Cancer
影响因子:10.3
合作单位:空军军医大学(第四军医大学)
研究方法:单细胞转录组测序,空间转录组测序,流式分选,RT-qPCR,Western blot,免疫组化,多重免疫组化,细胞实验。
百迈客生物为该研究提供了百创DG1000单细胞转录组测序服务以及百创S1000空间转录组技术服务,文中百创S1000空间数据分析得到的细胞空间分布图由百创开发软件BSTCellViewer展示。
研究背景
透明肾细胞癌ccRCC是肾细胞癌RCC的常见亚型,是肾癌相关死亡的主要原因,治疗手段包括肾切除手术、靶向治疗和免疫治疗,但多数患者不能从免疫治疗获益,这与肿瘤微环境异质性有关,因此有必要深入理解ccRCC的肿瘤微环境,助力开发新型个性化诊疗方案。
材料及方法
研究材料:15名肾切除术的ccRCC患者组织样本及其血液PBMC。对组织样本区域进行定义,分为肿瘤核心(TC),肿瘤-健康交界(IF,包括肿瘤边缘TR和临近健康肾组织AN),远端健康肾组织DN。
组别设计:实验组4名ccRCC患者样本进行单细胞转录组测序&空间转录组测序,验证组15名ccRCC患者样本进行流式细胞术&多重免疫荧光染色,151名ccRCC患者组织样本&40名其他肾癌亚型患者组织样本&6名捐献者健康肾组织进行多重荧光免疫组化染色。
研究方法:单细胞转录组测序(4名患者不同区域肿瘤组织,按照CD45+细胞:CD45-细胞=9:1增加免疫细胞数据占比,n=12),空间转录组测序(n=4);流式分选,RT-qPCR,Western blot,免疫组化,多重免疫组化,细胞实验。
研究结果
1.ccRCC组织细胞类型全面分析
单细胞转录组测序(scRNA-seq)数据显示不同患者肿瘤组织的免疫微环境细胞组成相似,T细胞占比最高,特别是CD4+ T细胞。肿瘤区域(TC/TR)富集CD3+细胞以及CD8+ T细胞,而CD4+ T细胞基本分布在所有区域。此外,基质细胞和免疫细胞丰度和分布存在差异,TR区域成纤维细胞比例显著低于TC区域和AN区域,这一发现也在空间转录数据中得到印证。
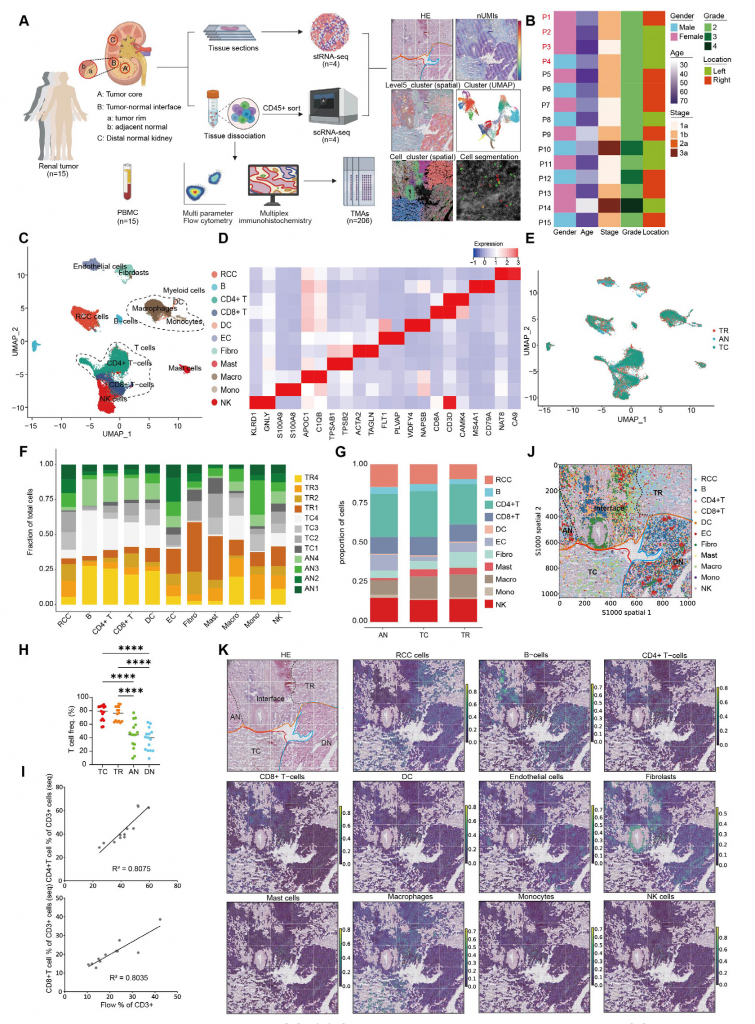
图1-ccRCC组织中细胞群的全面分析
2.ccRCC细胞元程序的丰度以及异质性
通过非负矩阵因子分解分析每个样本scRNA-seq数据,得到可以代表ccRCC肿瘤细胞簇元程序的6个基因集,不同基因集代表着不同的程序,如基因集1代表着EMT(上皮-间充质转变)相关基因表达谱,基因集5也与EMT相关但与基因集1不同的是其包含VEGFA等。
进一步分析,发现ccRCC亚群0~4簇与不同基因集表达谱匹配,5和6簇不与任何基因集匹配但具有细胞周期和应激响应相关基因表达。RCC0簇和RCC2簇代表EMThigh肿瘤细胞并在IF区域富集,RCC1簇代表PT(近曲小管)细胞,拟时序分析结果显示存在RCC0—>RCC2分化关系,但RCC2几乎只在P2患者样本中发现,表明RCC2可能与个别患者特征相关。RCC1、RCC3和RCC4细胞主要在组织而不是肿瘤区域富集,RCC4主要分布在AN和DN区域,RCC4在AN区域分布数量高于DN区域。RCC4高表达细胞因子受体基因,表明TME中分泌的促肿瘤细胞因子可能倾向于作用到RCC4,增加其转变成癌细胞的概率,加速肿瘤逃逸,促进肿瘤恶性化,与以往瘤旁附近不是完全的健康组织认识相符合。
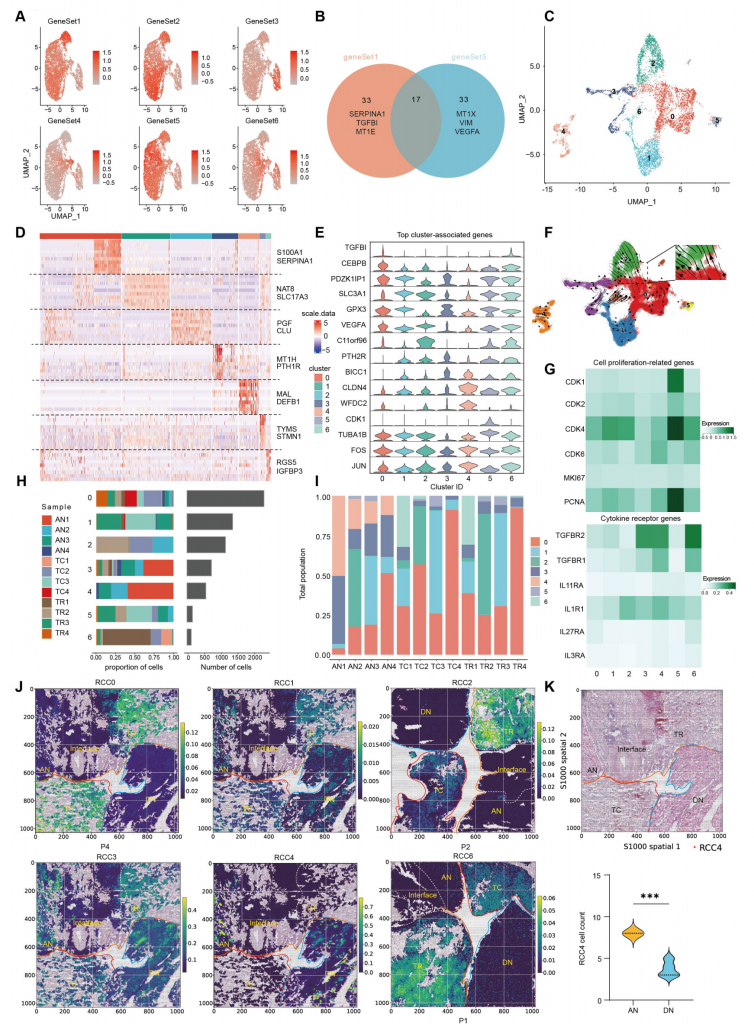
图2-透明细胞RCC细胞元程序的丰度及异质性
3.ccRCC基质细胞的区域化特征和异质性
scRNA-seq与空间数据均显示,ccRCC存在8种激活的成纤维细胞簇,肿瘤区域成纤维细胞数量高于健康组织,其中CD24+IL32+成纤维细胞显著富集在肿瘤区域,PTGDS+成纤维细胞几乎全分布在AN,高表达ECM(胞外基质)形成和EMT的成纤维细胞簇在IF较为富集,IL1R1+ CAF(肿瘤相关成纤维细胞)表现出肿瘤促进表型;7种EC(内皮细胞)簇中4种(0,2,3和6)主要富集在肿瘤组织,3种(1,4和5)在健康组织富集,胶原蛋白EC(0簇)丰度最高,具有促肿瘤特征。总之,不同的ECM蛋白质产生基质细胞倾向于富集在IF并共定位,可能行驶多种功能,包括细胞-细胞交互和胞外组分重构。
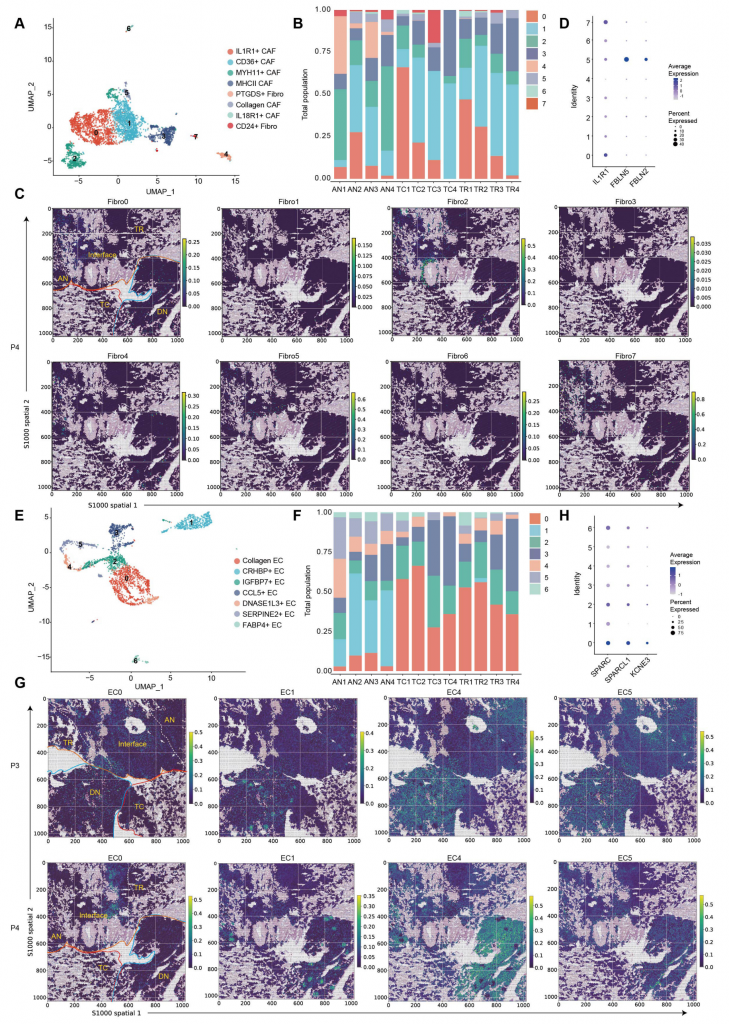
图3-透明细胞肾细胞癌中基质细胞的区域特征和异质性
4.ccRCC中MRC1+FOLR2+ TAM倾向于表现出更强的促癌表型
scRNA-seq数据与空间数据均显示,4种TAM簇具有不同分布趋势,TAM1主要分布在TC区域;TAM2高表达FOLR2、MRC1和CD163,可能是M2样巨噬细胞且具有增强的免疫抑制特征,TAM4是组织驻留巨噬细胞,两者主要分布在TR区域;TAM3表达炎症响应相关基因,在TR和AN区域富集。RNA速率分析显示存在TAM4—>TAM2—>TAM1和TAM4—>TAM3两种轨迹,以及从IF区域迁移到TC区域的趋势。进一步的功能分析显示,IF区域的TAM2可能通过促进EMT,TC区域的TAM2可能通过促进肿瘤血管生成,起到促癌效应。总之,TAM2不同的肿瘤促进效应可能与免疫抑制TME有关。
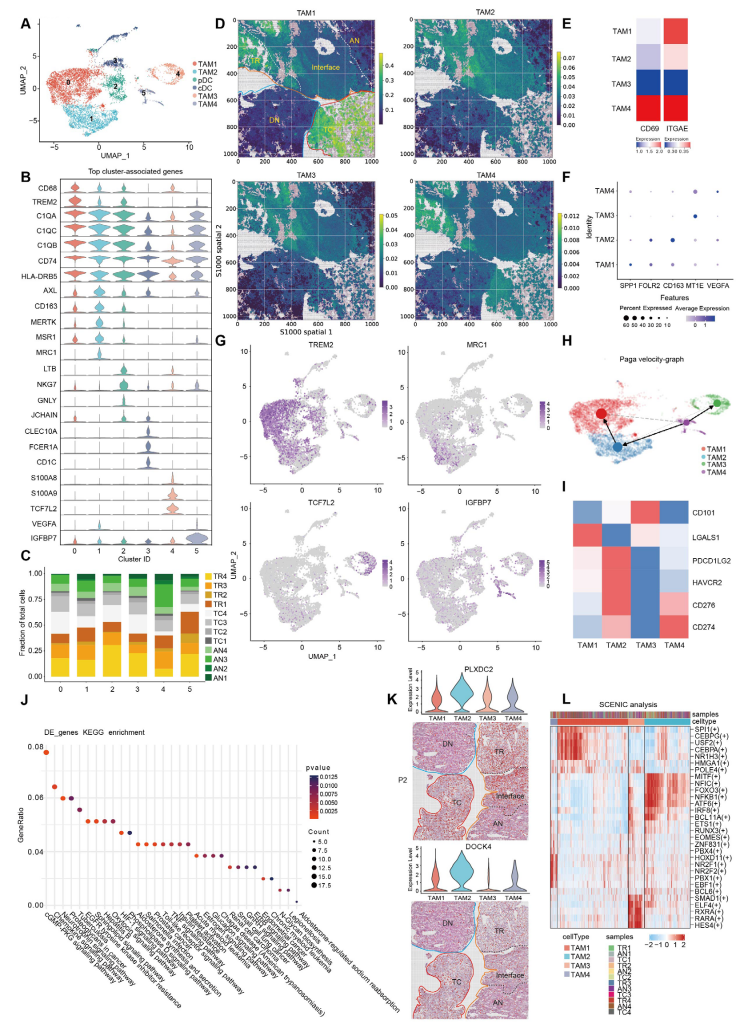
图4-透明细胞肾细胞癌中MRC1+FOLR2+ TAM倾向于表现更强的促癌表型
5.单细胞分析揭示ccRCC中存在表达IL1B的Treg
进一步分析CD4+ T细胞簇,发现存在CD4+ 初始T细胞、Treg和滤泡样辅助T细胞,不同簇的特征基因和空间分布模式不同,IF区域富集CD4+ 初始T细胞和PDE3B+ CD4+ T细胞,肿瘤区域富集Treg。其中,TC/TR区域CTLA-4+ Treg的占比以及Treg的FoxP3蛋白表达水平高于AN/DN区域,而CTLA-4+FoxP3- Treg在所有组织中的分布较为均匀,表明肿瘤区域Treg细胞具有更强的免疫抑制功能。
进一步分析Treg细胞簇,发现存在6种亚型,其中终末效应Treg细胞(5)主要分布在IF区域,FOXP3表达水平较低且ICOS表达水平降低,表明细胞可能处于不稳定状态。
此外,终末效应Treg细胞表达炎症性细胞因子如IL1B,IL18和IL7,验证队列的多重免疫荧光染色结果显示IL-1β+终末效应Treg是对ccRCC特异性肿瘤微环境信号的特异性响应。发现肿瘤组织中存在表达炎症性细胞因子IL1B的终末效应Treg细胞。
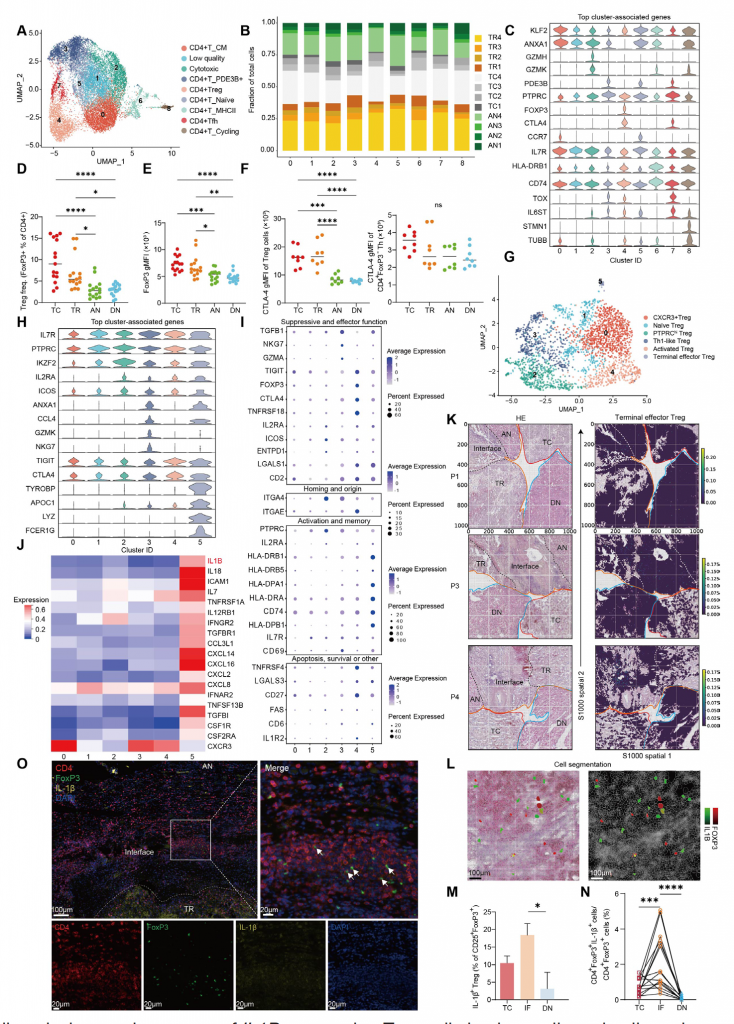
图5-单细胞分析揭示透明细胞肾细胞癌存在表达IL1B的Treg细胞群
6.IL-18通过ERK/NF-κB通路促进强免疫抑制功能的终末效应Treg细胞产生
空间转录组数据结果显示不同Treg细胞100μm范围内激活的CD4+/CD8+ T细胞数量较少,终末效应Treg细胞100μm范围内CD4+/CD8+ T细胞数量更少,表明终末效应Treg细胞周围应答Treg细胞(Tresp)增殖受到更强的抑制。细胞共培养实验表明终末效应Treg细胞具有强免疫抑制功能。RNA速率分析结果表明效应终末Treg可能由初始Treg细胞分化而来,体外实验表明IL-18可刺激CD4+CD25+ Treg细胞上调IL-1β表达,表明终末效应Treg细胞产生和作用可能与IL-18有关。ERK激活剂/NF-κB激活剂促进IL-18+ Treg细胞的产生,IL-18处理后Treg细胞ERK/NF-κB磷酸化水平增加,ERK抑制剂可抑制Treg细胞表达NF-κB但NF-κB抑制剂无法抑制ERK表达,综上,这些结果表明IL-18可能通过ERK/NF-κB通路介导终末效应Treg细胞的产生。
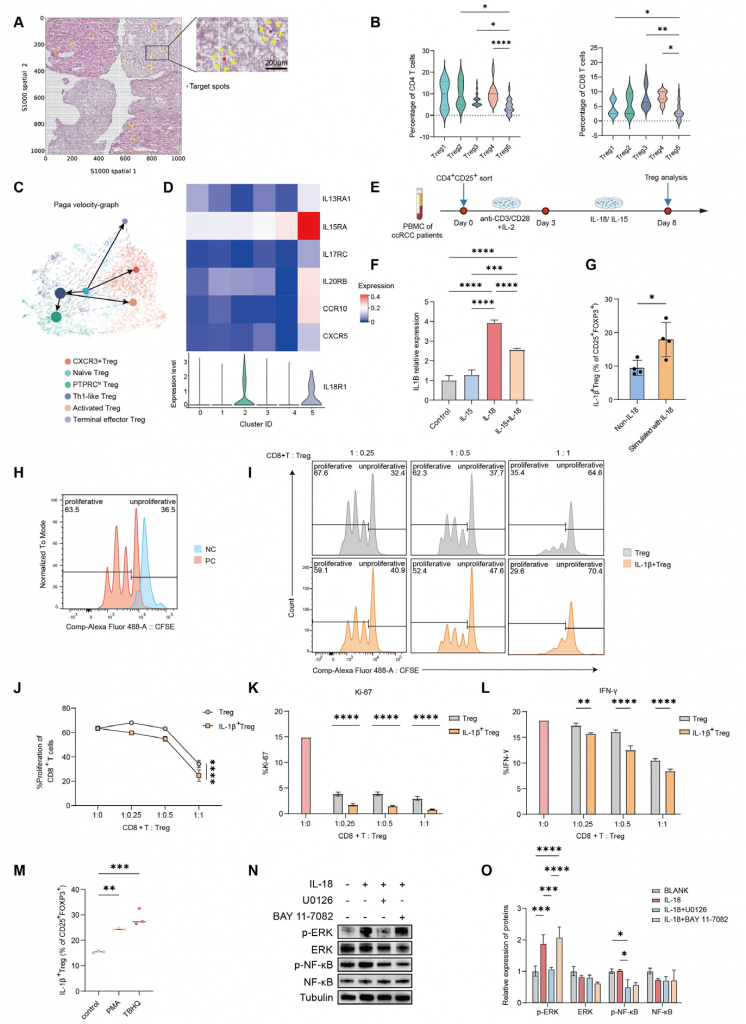
图6-IL-18通过ERK/NF-κB通路促进具有强免疫抑制功能的终末效应Treg细胞产生
7.通过与MRC1+FLOR2+ TAM互作,终末效应Treg细胞与存活率降低、免疫逃逸增加及肿瘤生长相关
确定终末效应Treg细胞标志基因(FOXP3、IL1B和FCER1G),TGCA泛癌数据库数据分析结果显示,终末效应T细胞浸润高的队列与更低的整体存活率相关。细胞通讯分析结果显示,巨噬细胞与终末效应Treg细胞有着最多的互作配体-受体对,许多是免疫抑制互作,验证实验支持终末效应Treg细胞与TAM2簇之间存在相互作用;IL1R1+ CAF与终末效应Treg细胞也存在潜在联系。仅在TC区域(与TR区域相比)发现NAMPT-INSR和TGFB1-(TGFBR1+TGFBR2)配受体互作,体外实验发现终末效应Treg细胞LRRC32(该基因编码的GARP是TGF-β1成熟和激活所必须的)表达水平高于传统Treg细胞。
此外,巨噬细胞特别是TAM2高表达IL18。这些结果可能表明ccRCC肿瘤微环境中,IF区域终末效应Treg细胞与临近TAM2互作,通过分泌的TGF-β1、M-CSF1以及IL-10,将IF驻留的TAM转变成促癌表型,引起肿瘤细胞EMT;TAM2分泌的趋化因子诱导Treg细胞迁移到肿瘤区域并过表达IL-18,将Treg细胞转变成IL-1β+ 终末效应T细胞,抑制T细胞免疫并促进肿瘤生长。
总之,这些结果表明ccRCC的IF区域,终末效应Treg细胞可能与其他促癌细胞互作,最终促进肿瘤细胞恶性转化,支持了终末效应Treg细胞具有免疫抑制和促癌作用的假设。
研究结果
该研究系统描述了ccRCC中不同类型细胞的基因表达谱和空间分布规律,发现一种具有癌症促进作用的新Treg细胞亚型,在肿瘤-健康组织交界区域与MRC1+FOLR2+ TAM互作,构建免疫抑制TME,促进肿瘤细胞恶性转化最终引起患者存活率降低。同时,这些发现也为开发新的药物和预后标志物提供了靶点。
参考文献:
Song X, et al. Spatial and single-cell transcriptomics reveal cellular heterogeneity and a novel cancer-promoting Treg cell subset in human clear-cell renal cell carcinoma. J Immunother Cancer. 2025 13(1):e010183.






 京公网安备 11011302003368号
京公网安备 11011302003368号