号外!号外!号外!
ONT全长转搭上代谢组带你玩出不一样的高度,且看全长转录组如何推陈出新。百迈客合作单位于2021年4月9日在J Agric Food Chem杂志上发表关于全长转录组在Zucker糖尿病的应用,下面一起来欣赏该文详细解析。

英文题目:1H NMR Metabolomics and Full-Length RNA-Seq Reveal Effects of
Acylated and Nonacylated Anthocyanins on Hepatic Metabolites and Gene Expression in Zucker Diabetic Fatty Rats
发表杂志:J Agric Food Chem
影响因子:4.192
发表时间:2021年4月9日
原文链接:https://pubs.acs.org/doi/10.1021/acs.jafc.1c00130
摘要
花色苷是植物中的一大类多酚化合物,目前已知是对氧化应激、炎症和能量稳态有调节作用。已有报道发现花色苷具有抗糖尿病的疗效。花色苷的核心结构是花青苷,它可以糖基化形成非酰化的花青苷,糖苷可以酰化后形成酰化的花青苷。且最近有研究表明,与未酰化的花青苷相比,酰化花青苷具有更好的稳定性和抗氧化活性。本研究利用全长转录组学和核磁共振代谢组学方法,比较了非酰化和酰化花色苷对糖尿病大鼠肝脏基因表达和代谢的影响。这是第一次综合应用这两种强大的技术来研究肝脏基因表达和代谢产物的变化。
实验设计
以喂养高脂饲料的雄性ZDF大鼠(fa/fa)作为2型糖尿病模型,瘦型且健康的 Zucker大鼠(fa/+)作为健康对照。干预8周后,禁食12h,异氟醚麻醉下处死。测量肝脏、附睾脂肪质量及其占体重的百分比。肝脏立即在液氮中冷冻,并储存在−80°C下。
注:NAAB:蓝莓非酰化花色苷提取物;AAPP:紫色马铃薯酰化花色苷提取物
实验技术
用代谢组学方法检测NAAB和AAPP对ZDF大鼠肝脏代谢产物的影响,并用ONT全长转录组方法研究其基因表达的变化。(ONT全长转录组测序由百迈客协助完成)
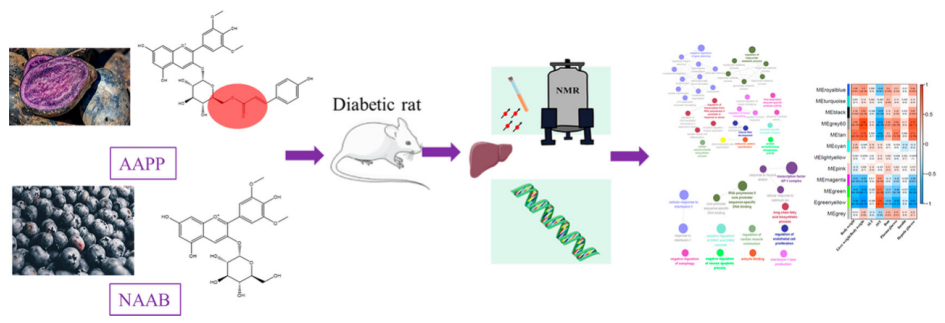 实验设计思路
实验设计思路
测序平台
Nanopore ,1H NMR
文章结果
1、肝脏、附睾脂肪重量及不同组别DETs、DEGs的统计分析
表1中可见,M组的肝脏和附睾脂肪重量及其占体重的百分比显著高于CON组和ND组(p<0.05)。CON组的大鼠肝脏重量和肝/体比明显高于ND组(P<0.05)。H-AAPP组大鼠肝/体重比明显低于M组(p<0.05)。
对全长转录组数据进行分析发现,在6个不同组之间的差异分析结果中,健康对照组和糖尿病模型之间有691个上调和1098个下调的DEGs,2469个上调和2483个下调的DETs (图1A和B)。与M组相比,H-AAPP处理改变了最多的基因和转录本(101个上调和179个下调的DEGs,89个上调和780个下调的DETs)。DEGs和DETs的热图显示,ND组和CON组在基因表达模式上与M组有很大不同,而且H-AAPP组的转录组图谱似乎比M组更接近ND组和CON组(图1C和D)。
高水平的肝脏重量和肝脏重量/体重比提示脂肪肝的发展。H-AAPP降低了这些水平,表明脂肪肝的状态可能有所改善。与M组相比,H-AAPP组表现出最多的DEG和DET数,并且在转录水平上与CON和ND组属于同一簇。因此,H-AAPP对ZDF大鼠可能起到最有益的作用。
表1.蓝莓和紫色马铃薯花色苷对喂饲不同实验饮食的瘦型Zucker大鼠(fa/+)和肥胖型Zucker大鼠(fa/fa)体重、肝脏质量、附睾脂肪及其占体重百分比的影响
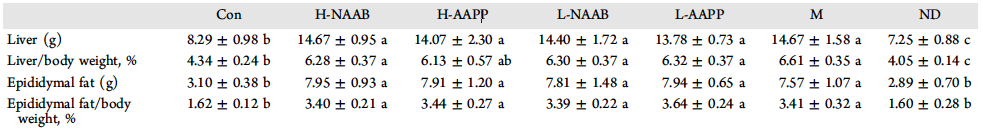
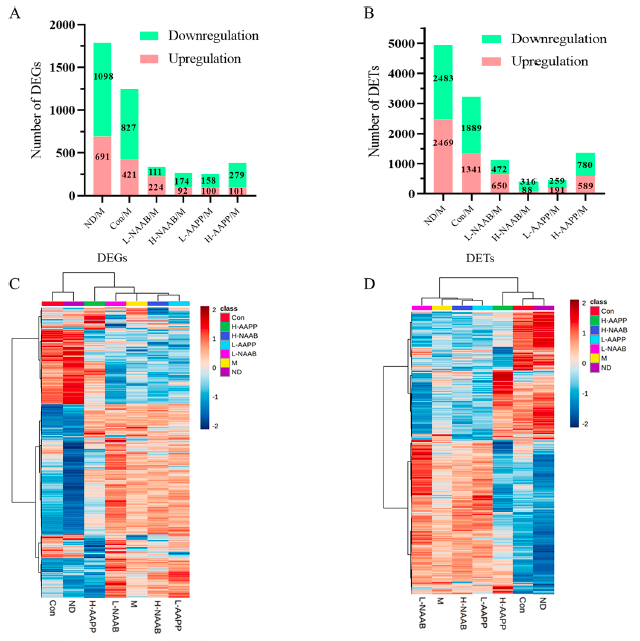
图1 DEGs(AC)及DETs(BD)的统计分析
2、ZDF大鼠中花色苷提取物对基因的修复作用
韦恩图表明了不同分组之间上调和下调的DEG的交集,揭示了受NAAB和AAPP影响的特定基因(图2A−D)。Gstm6与谷胱甘肽代谢、药物代谢以及细胞色素P450对外源物质的代谢有关,在胰岛素抵抗和糖尿病小鼠中均被报道下调,并可能参与T2D的进展。L-NAAB和H-NAAB均能恢复Gstm6的表达。与ND组和Con组相比,M组中有一个共同的基因被两种花色苷提取物(NAAB和AAPP)上调,即编码N-乙酰氨基葡萄糖转移酶GnT-4a的Mgat4a。在小鼠中,Mgat4a基因的遗传失活导致葡萄糖转运蛋白2N-聚糖的错误组装,导致葡萄糖转运蛋白2和质膜凝集素Galectin 9之间的相互作用失败,导致葡萄糖转运蛋白2内化,从而抑制葡萄糖摄取和葡萄糖刺激的胰岛素分泌。还发现高脂饮食抑制了Mgat4a的表达。蓝莓的非酰化花色苷和紫色马铃薯的酰化花青苷都是如此。编码脂蛋白脂肪酶的LPL在小鼠肝脏中过表达,导致肝脏甘油三酯含量增加2倍,并导致胰岛素抵抗,部分原因是对胰岛素的反应受损,抑制内源性葡萄糖的产生。在本研究中,L-NAAB和H-NAAB都下调了ZDF大鼠高水平的LPL,这可能导致胰岛素敏感性的改善。早期生长反应基因-1(Egr1)可被胰高血糖素短暂激活,介导胰高血糖素调节的糖异生。AAPP降低Egr1,这可能与糖异生减少有关。
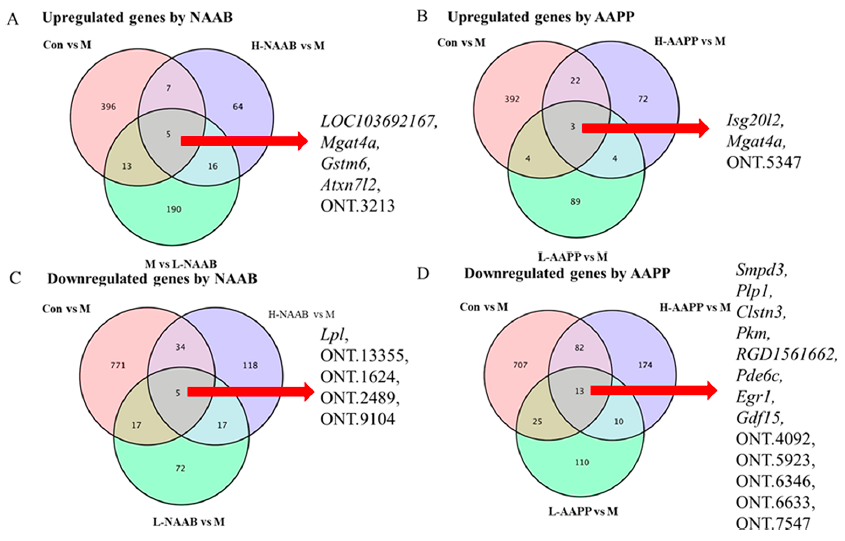
图2.不同分组差异基因韦恩图
3、构建PPI网络图
基于差异分组的DEGs构建PPI网络图,以揭示具有高度连接性的关键基因(图3A−F)。
在CON/M比较中,发现FASN、Acly、AcacA和Srebf1是增加的关键中心基因。FASN、Acly和AcacA是Srebf1编码的甾醇调节元件结合蛋白1(SREBP-1)的靶基因。这些基因的表达是脂肪酸合成所必需的,而在M组,脂肪酸合成增加了。发现M组与CON组和ND组相比,有3个关键中心基因增加,分别是GAPDH、Src和ESR1。3-磷酸甘油醛脱氢酶(GAPDH)的活性在糖尿病中明显受到干扰,Src作为肝脏葡萄糖产生的重要协调者,可以通过G蛋白偶联受体(GCPRs)、转化生长因子-β(TGF-β)和活性氧(ROS)在2型糖尿病中被激活。因此,ZDF大鼠可能具有脂肪酸合成活跃和低糖的特征。Fos和Jun是转录调节因子激活蛋白1(AP-1)的两个亚基。AP-1的活性可以受到各种刺激的调节,包括应激信号、细胞因子、感染和生长因子。AP-1在ZDF大鼠中的表达增加是因为氧化应激可以激活Jun氨基末端激酶(JNK)并进一步正向调节AP-1,而抑制JNK可改善糖尿病小鼠的糖耐量和胰岛素抵抗。在结果中,M组的Jun比ND组增加,AAPP提取物显著下调了Jun和Fos的表达。大剂量蓝莓花色苷提取物(HNAAB)也下调了Jun的表达。与NAAB提取物相比,AAPP提取物可能具有更好的调节AP-1、缓解胰岛素抵抗和改善糖耐量的能力。
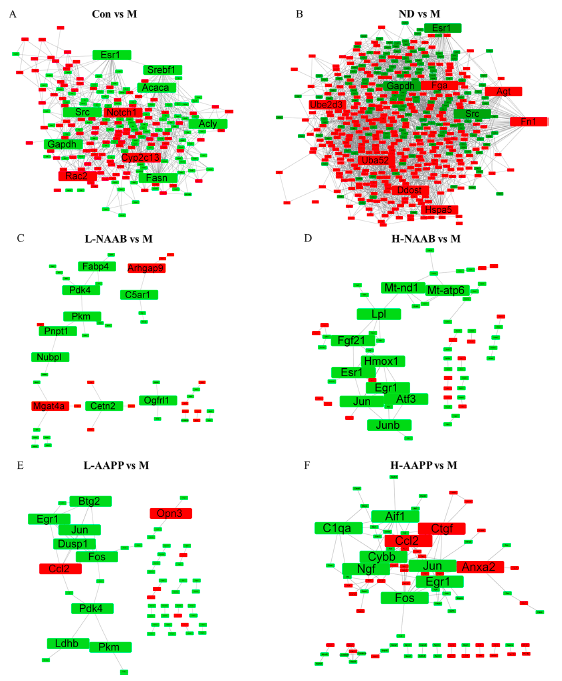
图3.DEGs生成的PPI网络图
4、基于ClueGO分析的功能注释网络分析
对不同分组中的DEGs进行ClueGO分析,以生成按功能分组的注释网络图(图4A−F)。在CON/M差异分组的结果中,DEGs主要富集在羧酸生物合成过程、单羧酸代谢过程和对其他有机物的反应过程。在ND/M分组差异结果中,脂肪酸代谢过程、羧酸代谢过程和对有机物的反应过程是富集排名前3的功能分组。在ND/M和CON/M分组中,DEGs主要在单羧酸代谢过程、羧酸生物合成过程、脂肪酸代谢过程、脂肪代谢过程和对有机物的反应过程相关的通路中富集。在L-NAAB/M分组差异结果中,DEGs组要与三个功能通过有关:质膜组织、感觉调节和细胞对脂肪酸的反应。在H-NAAB/M差异结果中,DEGs主要富集于基因沉默的负调控、甘油三酯代谢过程的调控以及RNA聚合酶II启动子对胁迫反应的转录调控。在L-AAPP/M比较中,DEGs在甘油三酯分解代谢过程、骨骼肌细胞分化和轴规范方面都明显富集。在H-AAPP/M差异结果中,发现转录因子AP-1复合体、细胞对白细胞介素-1的反应以及RNA聚合酶II核心启动子序列特异性DNA结合等通路显著富集。
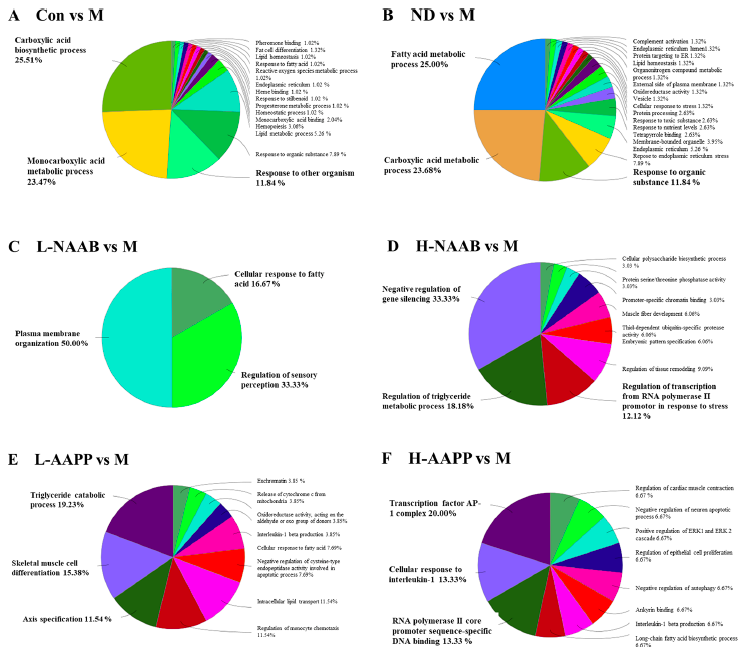
图4.DEG富集的GO注释网络图
5、KEGG通路富集分析
接下来,进行了KEGG通路富集分析。气泡图展示富集最显著的前20条通路(图5A−F)。与M组相比,Con组上调的DEGs主要富集于以下通路:苯丙氨酸、酪氨酸和色氨酸的生物合成,亚油酸代谢,金黄色葡萄球菌感染,补体和凝血级联反应,以及甲型流感病毒。ND组与M组相比,上调的DEGs主要富集在花生四烯酸代谢、金黄色葡萄球菌感染、移植物抗宿主病、吞噬小体等通路中,而ND组与M组相比上调的DEGs主要富集在以下通路:苯丙氨酸、酪氨酸和色氨酸的生物合成、亚油酸代谢、金黄色葡萄球菌感染、移植物抗宿主病、吞噬小体。在CON/M和ND/M比较中,下调的DEGs在相似的KEGG通路中富集:不饱和脂肪酸的生物合成、脂肪酸代谢、丙酮酸代谢、脂肪酸伸长、氧化磷酸化和碳代谢。
对于花色苷处理组,L-NAAB组上调的DEGs在N-糖链生物合成通路中显著富集。L-NAAB组下调的DEGs在泛酸和CoA生物合成通路中显著富集。在H-NAAB、L-AAPP和H-AAPP组中没有发现下调的DEGs有显著富集的通路,在H-NAAB和L-AAPP组中上调的DEGs也没有富集的通路。H-AAPP中上调的DEGs在补体和凝血级联、不饱和脂肪酸和变形虫病的生物合成等通路中显著富集。
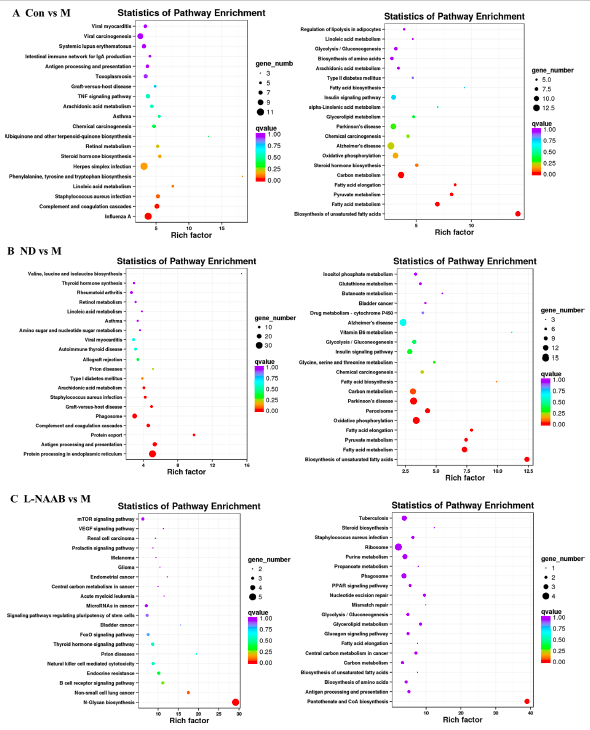
图5.不同分组中差异基因KEGG通路富集图(部分展示)
6、利用代谢组检测代谢物及相关基因的表达
为了从代谢物水平上研究这些花青苷提取物对糖尿病ZDF大鼠肝脏的影响,进行了1H NMR代谢组学研究。糖酵解代谢产物–肝葡萄糖、乳酸、丙氨酸和丙酮酸在M组升高。这可能反映了2型糖尿病患者糖酵解过度。此外,乳酸、甘油、丙氨酸和谷氨酰胺是主要的糖异生前体,占总糖异生的90%以上。结果表明,与对照组(CON和ND)相比,M组的糖酵解和糖异生水平升高。各花色苷处理组大鼠的血糖、乳酸、丙氨酸、丙酮酸和甘油水平均降低,而酰化花色苷(AAPP)处理组还降低了谷氨酰胺水平,表明花色苷提取物降低了肝脏葡萄糖产量,改善了糖酵解和糖异生代谢(图6A)。
GCK编码的葡萄糖激酶和PKLR编码的肝丙酮酸激酶是糖酵解过程中催化不可逆步骤的关键酶。GCK和葡糖激酶蛋白水平均降低。NAAB增加了GCK的表达,表明其作为葡糖激酶激活剂的潜在作用。AAPP显著降低PKLR的表达,提示AAPP可能降低糖尿病大鼠的糖酵解(图6B−C)。肝糖异生中的两种限速酶是编码G6PC(编码葡萄糖6-磷酸酶催化亚基)和Pck1(编码磷酸烯醇式丙酮酸羧激酶)。L-AAPP、H-AAPP和H-NAAB显著降低肝脏中G6pc的表达,这与先前的qPCR结果一致,H-AAPP显著降低了Pck1的表达。H-NAAB和AAPP在基因表达水平调控糖尿病糖酵解和糖异生。
然而,ZDF大鼠中谷氨酰胺/谷氨酸比值对花青苷提取物无反应(图6D),但L-AAPP和H-AAPP降低谷氨酰胺和谷氨酸,H-NAAB降低谷氨酸(图6E)。与M相比,所有花青苷处理组的二甲基甘氨酸升高的水平都被逆转到正常状态(图6F)。与M组相比,编码甜菜碱-同型半胱氨酸S-甲基转移酶的BHMT均降低。在脂质代谢产物方面,L-AAPP组和H-AAPP组的肝脂谱略有改善,表现为脂肪酸残留量、包括ω-3脂肪酸在内的不饱和脂肪酸和Ara+EPA的下降趋势(图6G−H)。M组显示出总体脂质谱增加,如高水平的磷脂、甘油三酯、脂肪酸和不饱和脂肪酸,所有这些都有助于脂肪肝的发展。L-AAPP和H-AAPP组通过调节脂肪酸残基和不饱和脂肪酸略有改善肝脂代谢。
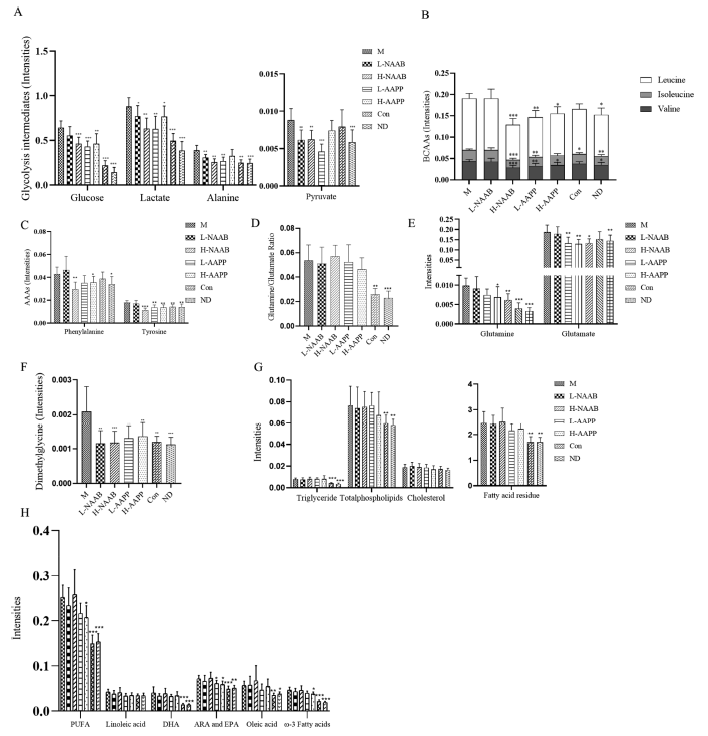
图6 NAAB和AAPP处理对ZDF大鼠肝脏代谢产物的影响
7、WGCNA分析
使用DEGs进行WGCNA分析以确定共表达模块及其与临床特征的相关性。确定了12个共表达模块,并与以前报道的各种临床特征(体重、AST、ALT、血尿素氮、血糖和胰岛素)相关(图7A)。MEgery 60和MEtan模块与体重、肝重/体重比、血糖、肝糖呈正相关,与天冬氨酸转氨酶呈负相关。MEgreen和MEgreenyellow模块与体重、肝重/体重比、血糖、肝糖呈负相关,与AST值呈正相关。
接下来,对MEgrey60和MEtan模块以及MEgreen和MEgreenyellow模块中的基因进行了KEGG通路富集分析。结果发现MEgrey60和MEtan中的基因富集的通路主要涉及脂类代谢(脂肪酸代谢、不饱和脂肪酸的生物合成、脂肪细胞脂解的调节)、氨基酸代谢(甘氨酸、丝氨酸和苏氨酸代谢、半胱氨酸和蛋氨酸代谢、谷胱甘肽代谢)、糖尿病(青少年成熟期糖尿病、II型糖尿病、I型糖尿病、胰岛素信号通路)(图7B)。MEgreen和MEgreenyellow模块中的基因主要富集在花生四烯酸代谢、视黄醇代谢、代谢途径、蛋白质输出、内质网蛋白质加工、类固醇激素生物合成、补体和凝血级联、亚油酸代谢以及TRP通道的炎症介质调节(图7C)。
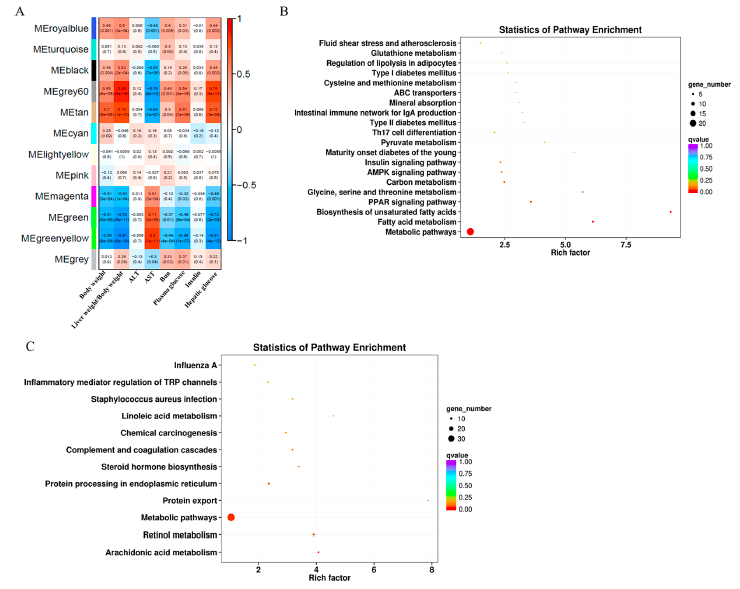
图7相关性热图及KEGG通路富集分析
总结
综上所述,本研究首次对紫色马铃薯酰化花色苷和蓝莓非酰化花色苷对ZDF大鼠肝脏代谢的影响进行了多组学分析。在所有花色苷处理组中,高剂量马铃薯花色苷(H-AAPP)处理组的转录和代谢特征更接近瘦型Zucker大鼠。发现两种花色苷提取物,尤其是AAPP,都通过恢复糖酵解相关基因的表达和代谢产物,在基因表达水平上降低AP-1的表达,从而起到有益的作用。
总体而言,本文的研究表明,紫色马铃薯中的酰化花色苷是一种廉价的花色苷来源,与蓝莓中的非酰化花色苷相比,紫色马铃薯中提取的酰化花色苷对肝脏转录和代谢谱有更好的调节作用。
https://international.biocloud.net/zh/article/detail/33835816
(复制链接到浏览器获取原文,如果没有云平台账号需要先注册)







 京公网安备 11011302003368号
京公网安备 11011302003368号