导读
结果:相比对照组,NEC患儿母亲母乳中HMO和DSLNT浓度显著降低。MOM阈值为241nmol/ml对NEC的敏感性和特异性为0.9。NEC发病前的宏基因组测序显示,NEC患儿Bifidobacterium longum相对丰度降低,Enterobacter cloacae相对丰度升高。低MOM DSLNT影响微生物组的纵向发展,这与过渡到以双歧杆菌为主的早产儿肠道菌群类型的减少有关,通常在年龄大一些的婴儿中观察到。疾病前HMO和宏基因组数据结合随机森林分析区分婴儿健康或是NEC准确度为87.5%。
总结:这些结果证明了HMO和肠道微生物在早产儿健康和疾病中的重要性。这一发现为生物标志物的发展、疾病风险分层和补充新途径提供潜在靶点,可预防危及生命的疾病。
英文题目:Human milk oligosaccharide DSLNT and gut microbiome in preterm infants predicts necrotising enterocolitis
中文题目:母乳寡聚糖DSLNT和早产儿肠道微生物预测坏死性小肠结肠炎
期刊:Gut
IF:19.819
作者:Andrea C Masi
原文链接:https://gut.bmj.com/content/early/2020/12/15/gutjnl-2020-322771.long
材料与方法
研究结果
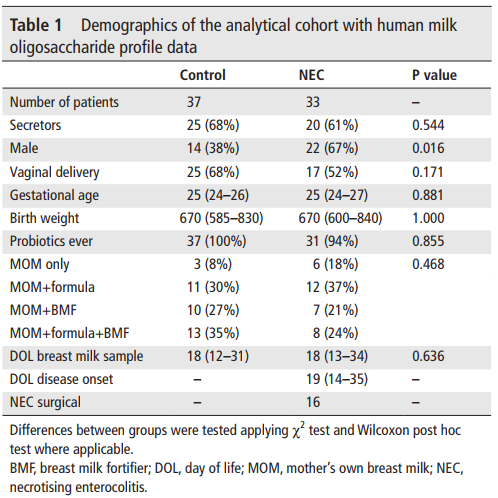
考虑到较低的DSLNT与NEC相关而不受分泌状态的影响,作者探讨了HMO作为NEC发育的生物标志物的用途。单因素ROC曲线分析表明,241nmol/ml是MOM中DSLNT鉴别NEC和对照婴儿的最佳浓度(图1C和D)。AUC值为0.947,灵敏度为0.9,特异性为0.9。
为了检验整合额外的HMO是否可以提高分类性能,利用增加的HMO数量建立了多变量ROC曲线。然而额外的HMO与DSLNT整合多变量模型中,与仅使用DSLNT的单变量模型相比性能相似。
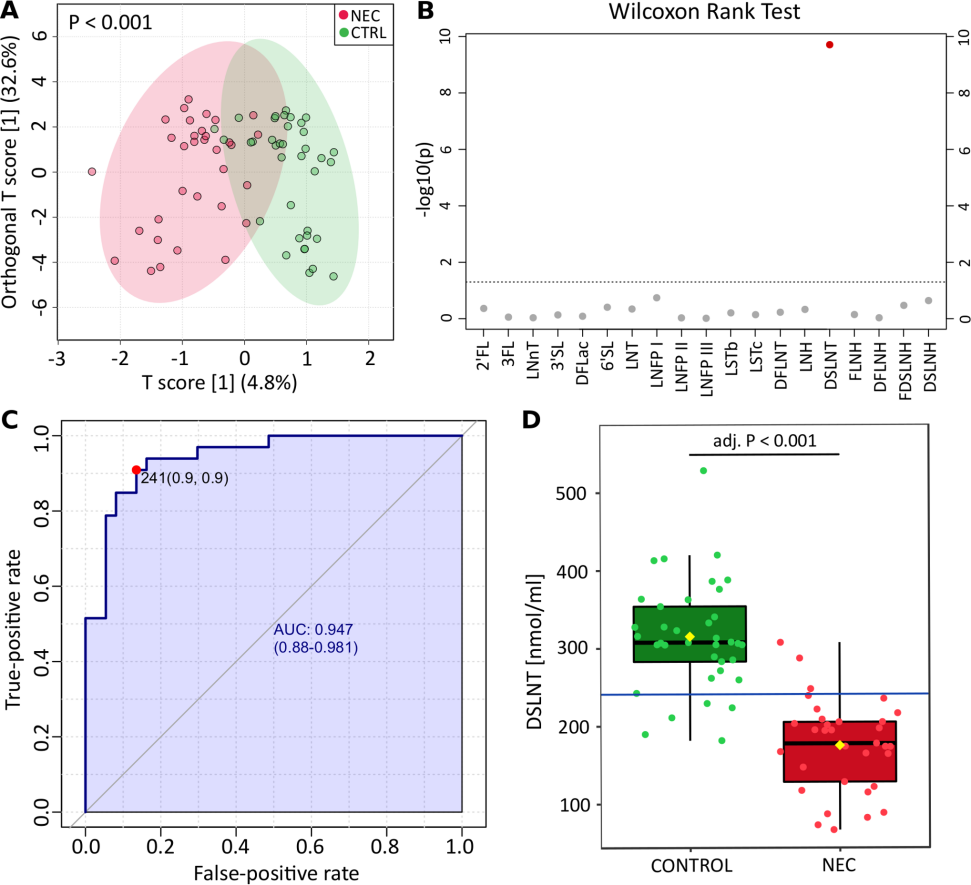
图1 NEC和CTRL组HMO图谱和DSLNT浓度分析
2、按NEC类型分层的HMO图谱分析
作者比较了未接受手术的NEC-M和接受手术的NEC-S。NEC-M和NEC-S聚类到一起与对照组分离(图2A)。两种HMOs显著不同,与对照组相比NEC-M和NEC-S组的DSLNT均较低(图2B)。此外,与NEC-M组和健康对照组相比NEC-S组MOM中LNnT显著降低(图2C)。
作者随后通过调整线性模型研究了DSLNT和LNnT浓度与临床变量之间的潜在关联。DSLNT与两种疾病类型呈负相关,NEC-M的系数值为-0.60,NEC-S的系数值为-0.67(图2D)。然而根据调整后的线性模型LNnT与疾病类型无关。分泌型母亲中DSLNT和LNnT均显著较高。母亲的DSLNT与胎龄呈正相关,与出生体重呈负相关。HMO与母亲性别、分娩方式、胎龄和DOL均无相关性(图2D)。
图2 NEC-M和NEC-S分层的HMO图谱分析
3、婴儿肠道微生物组与NEC发育的关系
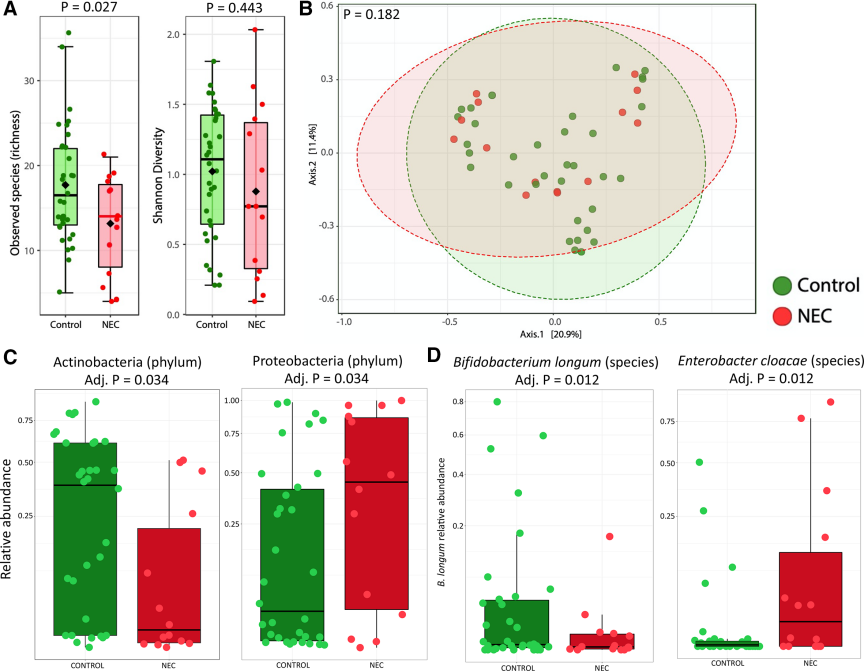
作者纳入了含有HMO数据的婴儿的粪便微生物组数据,进行独立研究获得宏基因组测序数据。14例NEC患儿和34例对照组的644个粪便样本。NEC患儿物种丰富度显著降低,shannon指数差异不显著(图3A)。PCoA分析显示NEC和对照之间细菌菌群结构差异不大(图3B)。门水平分析显示,相比于对照组NEC患儿Actinobacteria 相对丰度显著降低,Proteobacteria 相对丰度显著升高(图3C)。种水平分析相比于对照组NEC患儿B. longum相对丰度降低,Enterobacter cloacae相对丰度升高(图3D)。
图3 NEC和对照组早产儿粪便宏基因组分析
4、HMO和细菌图谱的综合分析
采用种水平数据对PGCTs进行DMM聚类,5种PCGTs最理想(图4A)。PGCT-1特征菌是高丰度Staphylococcus spp和Enterococcus faecalis,PGCT-2高丰度Escherichia spp,PGCT-3高丰度Klebsiella spp,PGCT-4和PGCT-5高丰度Bifidobacterium spp,B. breve在PGCT-5丰度高。根据样本在所有时间点和clusters上的分布,在出生后前70天内接受MOM中DSLNT高于和低于241nmol/ml的婴儿微生物组差异显著(图4B)。在校正组间抽样频率不均匀后,最后一个时间点接受MOM超过DSLNT阈值2倍的婴儿类似于PGCT-5,其Bifidobacterium高丰度(图4A)。
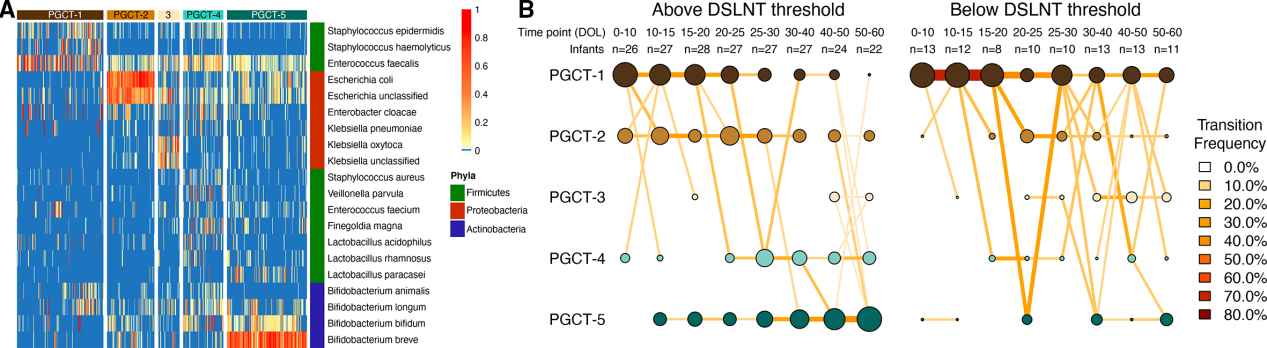
图4母乳喂养高于或低于241nmol/ml DSLNT的婴儿PGCTs分析
5、HMO和宏基因组数据可释方差和随机森林分类
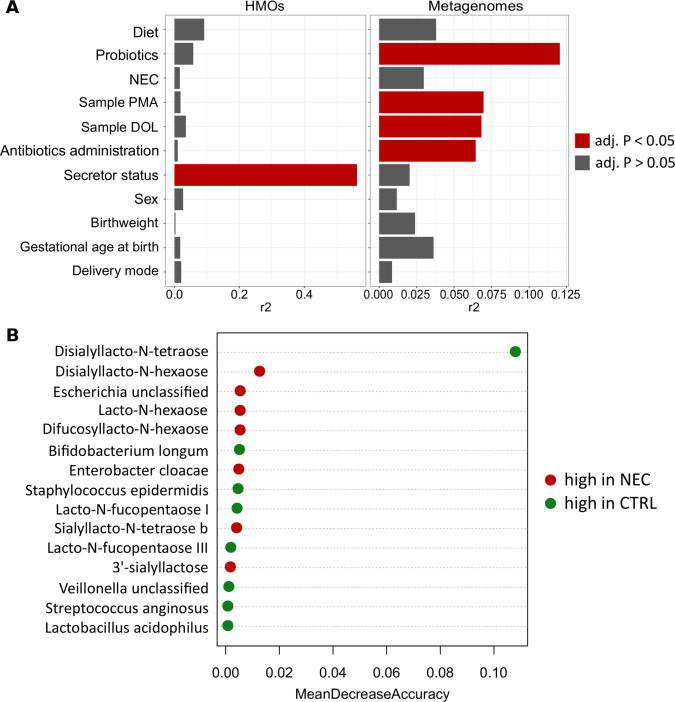
使用横断面HMO和横断面宏基因组数据集,作者试图确定哪些临床因素与HMO和细菌图谱最相关(图5A)。分泌状态可以解释HMO 56%的变异,其他协变量与HMO无显著相关性。细菌图谱与胎龄、DOL、抗生素使用和益生菌服用显著相关,而与母亲的分泌状态相关性不显著。总之这些发现强调了HMO和细菌分布受多种非重叠因素影响。
作者比较了基于HMO数据集、宏基因组数据和两个数据集结合建立的区分婴儿NEC和健康的随机森林模型的性能,鉴于所有这些信息在疾病发病前就可以获得,因此在临床实践中可作为风险分类系统。在组合模型中,DSLNT在对照组富集,DSLNH和Escherichiaunclassified的相对丰度在NEC中高(图5B)。






 京公网安备 11011302003368号
京公网安备 11011302003368号