2022年9月30日,成都中医药大学丁维俊教授团队在《Lipids in Health and Disease》发表题为“Potential novel biomarkers in small intestine for obesity/obesity resistance revealed by multi-omics analysis”的研究论文,该研究运用全长16S测序技术、全长转录组测序和代谢组检测,通过分析肥胖和肥胖抵抗小鼠模型中小肠菌群、代谢物和空肠转录组数据,发现了Clostridium_sensu_stricto_1、neuromedin N、脑啡肽 L、Pck1、5-羟基-L-色氨酸、Cxcl10 和肉桂醇可能是小肠中肥胖/肥胖抵抗的新型生物标志物,在预防肥胖或治疗肥胖患者具有重要意义。百迈客为该研究提供了ONT全长转录组测序,全长微生物多样性测序、代谢组检测和部分分析服务。

发表时间:2022.10.8
发表期刊:Lipids in Health and Disease
研究背景
在全球范围内,肥胖是一个日益严重的健康问题。其发病率逐年增加。肥胖会导致许多并发症,包括心血管疾病、中风、肝硬化和糖尿病。因此,新的预防性治疗策略对于降低肥胖发病率至关重要。肥胖的原因包括多种原因,包括环境和遗传因素。然而,个体似乎对肥胖表现出不同程度的易感性。高脂饮食有助于 C57BL/6 模型小鼠的肥胖或肥胖抵抗。盲肠或新鲜粪便中的微生物群和血液或尿液中的代谢物有助于肥胖抵抗;然而,小肠中的微生物群或代谢物尚未得到广泛研究。因此,该研究旨在调查小肠中肥胖/肥胖抵抗的不同潜在新型生物标志物。
技术路线
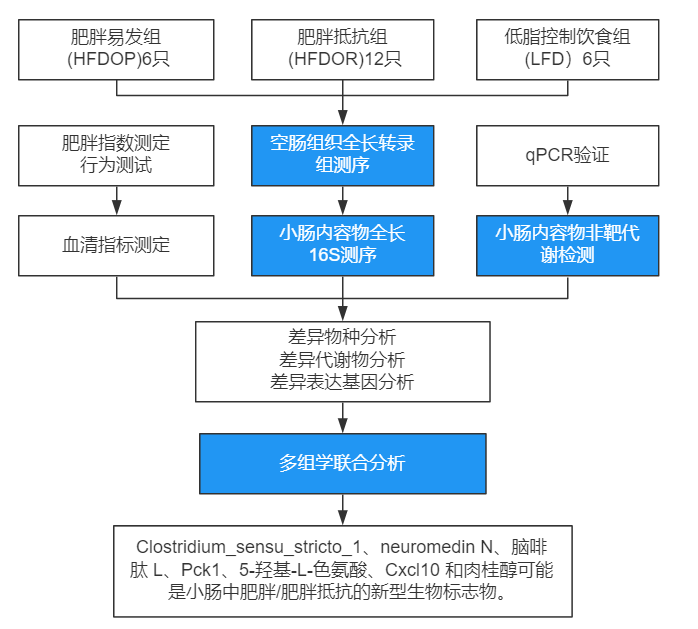
主要结果
1.肥胖/肥胖抵抗的主要指标
高脂饲料喂养8周后,单笼饲养4周,高脂饮食诱发的肥胖组(HFDOP)小鼠体重和Lee‘s指数持续增加,而肥胖抵抗组(HFDOR)小鼠体重和Lee’s指数持续增加。然而,HFDOP和HFDOR小鼠的平均每日饲料和能量摄入量没有显著差异(图1B、C)。高脂饮食组与高脂饮食组小鼠体重和Lee‘s指数有统计学差异。HFDOP组的空腹血糖水平高于HFDOR组和LFD组(图1G)。HFDOP组的肝脏重量、总脂肪和总内脏脂肪的重量显著高于LFD组(图1H-J).
然而,HFDOR组的肝脏、总脂肪和总内脏脂肪的重量显著低于HFDOP组(图1H-J)。HFDOP组AST、ALT、HDL、LDL、TG和TC水平较LFD组显著升高(图3K-P)。然而,HFDOR组的AST、ALT、高密度脂蛋白、低密度脂蛋白和甘油三酯水平显著低于HFDOP组(图3K-O)。尽管HFDOR组的TC水平低于HFDOP组,但差异无统计学意义。
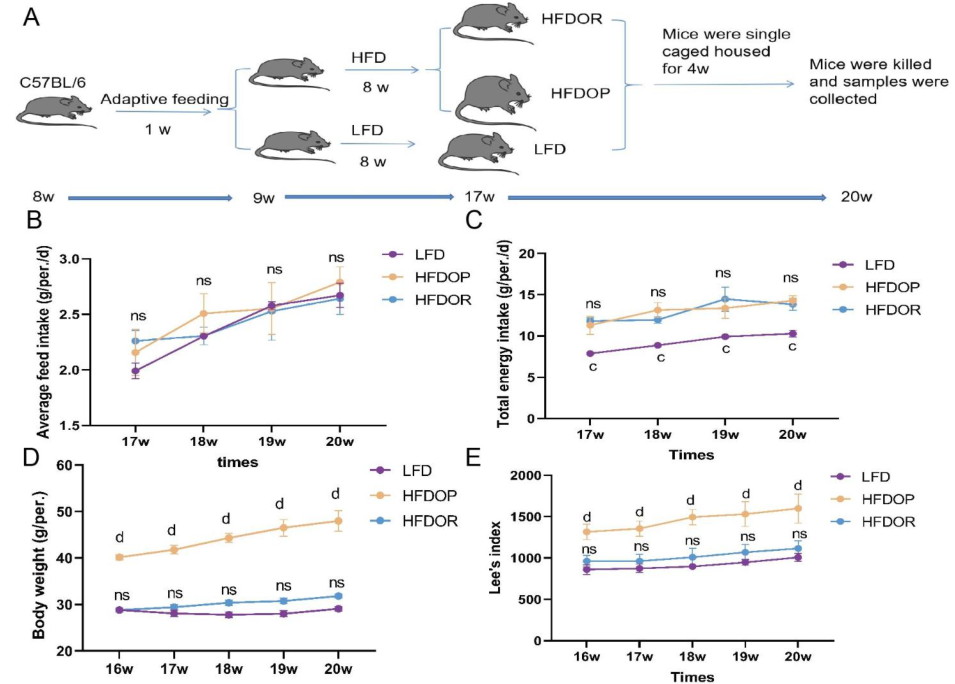
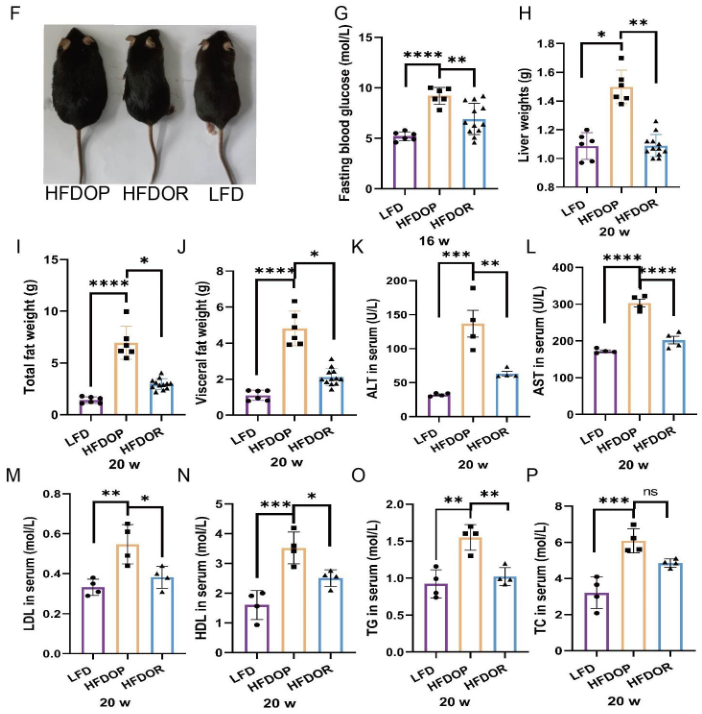
图1.肥胖/肥胖抵抗小鼠的主要指标
2.肥胖抵抗与抑郁无关
为了排除抑郁和焦虑样行为对肥胖抵抗的影响,在16周结束时进行了自发开场活动实验和高架十字迷宫实验。开场实验结果如图2A-C所示。HFDOP组进入中心区域的次数和进入该区域的次数显著低于LFD组(图2B、C)。HFDOR 组比 HFDOP 组更远地进入中心区域并且更频繁地进入该区域(图2B、C)。高架十字迷宫实验表明,与LFD组相比,HFDOP组进入开臂的次数和频率都要少得多(图3E、F)。HFDOR组比HFDOP组开臂走得更远,但两组之间没有统计学意义。HFDOR组比HFDOP组更频繁地进入开臂(图3F)。
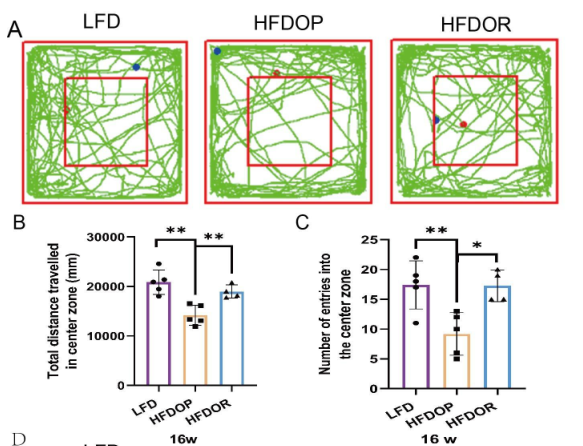

图2.肥胖/肥胖抵抗小鼠对抑郁和焦虑样行为测试
3.肥胖/肥胖抵抗与小肠菌群和代谢产物有关
使用全长16S微生物多样性测序和非靶向代谢组学方法检测了小肠内容物。HFDOP组的Muribaculaceae、Faecalibaculum、Desulfovibrio和 Lachnospiraceae的相对丰度高于 LFD 和 HFDOR 组,但差异无统计学意义。LFD对照组和HFDOR组Clostridium和Lactobacillus的相对丰度高于 HFDOP 组,但只有梭状芽胞杆菌水平的差异具有统计学意义。
小肠内容物非靶向代谢组学的结果如图3C-E 所示,PLS-DA 分析表明 HFDOR 和 HFDOP 组之间的明显分离(图3C)。在小肠内容物中共检测到 314 种差异代谢物(图3D)。相关性分析表明,Desulfovibrio、Bifidobacterium和Gemella都与 PC、DG 和胆酸葡糖苷酸呈正相关,而与维生素 A、dCMP、肉桂醇、5-HT 和肉桂酸葡糖苷酸呈负相关(图3E)。Clostridium_sensu_stricto_1 和 Ralstonia 与维生素 A、dCMP、肉桂醇、5-HT、1 H-吲哚-3-乙酰胺和氢化肉桂酸呈正相关,与 PC、PE、TG、DG、neuromedin N、脑啡肽 L 和胆固醇葡糖苷酸呈负相关(图 4)。
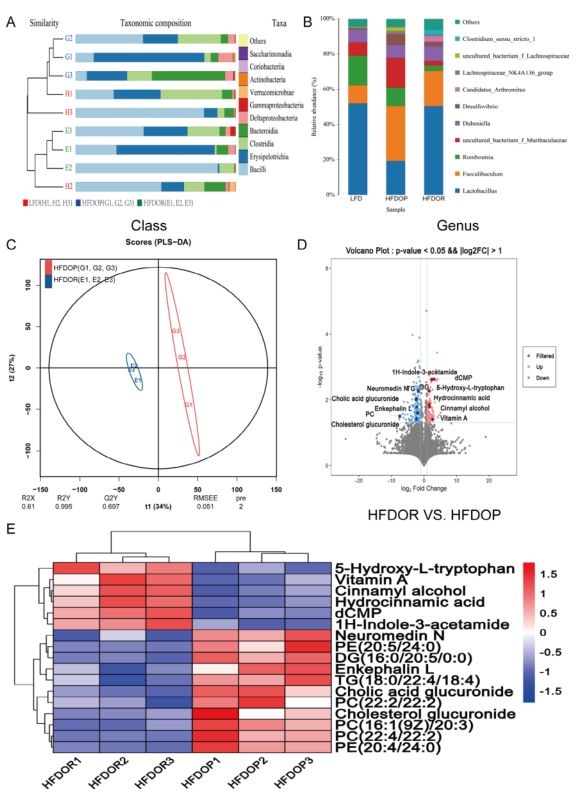
图3.小肠菌群和代谢物中肥胖/肥胖抵抗的差异生物标志物
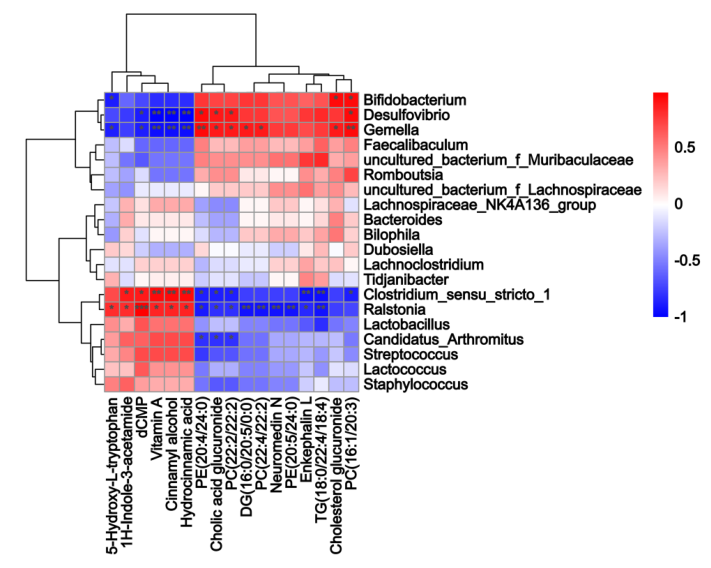
图4. 小肠微生物群与代谢物的 Spearman 相关性分析
4.肥胖/肥胖抵抗力的小鼠在空肠中表现出不同的转录水平
为了进一步探讨肥胖/肥胖抵抗的原因,研究者运用全长转录组测序技术检测空肠组织中的基因转录水平。共鉴定出1645个差异表达基因(750个上调,895个下调),其中331个差异表达显著。在331个显著差异表达基因中中,有30个基因在11条KEGG通路中被富集。富集的基因和10条最丰富的KEGG途径如图所示,这些基因在丝裂原活化蛋白激酶(MAPK)、细胞因子和磷脂酰肌醇3’激酶/蛋白激酶B(PI3K/Akt)信号通路中显著丰富(图6C)。用qPCR分别验证了差异表达基因。Tgfb2、Spp1、Pck 1、Cxcl10和Epha7表现出一致的mRNA表达模式(图6B,D-H)。
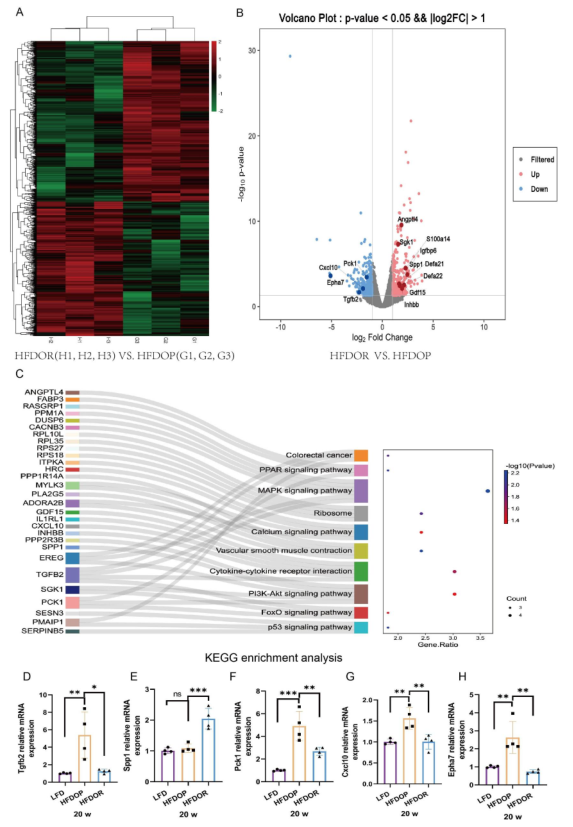
图6.空肠中肥胖/肥胖抵抗的不同转录水平
5.差异表达基因与代谢物或微生物群的相关性分析
进一步进行了DEGs和微生物的Spearman相关性分析。结果表明,esulfovibrio, Bifidobacterium和Gemella与CxCl10呈正相关,与SGK1、ANGPTL4和GDF15呈负相关。
Clostridium_sensu_stricto_1 和 Ralstonia 与 Igfbp6 和 Gdf15 呈正相关,与 Epha7、Pck1和Cxcl10 呈负相关。此外,Defa21和Defa22与uncultured_bacterium_f_Muribaculaceae呈负相关(图7A)。DEGs与代谢物的相关分析结果表明,H-吲哚-3-乙酰胺与Igfbp6和Inhbb水平呈显著正相关,与Epha7呈负相关。代谢产物5-羟色胺与SGK1呈显著正相关。维生素A、肉桂醇和氢肉桂酸与GDF15呈显著正相关,与CxCl10呈负相关。代谢产物PC、PE、TG、DG、脑啡肽L、NeuroMedin N、胆酸葡萄糖醛酸苷和胆固醇葡萄糖醛酸苷与CxCl10、Pck 1、Epha7和Tgfb2呈显著正相关,与Inhbb、Igfbp6、S100a14、GDF15、ANGPTL4和SGK1呈负相关(图7B)。
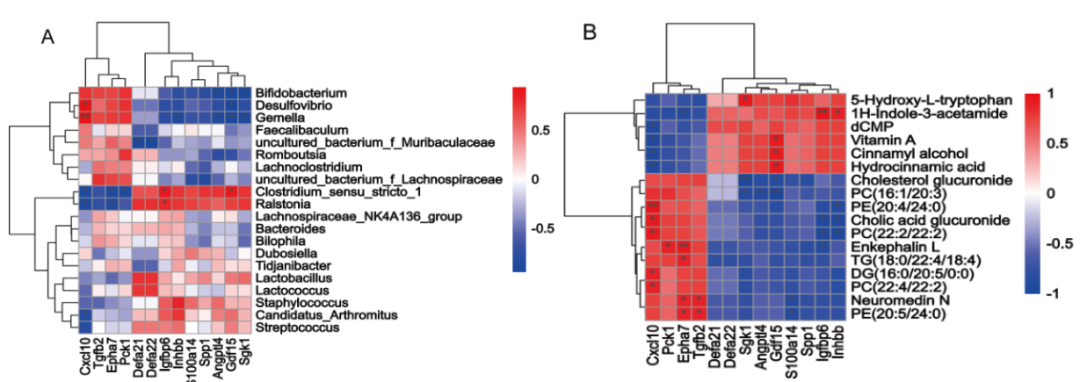
图7.差异表达基因与肠道菌群和代谢物的 Spearman 相关性分析 A.差异表达基因与小肠菌群相关性分析; B 差异表达基因与小肠代谢物相关性分析。
总结
综上所述,肠道菌群、肠道代谢产物和肠道基因相互作用。肠道微生物群Clostridium、Desulfovibrio和Lachnospiraceae可直接作用于肠粘膜,其代谢产物5-羟色胺(5-HT)、脑啡肽L和神经介素N可能调节神经系统并将信号传递给大脑。因此,“微生物-肠道-大脑”轴可能与肥胖抵抗有关。此外,Cxcl10也是HFD诱导的ENS损伤的潜在靶点。未来预防和治疗肥胖的目标可能包括5-羟色胺、脑啡肽L和神经介素N、肉桂醇和1H-吲哚-3-乙酰胺。益生菌补充剂,特别是梭状芽孢杆菌,可能有助于治疗肥胖患者或预防肥胖。
如果您对该研究思路感兴趣,欢迎点击下方按钮联系我们,我们将免费为您设计文章思路方案。
参考文献
Pang Y, Zheng Y, Yang N, et al. Potential novel biomarkers in small intestine for obesity/obesity resistance revealed by multi-omics analysis[J]. Lipids in health and disease, 2022, 21(1): 1-15.









 京公网安备 11011302003368号
京公网安备 11011302003368号