单细胞多组学已经广泛应用于肿瘤研究,特别是同时研究细胞染色质开放性和基因表达特征,本次给大家推荐的是单细胞多组学技术在阿尔茨海默症中的应用。
百迈客提供全面的单细胞空间转录组系列检测服务,包括单细胞(核)转录组、空间转录组、单细胞免疫组库、单细胞ATAC-seq、单细胞ATAC&GEX、单细胞全长转录组,年底活动更是优惠多多,详情可见:享年末,抄低价,丰富好礼超乎你想象!

发表期刊:Nature Genetics
影响因子:38.3307
发表日期:2021-08
摘要
在健康和疾病中,大脑的基因调控是高度动态的,协调着不同细胞类型之间一系列生物过程。本文展示了一项针对来自晚期阿尔茨海默症(AD)患者191890个细胞核的多组学单细胞核研究。分析了相同生物样本中的染色质可及性和基因表达,揭示了细胞异质性。鉴定了细胞类型特异性、疾病相关的候选顺式调控元件及其候选靶基因,包括一个与APOE和CLU连接的少突胶质细胞相关调控模式。阐述了由全基因组关联研究的AD风险位点上特定细胞类型的顺式调控关系,证明了多组学单细胞核方法的实用性。神经胶质群体的轨迹分析确定了疾病相关转录因子,如SREBF1及其调控靶基因。最后,作者还进行了单核共识加权基因共表达分析,这是一种对稀疏单细胞数据稳定的共表达网络分析策略,并对AD转录组进行了系统分析。
实验方法
RNA-seq、snRNA-seq、snATAC-seq、FISH、免疫荧光
背景介绍
人脑由多个不同种类的细胞组成,神经细胞和非神经细胞协同工作,完成简单而高阶的任务。最近的研究已经提供了认知正常大脑中神经元和非神经元细胞群体的更√确的分子特征和识别。然而,对疾病大脑中的异质细胞群体的了解仍然很有限,这限制了对疾病背后的生物学过程的理解。神经退行性疾病,如阿尔茨海默症(AD),其特点是大量神经元丢失,并伴有胶质细胞增生,而特定的神经元和胶质细胞群在AD病理生理学中的作用尚不清楚。目前仅在小鼠和人类组织上进行了几项单细胞和单细胞核RNA测序(snRNA-seq)研究,揭示细胞类型特异性的转录变化,但这些疾病相关细胞亚型的调控因素尚未确定。
此外,已经对阿尔茨海默症进对阿尔茨海默等复杂疾病的GWAS研究表明,从常见变异到远端调控元件的遗传风险占很大比例。这些调控元件通常是疾病相关组织中特定细胞类型的区域。虽然在将GWAS信号与功能基因组学分析(包括批量RNA-seq和高通量测序分析转座酶可及染色质分析(ATAC-seq))交叉方面进行了大量工作,但此类研究的分辨率明显受到细胞类型异质性的限制。将GWAS HITS与细胞类型联系起来的一个先决条件是将远端调控元件与它们的靶基因联系起来。
ATAC-seq是检测组织内开放的染色质区域。迄今为止,单细胞染色质可及性技术,如单核ATAC-seq (snATAC-seq),很少用于疾病组织的原始样本,因此,研究人员对同一AD患者死后的脑组织样本同时进行了snATAC-seq和snRNA-seq,以在表观基因组和转录组水平揭示AD相关基因调控程序,并为研究大脑的细胞异质性提供了一个新方法,并且能够揭示特定细胞群中神经退化的新途径。
本文对191890个来自阿尔茨海默症患者死后脑组织和认知健康对照的细胞核进行了单细胞核多组学分析,通过整合snRNA-seq和snATAC-seq数据,从而对阿尔茨海默症分子层面变化更完善的理解。通过染色质可及性分析确定了细胞类型特异性的候选顺式调节元件(cCREs),并发现了疾病相关的细胞亚群特异性转录组变化。确定了可能调节阿尔茨海默症基因表达变化的转录因子。此外,在整合的数据上进行了伪时间轨迹分析。然后将候选的阿尔茨海默症风险位点的精细定位的GWAS信号与snATAC-seq数据整合,将阿尔茨海默症风险信号与它们可接近的特定细胞类型联系起来,并确定了这些位点的顺式调控染色质可接近网络。此外,由于网络分析在阐明组织水平RNA-seq数据中的疾病转录组特征方面是有效的,研究人员设计了一个共表达网络分析通路,整合了单细胞和批量RNA-seq数据,在每种细胞类型中识别了AD相关的共表达网络。
结果
一、人类前额叶皮质的多组学分析
研究者进行了snATAC-seq (10×Genomics;12例晚期AD、8例对照)和snRNA-seq (10×Genomics v3;11例晚期AD、7例对照组),使用从晚期AD患者和年龄匹配的认知健康对照组(74-90岁以上;图1a)。根据Braak分期和斑块分期定义了晚期AD和对照。从同一组织样本分别生成转录组和表观遗传学数据,以减少两种方法之间的细胞类型组成差异。经过质控过滤后,对130418个细胞核进行snATAC-seq,61472个细胞核进行snRNA-seq。为了保证研究的严谨性,对这两种方法的数据采用了批量校正。对于snATAC-seq,使用了相互最近邻(MNN)来校正潜在的semantic indexing来降低的染色质可达性;对于snRNA-seq,使用了整合非负矩阵因子分解(iNMF)来降维,同时消除批次效应。将UMAP降维和Leiden聚类应用到批量校正的表观基因组和转录组数据中,在snATAC-seq和snRNA-seq中识别到了不同的细胞类型(图1b、c)。利用snATAC-seq,分析了脑的所有主要细胞类型——兴奋性神经元(24076个细胞核,EX.a-e)、抑制神经元(9644个细胞核,INH.a-d)、星形胶质细胞(15399个细胞核,ASC.a-f)、小胶质细胞(12232个细胞核,MG.a-e)、少突胶质细胞(62253个细胞核,ODC.a-m)和少突胶质细胞前体细胞(4869个细胞核;OPC.a),基于已知标记基因启动子区域的染色质可及性进行注释。同时使用chromVAR通过估算可访问染色质区域的TF结合基序的富集来计算单细胞核内TF基序的变异性,并检测了依据细胞类型划分的TF基序的富集情况,确定了在星形胶质细胞、兴奋性神经元和小胶质细胞中随着疾病发生而富集增加的几种TF基序。此外,对TF足迹进行分析,以进一步阐明细胞类型特异性TF调控,结果发现SOX9 TF足迹在少突胶质细胞中的作用。研究人员发现在兴奋性神经元中TF motif富集了少突细胞相关的TF。同样,使用snRNA-seq-检测到了类似的细胞类型——兴奋性神经元(6369个细胞核,EX1-5)、抑制神经元(5962个细胞核,INH1-4)、星形胶质细胞(4756个细胞核,ASC1-4)、小胶质细胞(4126个细胞核,MG1-3)、少突胶质细胞(37052个细胞核,ODC1-13)和少突胶质细胞前体细胞(2740个细胞核,OPC1-2),通过细胞类型标记基因的表达进行分类(图1e)。在这两种检测中,少突胶质细胞都是常见的细胞类型。此外,虽然每种主要细胞类型中的许多差异表达基因(DEGs)与以前的文献一致,但也发现先前被确定为神经元或胶质亚型标记的细胞分群特异性基因。
由于表观基因组图谱与下游基因表达信号深度交织在一起,研究人员使用了Seurat的整合平台整合了snATAC-seq和snRNA-seq数据(图1f)。在整合的UMAP空间时将染色质数据或转录组数据独立分类的细胞类型整合在了一起(图1g)。在snATAC-seq和snRNA-seq中使用相同的生物样本,导致来自这两个数据模拟动态的细胞核在共同构建的空间中高度重叠。
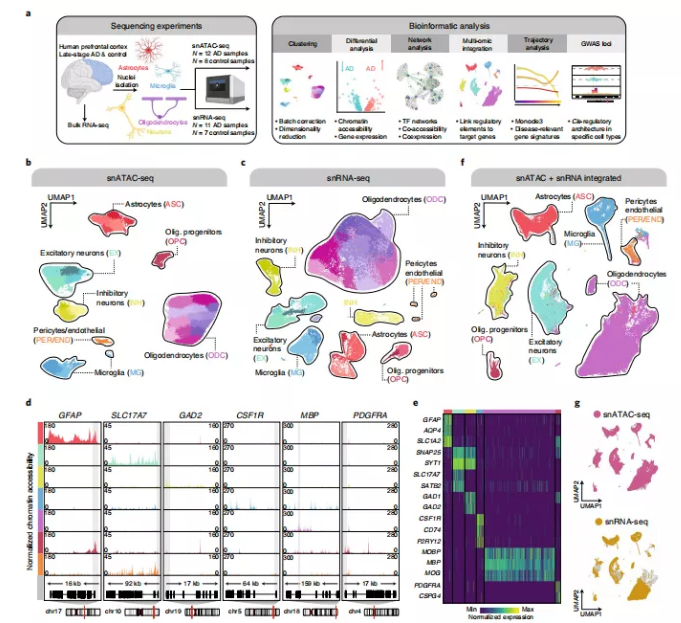
图1单核ATAC-seq和单核RNA-seq在研究病变脑细胞多样性中的应用
二、阿尔茨海默症中细胞异质性的多组学特征
在snATAC-seq和snRNA-seq中,发现了多个神经元和胶质细胞亚群,并基于之前鉴定的标记基因对snRNA-seq中的亚群进行了注释(图2)。对于snATAC-seq聚类,研究人员使用的是Seurat的标记转移算法来计算聚类预测值。研究人员对疾病组的每个分群的组成进行分析,与对照相比在AD晚期中发现了一些明显的过高或过低组分(图2d-g),并且在两种数据中结果类似。ASC3 (GFAPhigh/CHI3L+) 随疾病程度比例显著增加,而ASC4 (GFAPlow/WIF1+/ ADAMTS17+) 显著降低。这与最近对患AD的小鼠5XFAD模型的snRNA-seq研究一致。研究人员还发现MG.a和MG.b在AD晚期增加,两者都定位到激活的snRNA-seq聚类的MG1 (SPP1high/CD163+),且随疾病的加重而增加。此外,研究人员发现免疫少突胶质细胞簇ODC13在AD晚期显著增加。
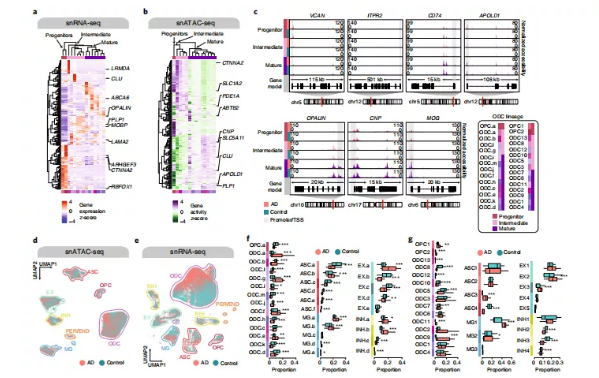
图2.人类AD前额叶皮质中不同的表观遗传学和转录差异细胞亚群
三、晚期阿尔茨海默症的细胞类型特异性顺式基因调控
基于研究人员在同一样本中同时使用snATAC-seq和snRNA-seq的实验设计,研究人员推测可以在特定的细胞群体中确定cCREs的靶基因。为此,研究人员通过在每一种细胞类型中分别为AD晚期和对照样本构建顺式共可及网络(CCANs)来阐明AD晚期PFC的顺式调控结构。
为了识别cCREs的靶基因,研究人员将重点放在了共可及peaks上,选定其中位于启动子元件中的peaks,得到了一组cCREs和候选靶基因。研究人员将候选靶基因的表达与cCRE的染色质可及性关联起来,旨在研究潜在调控关系的,而不仅仅是共可及性。最后,研究人员使用NMF根据这些基因连锁的cCRE(gl-cCRE)在每个细胞分群中的染色质可及性进行分析和聚类。总而言之,对于晚期AD和对照样本中的每一种主要细胞类型,这种方法导致了一组候选增强子元件(gl-cCRE)以及一组cCRE连锁的基因被分组到功能模块中。
总的来说,使用这种方法共鉴定了56552个gl-cCREs和11440个cCREs连锁基因,每个基因的中位数为4个cCREs(图3a)。通过检查在每个细胞类型中鉴定的cCREs连锁基因组之间的重叠,研究人员发现,除了那些细胞类型特异性的基因外,还有大量具有连锁cCRE的基因在多种细胞类型中共享(图3b)。在一些细胞类型中,研究人员发现cCREs连锁基因与细胞类型标记DEGs以及该细胞类型中在AD中上调的基因之间存在显著重叠,这表明cCREs在疾病相关基因表达变化中发挥关键作用(图3c)。研究人员还研究了这些gl-cCREs的每个snATAC-seq分群的染色质可及性,并发现到细胞类型和分群高度特异性(图3d)。大部分gl-cCREs定位于内含子区域(58.35%;图3e)。此外,通过检查NMF系数矩阵(H),研究人员能够识别每个NMF模块对应的分群或细胞类型,并注释了几个特定于控制晚期AD细胞核的模块(图3f、g)。此外,研究人员还发现一些在多种细胞类型中共有的cCRE靶基因在每种细胞类型中受不同的cCRE调控。
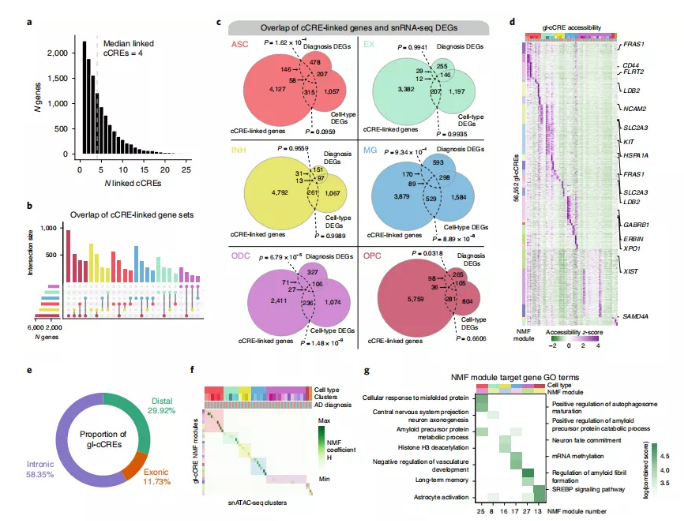 图3.将顺式调控元件连接到特定细胞类型中的下游靶基因
图3.将顺式调控元件连接到特定细胞类型中的下游靶基因
四、晚期阿尔茨海默症中的细胞类型特异性转录因子
为了补充对顺式调节元件的分析,研究人员在晚期AD中识别了特定细胞类型的反式调节元件。TFs在神经发育过程中严格控制细胞命运,并与神经退化过程有关。研究人员分析了小胶质细胞转移因子SPI1(也称为PU.1)和核呼吸因子1(NRF1)在少突胶质细胞中的调节作用(图4a-f)。snATAC-seq小胶质细胞分群中的SPI1基序可变性只在上调的MG.a和MG.b中显著增加,但SPI1的靶基因在只有MG1中显著下调(图4a、b)。研究人员还发现NRF1在特定的少突胶质细胞分群中表达失调(图4d-f)。这些结果表明,SPI1在晚期AD中起转录抑制因子的作用。此外,NRF1已被认为与线粒体功能相关,NRF1调节失调所介导的线粒体功能受损可能通过破坏髓鞘形成而导致晚期AD的神经元功能障碍。
为了进一步探究晚期AD中TF介导的基因调控,研究人员构建了特定细胞类型的TF调控网络。对于特定的TF,研究人员确定了候选目标基因,即其启动子或连锁的cCRE是可访问的,并且在目标细胞类型中包含TF的结合基序的基因,研究人员对几个选定的TF重复了这一过程,产生了小胶质细胞特异性和少突胶质细胞特异性的TF调控网络(图4g,h)。在这些网络中,研究人员发现了多个AD DEGs,除了位于已知AD GWAS位点的基因外,还受到小胶质细胞中的SPI1和少突胶质细胞中的NRF1的调控。
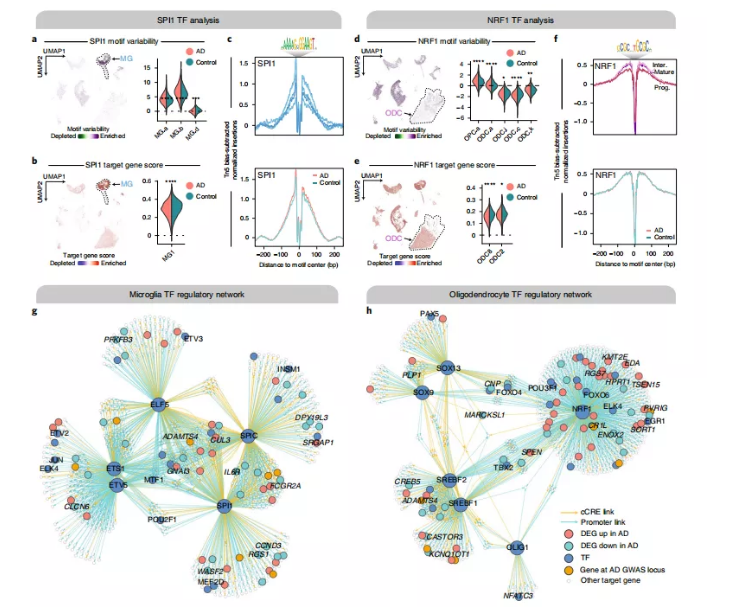 图4. AD晚期中细胞亚群特异性转录因子调控
图4. AD晚期中细胞亚群特异性转录因子调控
五、疾病相关胶质细胞的综合轨迹分析
为了进一步揭示阿尔茨海默症胶质细胞异质性的分子机制,研究人员使用Monocle3进行了伪时间轨迹分析。在少突胶质细胞、小胶质细胞和星形胶质细胞中整合的snATAC-seq和snRNA-seq数据。多组轨迹分析能够研究在细胞状态转换的连续体中基因表达、染色质可及性和TF基序可变性的动态。研究人员使用递归变异自动编码器(RVAE)对基因表达和染色质可及性动态进行建模。对于每种细胞类型,研究人员确定了沿着轨迹差异表达的基因(t-DEGs)。
六、少突胶质细胞轨迹显示SREBF1失调
研究人员使用snATAC-seq的58221个细胞核和snRNA-seq的36773个细胞核构建了一个完整的少突胶质细胞轨迹(图5a),发现AD晚期样本的细胞核比例似乎沿着轨迹增加(图5b)。为了阐明与晚期AD相关的少突胶质细胞的功能状态,研究人员检测了新形成的少突胶质细胞(NF-ODCs)、髓鞘形成的少突胶质细胞(MF-ODCs)和成熟的少突胶质细胞(图5c)。研究人员发现成熟ODC基因表达特征在轨迹的末端增加,而MF-ODC基因表达特征减少。此外,NF-ODC基因标记在整个轨迹中全部降低,这表明少突胶质细胞伪时间轨迹再现了少突胶质细胞成熟过程。9231个少突胶质细胞gl-cCREs的染色质可及性和1563个用RVAE重建的少突胶质细胞t-DEGs的基因表达表明,大量的染色质重塑和转录重编程可能是少突胶质细胞成熟的基础(图5d)。
此外,RVAE得到的潜伏特征空间提供了对疾病中的伪时间轨迹和基因调控的进一步生物学观察(图5e)。每个点代表一个单一的特征(基因或染色质区域)。研究人员根据每个功能在轨迹上达到*大值75%的位置对其进行排名,研究人员称之为该功能的“轨迹排名”。然后,研究人员将重建特征轨迹(如图5d)与晚期AD细胞核的比例进行对比(如图5b),查看哪些特征与AD持续变化。对于基因(t-DEGs)和染色质区域(gl-cCREs),潜在空间明确地将与晚期AD细胞核比例正或负相关的特征分组在一起,并将具有相似轨迹等级的特征分组在一起,这表明了该RVAE模型在分析和解释多组伪伪时间动力学方面的是可行的。
少突胶质细胞中的两个关键转录因子:NRF1和甾醇调节元件结合转录因子1(SREBF1)。SREBF1在调节胆固醇和脂肪酸稳态相关基因的表达方面发挥着关键作用,有人认为Aβ可以抑制SREBF1的激活。研究人员发现,在晚期AD的少突胶质细胞中,NRF1基序可变性上调(图4d),而SREBF1基序可变性随疾病的发生而下调。研究人员将TF基序可变性轨迹与重构的t-DEG表达轨迹相关联,并可视化了TF与2D潜在空间内每个基因之间的相关性,确定了由TF结合激活或抑制的候选靶基因(分别为正或负轨迹相关性;图5f)。发现NRF1与轨迹末端的靶基因呈负相关,而SREBF1与轨迹开始和末端的靶基因呈正相关,表明SREBF1在整个轨迹中起着转录激活因子的作用。
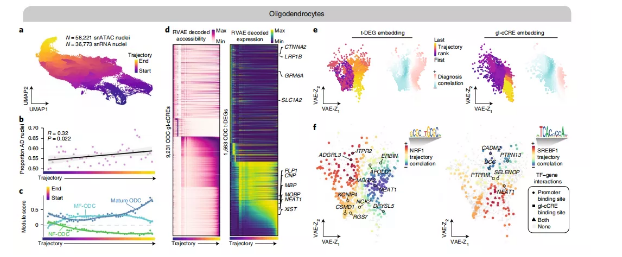 图5.多染色体少突胶质细胞轨迹分析
图5.多染色体少突胶质细胞轨迹分析
七、小胶质细胞轨迹定义疾病相关的小胶质细胞
对少突胶质细胞轨迹分析使用相同的分析方法,对snATAC-seq的10768个核和snRNA-seq的4119个细胞核构建了一个完整的小胶质细胞轨迹(图6a)。晚期AD样本的细胞核比例在整个小胶质细胞轨迹中显著增加(图6b)。疾病相关小胶质细胞(DAM)的基因特征进行了分析。DAM是AD相关的吞噬小胶质细胞,在TREM2依赖和TREM2依赖的阶段依次激活。
整合小胶质细胞的轨迹伴随着稳态特征的减少,阶段1的DAM特征的增加和阶段2依赖于TREM2的DAM特征的明显的耗损(图6c),表明这种小胶质细胞轨迹从稳态到疾病相关细胞状态转变过程中的转录和表观遗传变化。
为了进一步剖析小胶质细胞的轨迹,再次用RVAE(图6d、e)分别对9163个小胶质细胞gl-cCRE和2138个小胶质细胞t-DEG的染色质可及性和基因表达动态进行了建模。对ETS家族转录因子——SPI1和ETS变体5(ETV5)进行分析,这两个家族在AD晚期都显示出基序可变性以及候选靶基因的上调(图6f)。还观察到SPI1基序轨迹与轨迹末端的基因呈负相关,即SPI1在晚期AD中起到抑制因子的作用。
八、人类阿尔茨海默症中与疾病相关的星形胶质细胞
利用snATAC-seq的12112个细胞核和snRNA-seq的4704个细胞核构建了一个完整的星形胶质细胞轨迹(图6h),同时发现AD晚期细胞核的比例在整个轨迹中显著增加(图6h)。与小胶质细胞轨迹中的DAM信号的分析结果类似。研究人员研究了疾病相关星形胶质细胞(DAAs)的基因信号,基于DAA基因特征分析,推断这一轨迹遵循从GFAP低态到GFAP高态与DAA状态的趋势相似(图6i)。
12487个星形细胞gl-cCRE和1797个星形细胞t-DEG的RVAE模型显示了整个轨迹中富集的基因调控动力学(图6j、k)。研究人员对星形胶质细胞t-DEGs与两种转录因子进行了研究:CCCTC-binding factor (CTCF)和FOSL2,发现这两种因子的基序变异性在AD晚期分别下调和上调。CTCF被认为是一个主要的染色质调控因子,研究发现CTCF基序可变性轨迹与DAA和GFAPhigh信号呈负相关,而与该轨迹GFAP-low的t-DEGs呈正相关(图6l)。另外研究人员发现FOSL2的基序变异轨迹与GFAP-high和DAA基因信号呈正相关,并与轨迹末端的基因呈正相关(图6l)。这些发现表明FOSL2可能是DAA信号的激活因子,而CTCF可能促进星形胶质细胞处于进稳态或非病变星形胶质细胞状态。通过将基因表达与TF基序富集、TF结合位点可及性联系起来,以及利用RVAE得到的时间信息,揭示了TF在调节细胞状态(如DAA)中的作用。
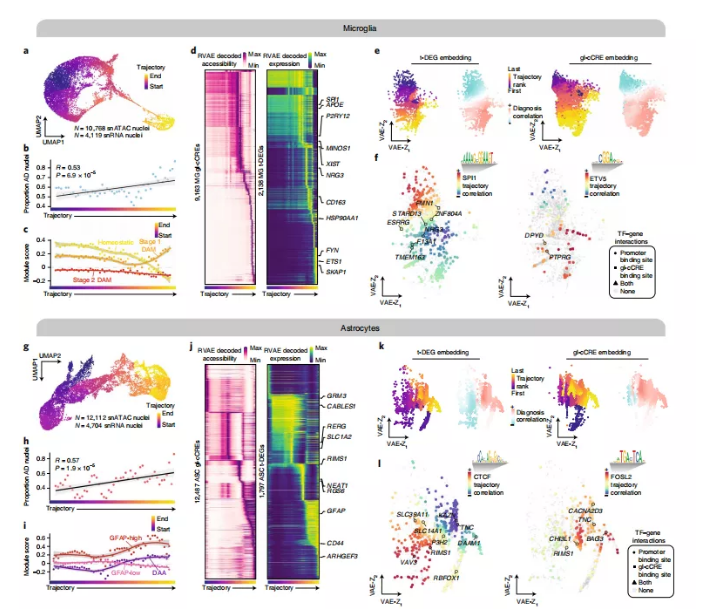
图6.多染色体小胶质细胞和星形胶质细胞轨迹分析
九、细胞类型特异性顺式调控在阿尔茨海默症遗传风险位点
为了进一步探究AD遗传风险信号,研究人员使用AD和其他相关性状的GWAS汇总统计数据,对snATAC-seq聚类进行细胞类型特异性连锁不平衡评分回归分析(LDSC)。Kunkle等人的研究表明,小胶质细胞MG.b和MG.c对AD GWAS SNPs有显著的富集作用,Jansen等人的研究中5个小胶质细胞簇均显著富集(MG.a、MG.e、MGb、MG.c和MG.d),其中除了来自AD患者的数据外,还包括家族性AD-by-proxy样本(图7a)。GWAS遗传分析的结果支持了之前在非患病人类和小鼠中的snATAC-seq数据。研究人员沿着小胶质细胞的伪时间轨迹进行了研究,观察到整个小胶质细胞轨迹远端peaks的gchrom VAR偏差分数显著增加(图7b、c),这与类似基因-近端peaks分析的偏差分数显著下降形成鲜明对比,这表明DAM中远端增强子上具有与AD相关的SNPs。通过将共可及性图与染色质可及性信号和沿基因组轴的GWAS统计叠加,研究人员揭开了GWAS基因中被致病变异破坏的潜在顺式调控关系,如BIN1、ADAM10、APOE和SLC24A4(图7d-i)。研究人员发现APOE基因座是研究AD遗传性的主要决定因素,也是目前研究得详细的AD风险基因座之一,其在疾病中小胶质细胞和星形胶质细胞中具有顺式调控染色质网络改变的作用。
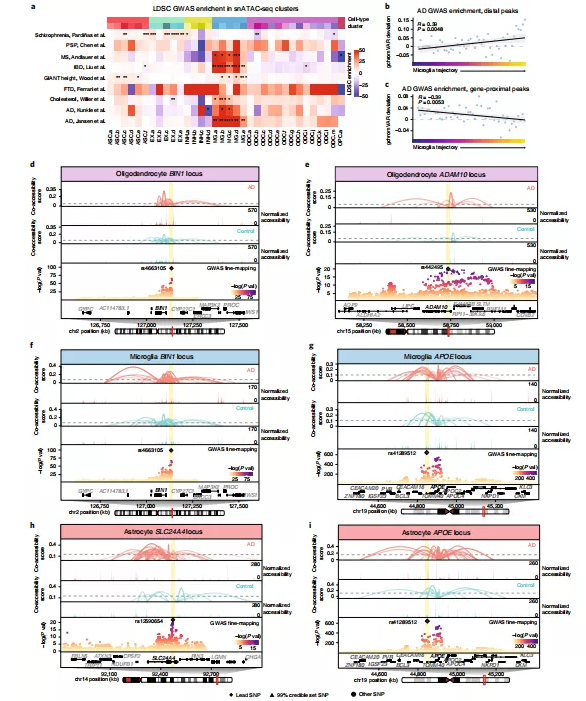 图7.阿尔茨海默症患者脑内GWAS基因座的细胞类型特异性调控格局
图7.阿尔茨海默症患者脑内GWAS基因座的细胞类型特异性调控格局
十、scWGNCA的单细胞共表达网络
为了将snRNA-seq数据在系统框架中重新定义,研究人员开发了一种加权基因共表达分析(WGCNA)的单细胞数据的基因共表达网络分析方法,WGCNA是一种用于识别疾病相关基因模块的强大分析方法,最初是为批量基因表达数据设计的。研究人员对其进行了修订,其中“meta-cells”是通过使用特定细胞群体中k-nearest neighbors计算50个相邻细胞的平均表达来构建的。Mathys等人发表的的AD snRNA-seq数据进行了重新处理,并使用iNMF将这些数据与其snRNA-seq数据整合。此外,研究人员对早期和晚期AD样本以及对照样本进行了批量RNA-seq。最后,研究人员使用WGCNA对不同时期的人类PFC的snRNA-seq数据和批量RNA-seq数据构建的meta-cells联合形成了共表达网络。
研究人员对少突胶质细胞的scWGCNA分析进行了重点研究,发现了四个与AD诊断显著相关的共表达模块——OM1、OM2、OM4和OM5(图8a、b)。例如,AD下调模块OM1的hub基因编码核糖体亚基(例如,RPS15A、RPL30和RPL23A),与它对蛋白质合成和分选相关GO富集一致。已知OM2基因成员MAG、CNP和PLP1参与髓鞘形成,研究人员发现OM2随着疾病的发生而下调。
此外,研究人员在共表达网络中检查了SREBF1的下游调控靶基因。随后又发现其中三个少突胶质细胞显著富集了SREBF1的靶基因,这表明SREBF1在调节这些模块中的基因表达方面发挥重要作用(图8c)。将批量RNA-seq、高通量蛋白质组学、SREBF1-ChIP)以及ChIP-seq的数据确定了SREBF1靶基因的蛋白-蛋白相互作用(PPI)网络。此外,研究人员发现SREBF1靶基因模块的基因表达量在AD早期和晚期样本的蛋白和RNA中下调(图8d),证实snATAC-seq SREBF1基序的可变性。通过RNA原位杂交和免疫组织化学方法验证了SREBF1在晚期AD中的下调,并发现ACSL4的表达在晚期AD中有所降低,ACSL4是ENCODE Chip-Seq数据中发现的SREBF1的靶点之一 (图8e-g)。总体而言,研究人员的共表达网络分析方法有助于识别细胞类型特异性疾病,在少突胶质细胞中发现了TF SREBF1,这在AD中基本上没有研究过,表明其研究方法能够对疾病产生新的见解。
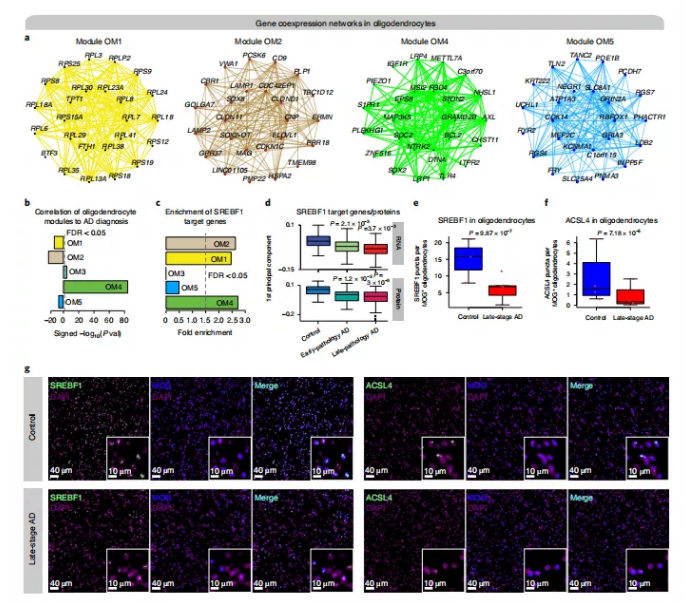
图8.批量和单细胞共表达网络分析揭示的基因表达模块
讨论
对晚期阿尔茨海默症的综合多组学分析为了解疾病发病机制提供了一个独特的视角,揭示了疾病发病机制下细胞异质性的连续性。√确定位复杂疾病的致病机制需要在表观基因组和转录水平上对细胞群体特异性基因调控系统有深入的理解。虽然单细胞染色质的可及性可以提供对疾病的重要见解,但由于其固有的稀疏性,研究人员通过整合相同样本的单核开放染色质和单核转录组,以及使用聚类进行批量可及性分析和共可及性分析,避免了稀疏性问题。考虑到这些因素,多组学分析能够分析神经退行性病变中特定细胞类型的表观基因组失调,破译了人类AD中单细胞核转录组。
研究人员发现了特定细胞类型的gl-cCRE,它可能介导晚期AD的基因调控,也可能与特定细胞类型中的gl-cCRE的TF结合。虽然cCRE可以仅用表观遗传学数据来鉴定,但他们的分析是通过整合单核转录组数据来证实的,因为研究人员将候选靶基因的基因表达与CCRE染色质的可及性联系起来。之前对AD的研究还没有探索细胞类型或细胞亚群水平的顺式基因调控。研究人员强调了晚期AD中顺式基因和反式基因调控的紊乱,为进一步研究AD提供了潜在的靶点,如少突胶质细胞中的NRF1和星形胶质细胞及其相应的gl-cCRE中的FOSL2。此外,研究人员检查了多组学数据中的顺式调控相互作用,以阐明GWAS与遗传性AD风险相关的细胞类型和疾病特异性基因表达模式。研究人员比较了AD和对照细胞群体之间的顺式调控网络,确定了在疾病中唯一的相互作用。因此,这项研究为更广泛的AD研究提供了一个资源,未来可以探索感兴趣的基因和基因组区域的细胞类型以及细胞状态特异性调控图谱。
此外,对少突胶质细胞转录组和染色质图谱的独立和联合分析显示,AD的基因调控和生物学途径受到干扰。研究人员分析了一个少突胶质细胞的轨迹,并评估了新形成的少突胶质细胞向成熟少突胶质细胞转变过程中的基因表达特征,观察到该轨迹似乎与少突胶质细胞成熟的发育方向一致。研究人员还发现在晚期AD中SREBF1基序的变异性降低,表明疾病中可与SREBF1结合的位点减少,而且SREBF1基因在AD少突胶质细胞中的表达也下调。轨迹分析表明,SREBF1基序的可变性与整个轨迹中的t-DEGs呈正相关,表明它在少突胶质细胞中发挥转录激活因子的作用。
共表达网络分析方法(如WGCNA)已被广泛应用于海量基因表达数据中的疾病相关基因的研究,然而,这些方法很少用于单细胞转录学,本文研究人员开发了scWGCNA,它利用聚集的meta-cells来减弱单细胞基因表达的稀疏性。研究人员利用scWGCNA联合分析了snRNA-seq和批量RNA-seq数据,发现了人类AD中的基因共表达网络。scWGCNA鉴定了三个SREBF1富集靶基因的少突胶质细胞模块,并表明这些靶基因和蛋白的表达在AD晚期降低。通过对少突胶质细胞中SREBF1的共表达和轨迹分析,SREBF1显然是一个后续具有重要研究价值的基因,作为AD治疗的候选靶点,也证明了研究人员的分析方法在确定新疾病基因靶点方面的实用性。
虽然散发性阿尔茨海默症的致病分子机制仍不清楚,但研究人员的研究成果提供了新的见解,有助于揭示阿尔茨海默症基因调控的本质。但还需要解决阿尔茨海默症和神经退行性变中基因表达和表观基因组学的复杂性的问题。这里提供的数据是理解疾病大脑中调节关系的宝贵资源,其分析的框架为挖掘单细胞多组学数据、发现复杂特征提供了蓝图。
推荐阅读
▶ 单细胞多组学|Nature带你玩转单细胞表观基因组学探讨人类皮质发育的机制
▶ 【单细胞+空间转录组】单细胞和空间转录组强强联手共同研究人类肌腱疾病中免疫稳态失调







 京公网安备 11011302003368号
京公网安备 11011302003368号