
该研究发现,高糖高脂通过刺激血管平滑肌细胞(VSMC)的活性氧(ROS)水平增加,诱导SIRT6由细胞核异常转位至胞质;胞质定位的SIRT6与糖酵解关键酶ENO3发生相互作用并催化其去乙酰化,该翻译后修饰增加ENO3的酶活性,从而触发糖酵解重编程。此外,外源性硫化氢(H₂S)可抑制氧化应激,并诱导SIRT6第141位半胱氨酸残基发生S-硫巯基化修饰,阻断SIRT6–ENO3相互作用,进而改善糖尿病血管病变中的糖酵解重编程及VSMC功能障碍。百迈客生物为该研究提供了转录组及单细胞核转录组测序服务!
研究背景
糖尿病性血管病变是2型糖尿病(T2DM)的一种主要并发症,其发病机制与血管功能障碍、代谢重编程以及氧化应激有关。位于细胞核内的NAD⁺依赖性去乙酰化酶SIRT6,因其通过组蛋白去乙酰化作用来调节心血管和代谢稳态而受到关注。然而,T2DM中细胞质SIRT6的积累及其功能和机制仍需进一步阐明。
研究内容
单细胞转录组分析结果表明:Ⅱ型糖尿病主动脉经历了显著的病理重塑,其特征是VSMС过度增殖、从收缩状态向合成状态的表型转换以及迁移能力增强。
通过转录组学和蛋白质组学分析,研究确定蛋白去乙酰化过程是导致糖尿病血管病变的重要诱因。进一步研究发现,使用高糖高棕榈酸处理血管平滑肌细胞后,SIRT6以Importin13(IPO13)的依赖方式从细胞核向细胞质转位。糖酵解异常是糖尿病性血管病变的关键诱因。
该研究旨在探究细胞质中的SIRT6是否对糖尿病性血管病变中的糖酵解过程起到调节作用。结果显示,SIRT6通过与ENO3(一种催化2-PGA转化为PEP的关键糖酵解酶)相互作用,从而去乙酰化SIRT6,从而降低了其活性,进而加剧了在高血糖和高血脂条件下发生的糖酵解重编程过程。
H₂S是一种气体信号分子,主要通过半胱氨酸残基的巯基硫化修饰作用来调节底物蛋白的功能。研究发现H₂S通过靶向SIRT6起到了改善糖酵解重编程的作用。在稳态状态下,H₂S对维持各种器官的生理功能至关重要,并且内源性H₂S水平与许多生物活动相关,例如糖尿病和代谢失调。
在该研究中,H₂S减缓了血管平滑肌细胞的增殖以及收缩合成表型的转变。我们认为其潜在机制可能涉及多种途径。一方面,H₂S减少了活性氧的生成;另一方面,它增强了SIRT6在C141位点的硫巯基化修饰。作者证实SIRT6保守活性中心的C141位点是H2S调节SIRT6功能的关键靶点。
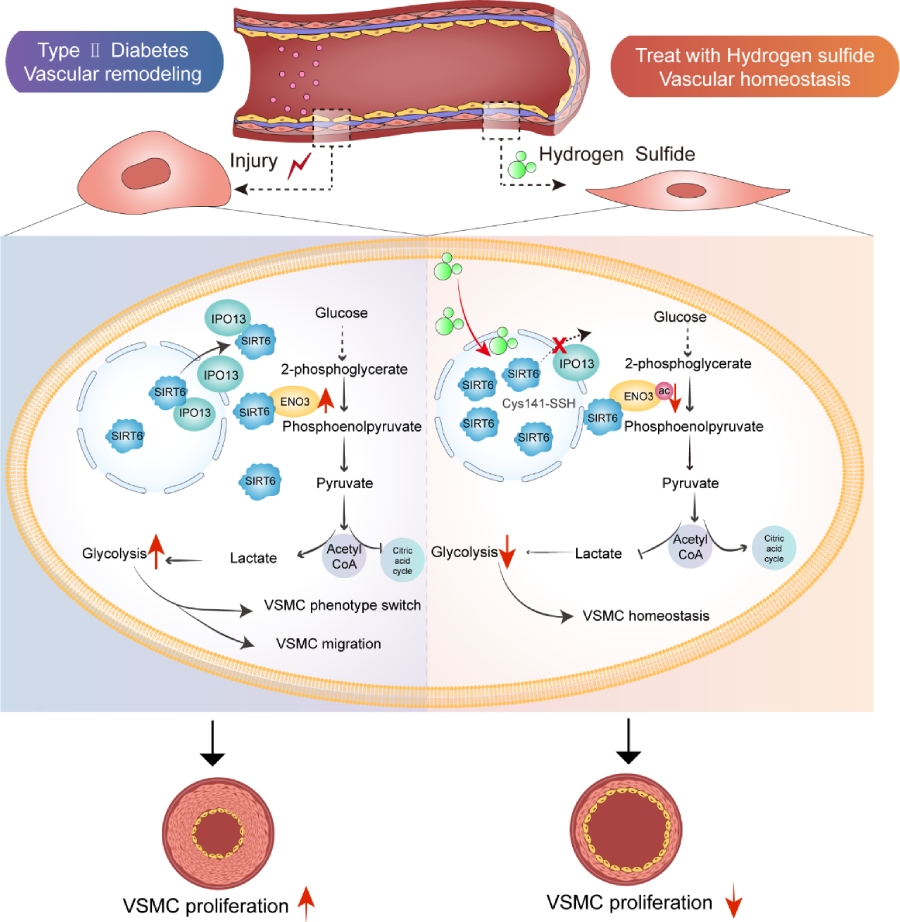
综上所述,胞质SIRT6通过促进病理性糖酵解参与糖尿病血管重塑。其中SIRT6在Importin 13(IPO13)介导下由核转位至胞质。进一步研究发现,胞质内积聚的SIRT6与糖酵解关键酶烯醇化酶3(ENO3)发生直接相互作用,促进ENO3去乙酰化,增强下游磷酸烯醇式丙酮酸(PEP)生成,从而诱导糖酵解重编程,最终导致糖尿病血管病变的病理性改变。此外,外源性硫化氢(H₂S)通过诱导SIRT6第141位半胱氨酸发生S-巯基化修饰,阻断SIRT6-ENO3相互作用,抑制病理性糖酵解并减轻VSMC过度增殖。该研究提出的SIRT6-ENO3信号轴通过调控血管糖酵解重编程参与糖尿病血管病变的发生发展,为靶向胞浆SIRT6作为糖尿病血管并发症的潜在治疗策略提供了新的理论依据。
研究总结
总体而言,该研究通过整合多组学分析、动物模型验证和细胞功能实验,全面揭示了细胞质SIRT6-ENO3轴调节糖酵解重编程和VSMC增殖相关血管重塑的新机制。研究发现高血糖和高血脂通过氧化应激和IPO13依赖的核输出过程促进SIRT6细胞质易位,易位的SIRT6通过去乙酰化ENO3增强其酶活性,驱动糖酵解重编程和血管平滑肌细胞异常增殖。更重要的是,外源性硫化氢通过恢复SIRT6第141位半胱氨酸的S-硫氢化修饰,抑制其细胞质易位并减弱ENO3活性,从而改善糖尿病血管病变。
这项研究首次阐明了细胞质SIRT6在糖尿病血管病变中的病理作用,为理解糖酵解重编程与血管重塑的分子联系提供了重要理论依据。该发现不仅丰富了对SIRT6功能多样性的认识,更为开发针对糖尿病血管并发症的新型治疗策略开辟了重要途径。特别是硫化氢作为内源性保护因子的作用机制解析,为临床转化应用提供了有力支撑,有望为改善糖尿病患者血管功能和预后带来新希望。
参考文献
[1] K. P. Zucatti, P. P. Teixeira, L. F. Wayerbacher, G. F. Piccoli, P. E. Correia, N. K. O. Fonseca, et al., Long-term Effect of Lifestyle Interventions on the Cardiovascular and All-Cause Mortality of Subjects With Prediabetes and Type 2 Diabetes: A Systematic Review and Meta-analysis,Diabetes Care.45 (2022) 2787-2795.
[2] J. Xie, M. Wang, Z. Long, H. Ning, J. Li, Y. Cao, et al., Global burden of type 2 diabetes in adolescents and young adults, 1990-2019: systematic analysis of the Global Burden of Disease Study 2019,Bmj.379 (2022) e072385.
[3] J. Shi, Y. Yang, A. Cheng, G. Xu, F. He, Metabolism of vascular smooth muscle cells in vascular diseases,Am J Physiol Heart Circ Physiol.319 (2020) H613-h631.
[4] S. H. Cao, R. Y. Ma, T. Cao, T. Hu, S. Yang, Z. Y. Ren, et al., PKM2 crotonylation reprograms glycolysis in VSMCs, contributing to phenotypic switching,Oncogene. (2025).
[5] M. O. J. Grootaert, A. Finigan, N. L. Figg, A. K. Uryga, M. R. Bennett, SIRT6 Protects Smooth Muscle Cells From Senescence and Reduces Atherosclerosis,Circ Res.128 (2021) 474-491.
[6] Q. J. Wu, T. N. Zhang, H. H. Chen, X. F. Yu, J. L. Lv, Y. Y. Liu, et al., The sirtuin family in health and disease,Signal Transduct Target Ther.7 (2022) 402.
[7] D. Sun, S. Chen, S. Li, N. Wang, S. Zhang, L. Xu, et al., Enhancement of glycolysis-dependent DNA repair regulated by FOXO1 knockdown via PFKFB3 attenuates hyperglycemia-induced endothelial oxidative stress injury,Redox Biol.59 (2023) 102589.
[8] R. Gupta, M. Sahu, R. Tripathi, R. K. Ambasta, P. Kumar, Protein S-sulfhydration: Unraveling the prospective of hydrogen sulfide in the brain, vasculature and neurological manifestations,Ageing Res Rev.76 (2022) 101579.
以上内容来源于BioArtMED,侵删







 京公网安备 11011302003368号
京公网安备 11011302003368号