2023年1月4日成都体育学院运动医学与健康研究所李顺昌教授团队在《Frontiers in Nutrition》(IF=6.59)发表T2D型糖尿病相关研究成果“MOTS-c repairs myocardial damage by inhibiting the CCN1/ERK1/2/EGR1 pathway in diabetic rats”,该研究揭示糖尿病常见并发症心脏结构重塑和功能障碍潜在治疗靶点MOTS-c,促进糖尿病患者的心肌损伤修复,帮助确定糖尿病心脏并发症管理中的潜在治疗策略。
Ps:李顺昌教授团队多次合作利用转录组测序全面精准揭示糖尿病相关发病机制和治疗策略,其实验方案设计值得大家借鉴参考。

研究背景
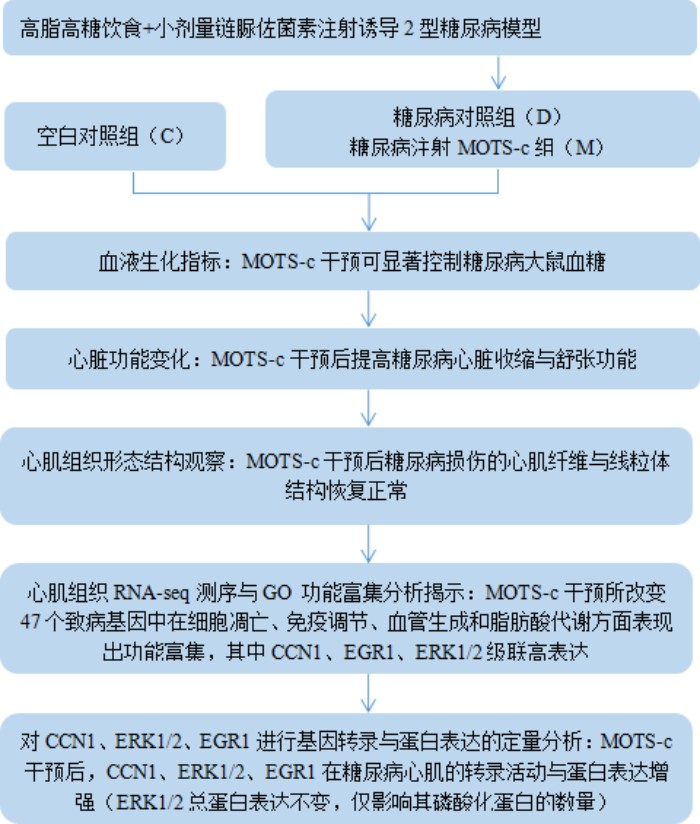
心脏重构和功能障碍是糖尿病常见的并发症,常导致严重的心血管事件。MOTS-c是一种线粒体衍生肽,通过加速葡萄糖摄取和提高胰岛素敏感性来调节代谢稳态。目前发现,MOTS-c不仅可改善心脏与血管内皮功能,且其含量在糖尿病患者血浆中明显下降,使其成为糖尿病心血管并发症的一个新的治疗靶点。所以,该研究旨在探究MOTS-c对糖尿病心脏结构与功能的影响并利用转录组学技术挖掘其中的分子机制。
材料方法
对照组(C,n = 10)和糖尿病前组(PD,n = 30)。PD组的大鼠服用含有67%正常颗粒、10%猪油、20%蔗糖、2%胆固醇和1%胆酸钠(16)的高脂肪饮食7周,糖尿病大鼠被随机分为两组:(1)糖尿病组(未经治疗)(D),(2)用MOTS-c(M)治疗的糖尿病大鼠,取对照组(C)、未治疗组(D)、治疗组(M)大鼠心脏组织,进行转录组测序(RNA-seq)。
研究思路
研究结果
1. MOTS-c显著降低糖尿病空腹血糖与胰岛素抵抗
MOTS-c治疗8周后,D组和M组大鼠体重低于C组(图1a和图1e)。与D组相比,M组大鼠空腹血糖水平降低(图1b)。此外,与C组相比,D组和M组大鼠胰岛素水平下降,D组和M组间胰岛素水平无显著差异(图1c)。通过计算HOMA-IR指数评估胰岛素抵抗。与C组相比,D组大鼠的HOMA-IR指数显著升高,而M组大鼠HOMA-IR指数较D组降低。
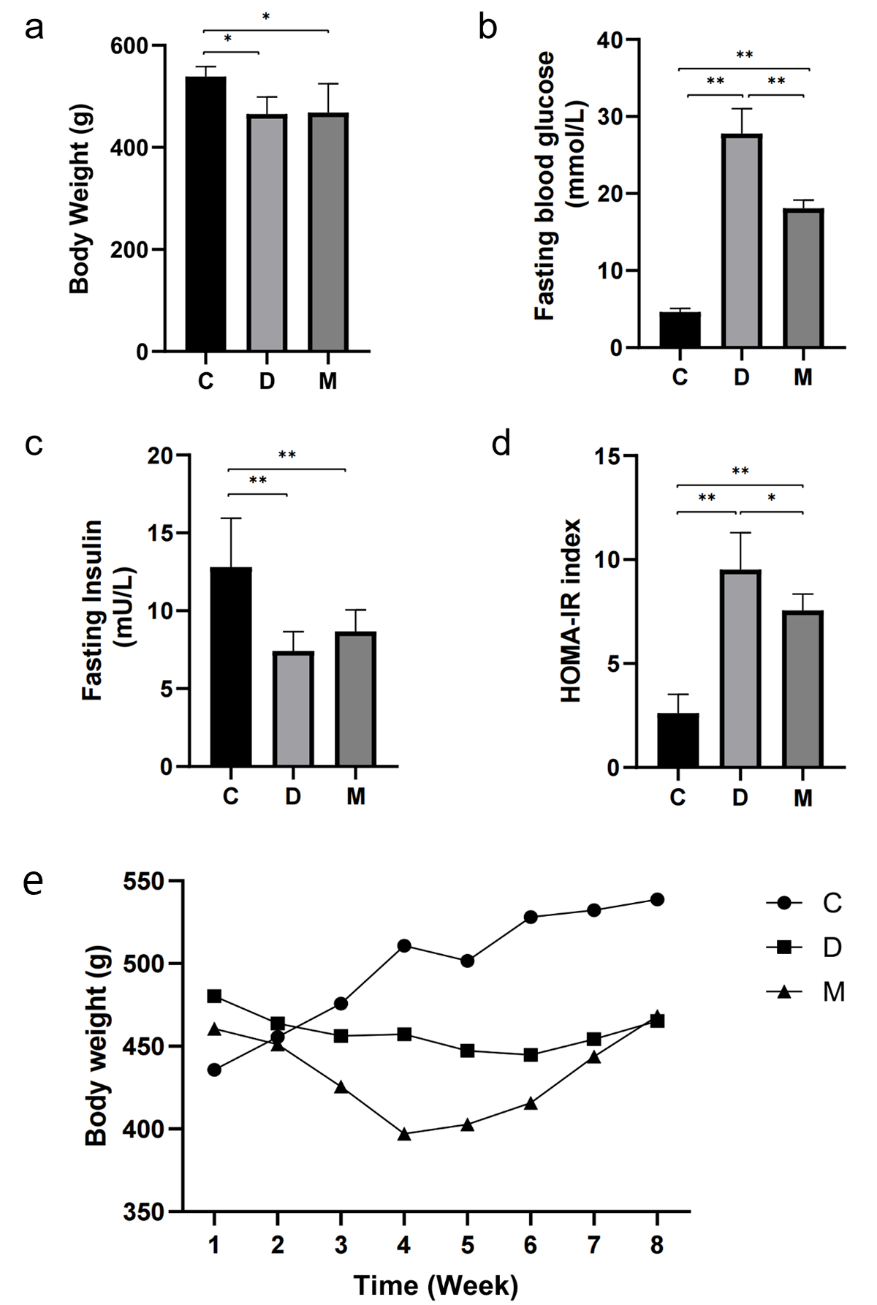
图1. MOTS-c干预后各组大鼠空腹血糖、空腹胰岛素、HOMA-IR与体重的变化
2. MOTS-c有效改善糖尿病心脏结构和功能
该研究利用透射电镜测定了MOTS-c对糖尿病心肌超微结构的影响。糖尿病引起心肌纤维排列紊乱和线粒体结构的异常改变,包括心肌细胞排列不规则、嵴破裂、肿胀和空泡化(图2)。MOTS-c治疗糖尿病大鼠显著降低心肌线粒体损伤,改善心肌纤维和线粒体结构(图2)。研究还通过测定柠檬酸合酶的活性,测定了线粒体功能。D组大鼠柠檬酸合酶的活性显著降低,C组和M组的柠檬酸合酶的活性无统计学差异(图3g)。
使用M型超声心动图测定大鼠心脏功能。D组大鼠LVPWd值明显升高,提示左心室出现病变(图3d)。与C组相比,D组大鼠EF值下降(图3b),提示糖尿病对照组大鼠心脏收缩功能受损。D组糖尿病大鼠的E峰值和A峰值均下降,而A峰值下降更快,因此增加了E/A比值(图3c、3e和3f)。M组和C组在EF、E/A、LVPWd、E峰值和A峰值方面均无差异(图3b-3f),表明MOTS-c心脏舒张功能和收缩功能。
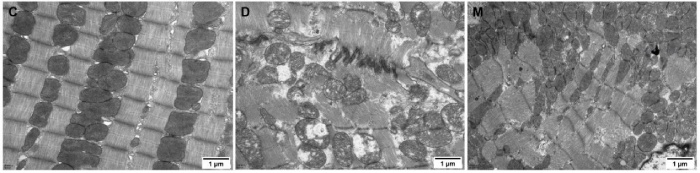
图2. 各组大鼠心肌组织透射电镜图像
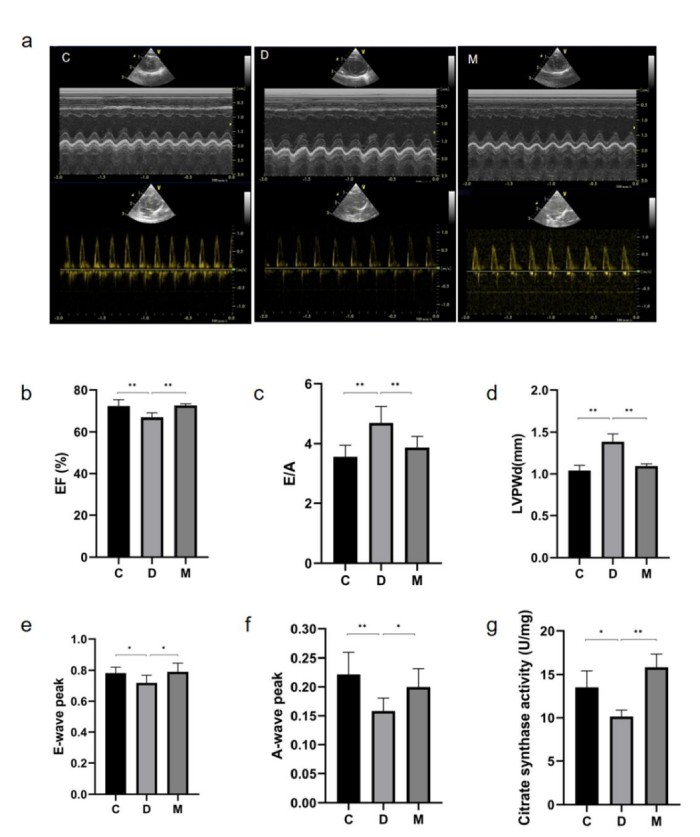
图3. 各组大鼠超声心动图影像与数据统计
3. 差异表达基因的筛选
为了进一步探究糖尿病大鼠对MOTS-c的适应性反应的机制,研究者利用RNA-Seq技术,测定了心肌组织基因全长转录表达。以C组为对照,D组表现出的差异表达基因(DEGs)即致病基因,再以D组为对照组筛选出M组的差异表达基因,二者筛选出的DEGs中重叠的基因即为MOTS-c改变的致病基因。将以上步骤执行,筛选出47个MOTS-c改变的致病基因(图4a)。将这47个基因进行热图分析后发现,C组基因表达趋势与D组相反,而与M组近似(图4b)。
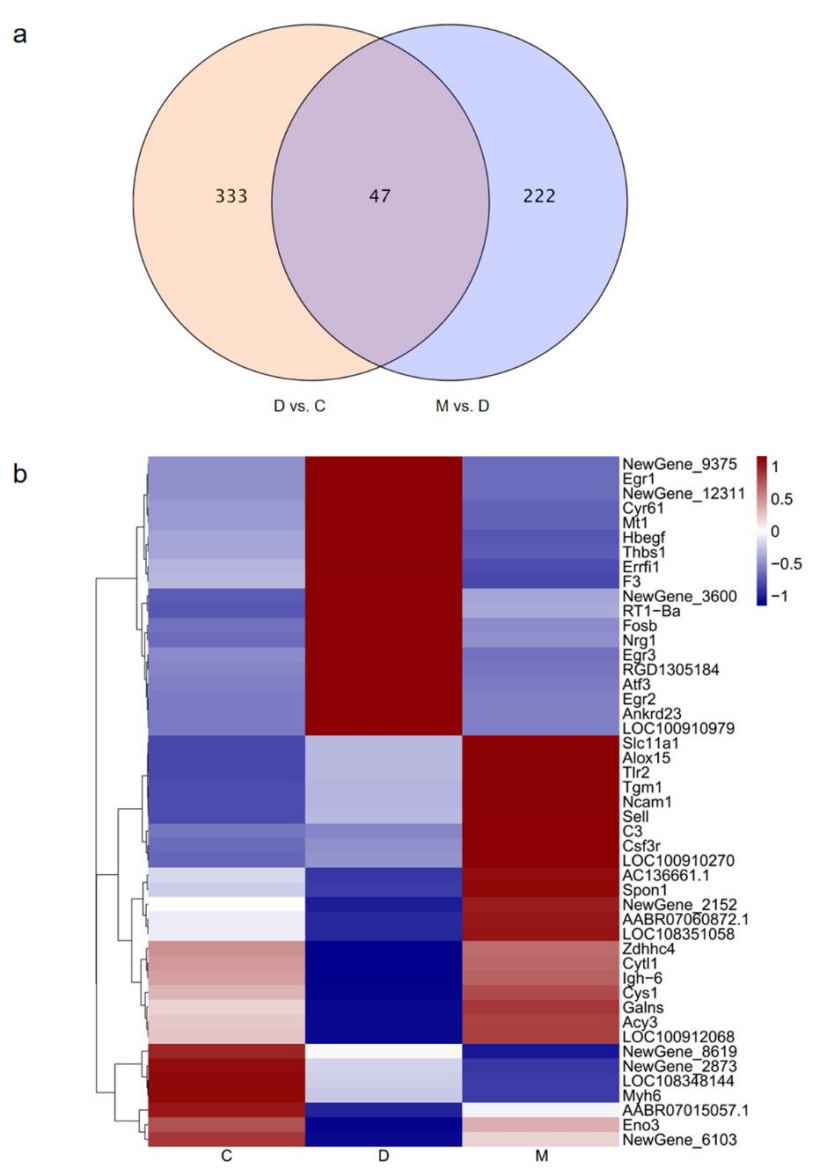
图4. 差异表达基因的筛选
4.差异表达基因的功能富集分析
采用Gene Ontology(GO)与Kyoto Encyclopedia of Genes and Genomes(KEGG)对MOTS-c所改变的47个致病基因进行功能富集分析。GO 注释系统包含三个主要分支,即:生物学过程(BP)、分子功能(MF)和细胞组分(CC)。)8 周 MOTS-c 注射所改变的 47 个糖尿病致病基因共富集于 195 个 GO term 中,其中 188 个 term 富集于 BP,2 个 term 富集于 CC,5 个 term 富集于MF。经过 ClueGO 聚类分析后,195 个 term 主要富集于 9 个类别(见图 5b),分别为血管生成(angiogenesis)、凋亡过程调控(regulation of the apoptotic process)、MAPK 级联调控(regulation of MAPK cascade)、蛋白激酶活性正调控(positive regulation of protein kinase activity)、脂肪酸代谢过程(fatty acid metabolic process)、吞噬作用调节(regulation of phagocytosis)、蛋白激酶 B 信号正调控(positive regulation of protein kinase B signaling)、ERK1/2 级联(regulation of ERK1/2 cascade)、胶质生成(gliogenesis)和白细胞介素-1 的产生(interleukin-1 beta production)。KEGG通路富集分析显示,18条KEGG通路显著富集(图5b),其中5条信号通路与免疫、凋亡和糖代谢相关(ErbB信号通路、补体和凝血级联、c型凝集素受体信号通路、PI3K-Akt信号通路和AGE-RAGE信号通路)。在功能富集通路注释基因中,ALOX15、ATF3、CCN1、EGR1、EGR3、ERRFI1、THBS1、TLR2和NRG1高频率注释。CCN1与EGR1基因高表达,同时均注释在凋亡相关的GO term中,而CCN1也注释于富集显著性最高的ERK1/2级联通路中,表明CCN1、ERK1/2与EGR1可能是相互关联的关键基因。
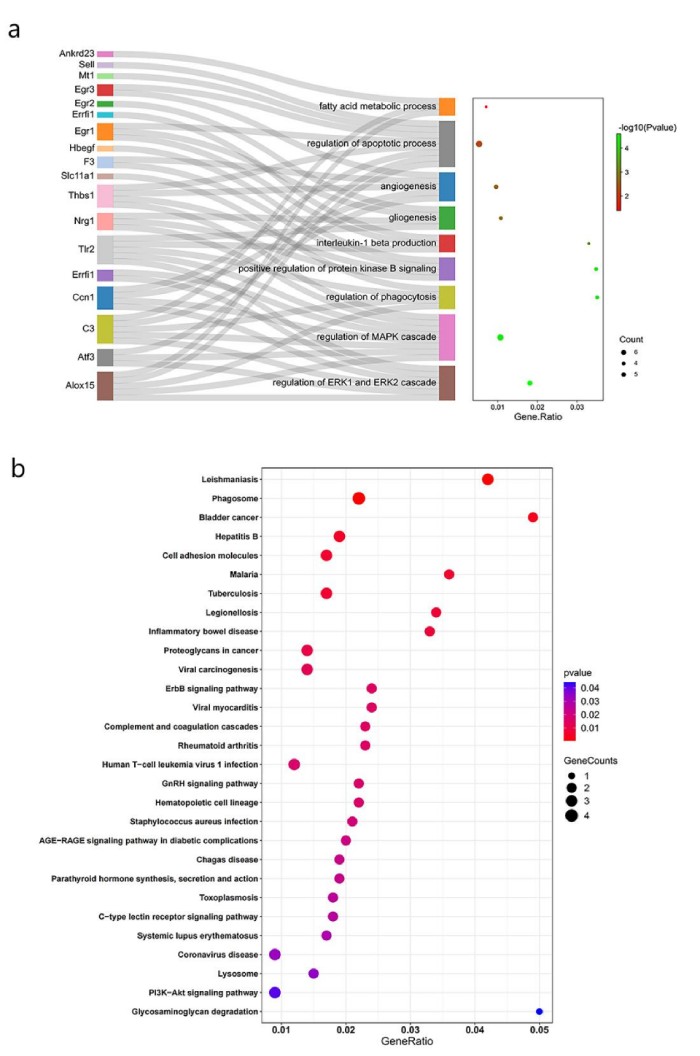
图5. GO与KEGG功能富集分析
5. MOTS-c对CCN1 / ERK1/2 / EGR1信号通路的影响
为了验证CCN1、ERK1/2与EGR1是否在MOTS-c改善糖尿病心脏结构与功能中发挥重要作用,也为了进一步探究MOTS-c对线粒体发生的作用,研究者利用RT-PCR与Western Blotting技术测定了CCN1、ERK1/2、EGR1的基因表达与蛋白表达以及线粒体发生标志蛋白PGC-1α的蛋白表达。结果表明,MOTS-c治疗后,糖尿病大鼠心肌中PGC-1α蛋白表达显著上升(图7a);CCN1、ERK1/2和EGR1基因表达显著降低(图6);CCN1、EGR1蛋白表达显著降低,ERK1/2的总蛋白表达量不变(图7),但多个研究表明MOTS-c仅影响ERK1/2的磷酸化水平。
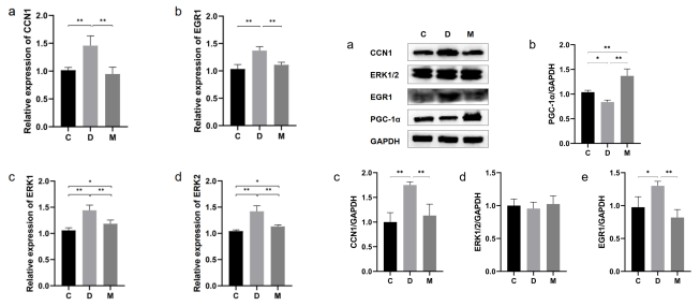
图6. 各组大鼠心肌中CCN1、ERK1/2与EGR1的基因表达和蛋白表达
研究结论
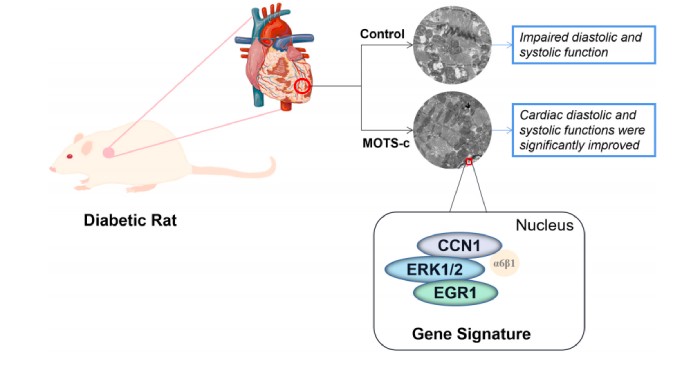
为期8周的MOTS-c治疗减少了糖尿病患者的心功能障碍与线粒体损伤,MOTS-c可能是通过调节脂肪酸代谢、免疫调节、血管生成和细胞凋亡产生作用。CCN1/ERK1/2/EGR1的信号转导可能在MOTS-c抑制心肌细胞凋亡中发挥重要作用。
参考文献
Manda Wang, Gangqiang Wang, Shunchang Li, et al. MOTS-c repairs myocardial damage by inhibiting the CCN1/ERK1/2/EGR1 pathway in diabetic rats. Front. Nutr., 04 January 2023Sec.
如果您对该研究思路感兴趣,欢迎长按识别下方二维码联系我们,我们将免费为您设计文章思路方案。








 京公网安备 11011302003368号
京公网安备 11011302003368号