环境与生物生存息息相关,而环境污染也对人类等生物的健康产生威胁,例如微塑料/纳米塑料(MPs/NPs)的危害目前已经波及到越来越大的范围,因此关于纳米塑料危害的研究热度一直居高不下。西北农林科技大学李振宇教授团队于2024年5月在 Journal of Hazardous materials 期刊发表题为“ Nanoplastics induced health risk: Insights into intestinal barrier homeostasis and potential remediation strategy by dietary intervention ” 的研究论文,研究了老化NPs对肠道屏障稳态的影响,并通过转录组学和分子生物学分析探讨了槲皮素对老化NPs毒性的缓解作用。

文章标题:Nanoplastics induced health risk: Insights into intestinal barrier homeostasis and potential remediation strategy by dietary intervention
发表期刊:Journal of Hazardous materials
影响因子:12.2
合作单位:西北农林科技大学
研究对象:对照组及老化NPs处理小鼠
研究方法:转录组+qPCR+ELISA等
百迈客生物为该研究提供了转录组测序技术服务。
研究背景
微塑料/纳米塑料(MPs/NPs)是由较大的塑料碎片的老化过程形成的,会造成对免疫稳态的破坏和肠道功能障碍,人类摄取MPs/NPs的方式主要是通过摄入食物和饮料,MPs/NPs被鱼类或海洋生物摄入后通过食物链积累并以食物方式进入人体,老化的纳米塑料(NPs)具有独特的环境作用特性,如表面粗糙、高氧含量等,有研究强调了老化NPs的潜在危害,但目前的研究为老化NPs污染修复提供了策略,槲皮素的饮食干预是解决老化NPs健康风险的一个新见解。
槲皮素 (Que) 占膳食总黄酮类化合物的 60-75%,是一种天然化合物,存在于人类饮食中的各种食物中,包括蔬菜、水果和茶,Que 及其衍生物可以调节多个细胞内靶标和细胞信号传导过程的能力,具有抗氧化和抗炎分子的作用,探索膳食补充剂 Que 是否可以改善 NPs 诱导的肠道屏障功能障碍具有重要意义。本研究通过转录组学、组织病理学和免疫学分析探讨老化 NPs 暴露下肠道屏障损伤的机制,此外,还评估了 Que 在老化 NPs 暴露下对肠道屏障的积极影响。
材料方法
材料:对照组(摄入去离子水);老化NPs(摄入146 mg/kg/d老化NPs);老化NPs+Que(摄入146 mg/kg/d老化NPs和80 mg/kg Que),取三组小鼠的肠道组织;
方法:转录组+qPCR+ELISA等
研究结果
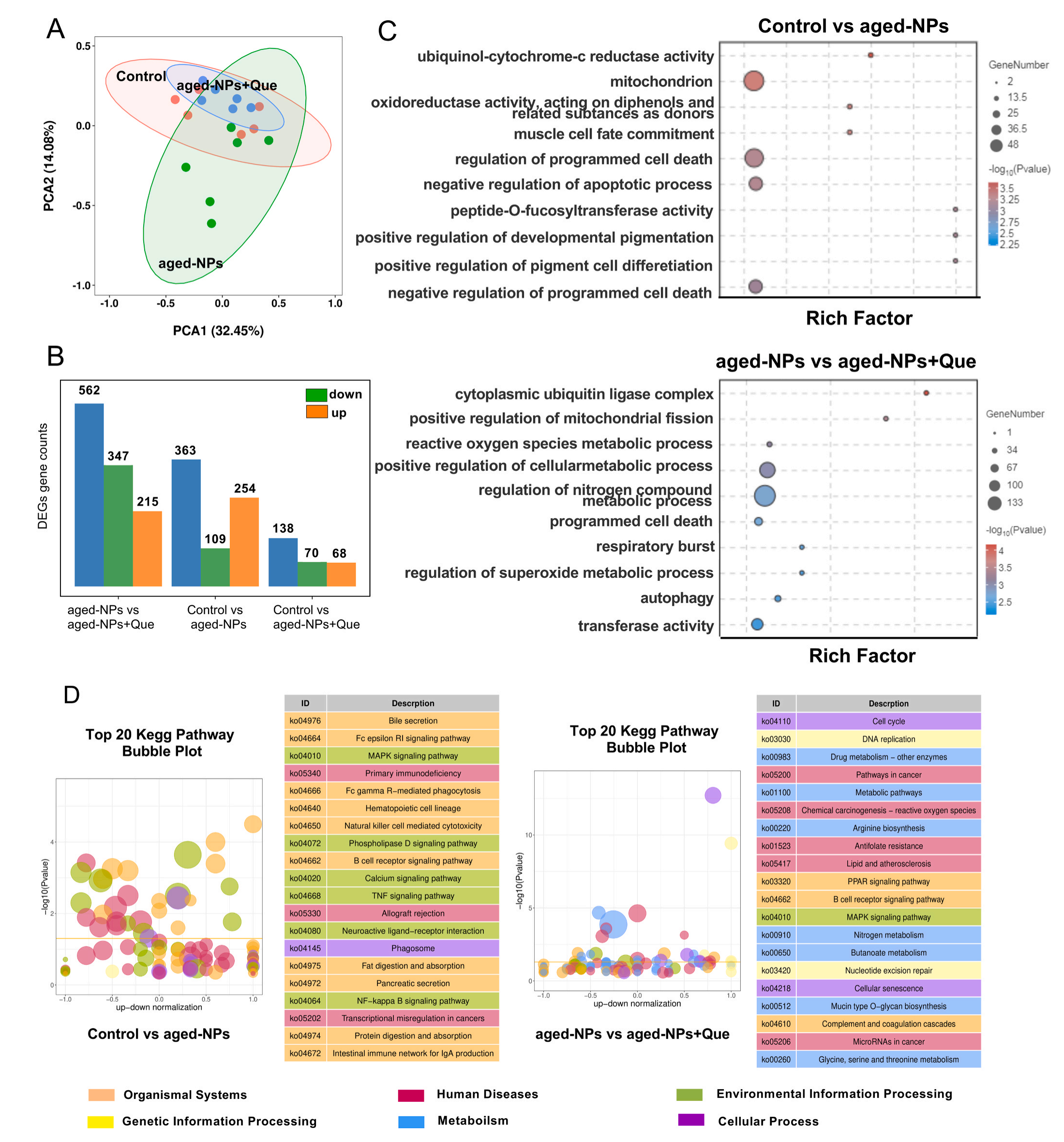
采用RNA测序(RNA-seq)检测老化NPs和Que对肠道的影响,与对照组相比,老化NPs共鉴定出363个差异表达基因(DEGs),包括254/ 109个上调/下调基因,与老化NPs相比,老化NPs+Que组中的DEGs为562个,包括347/215个上调/下调基因,GO富集结果显示老化NPs暴露后,显著富集集中在生物过程中,如肌肉细胞命运决定、程序性细胞死亡的调节和凋亡过程的负调控。
细胞成分中最突出的基因Term是线粒体,鉴定出45个DEGs,值得注意的是,老化的NPs影响了与氧化还原酶活性和泛醌细胞色素-c还原酶活性相关的活性,这些发现表明,老化的NPs会导致氧化应激、线粒体损伤和细胞凋亡,线粒体损伤激活线粒体凋亡通路,该通路在凋亡中起着重要作用,表明老化的NPs激活线粒体凋亡通路,最终导致细胞凋亡。而增加Que后,差异基因显著细胞代谢和细胞分解中,如氮化合物代谢、转移酶活性、正调控DNA修复等,KEGG富集结果显示,老化NPs组差异基因参与信号转导、免疫系统、癌症、转运和转分解代谢等通路,Que治疗后癌症的细胞代谢途径和途径显著富集,此外,Que干预改变了自由基代谢,如化学致癌-活性氧和GSH代谢,qPCR结果验证了相关基因表达。
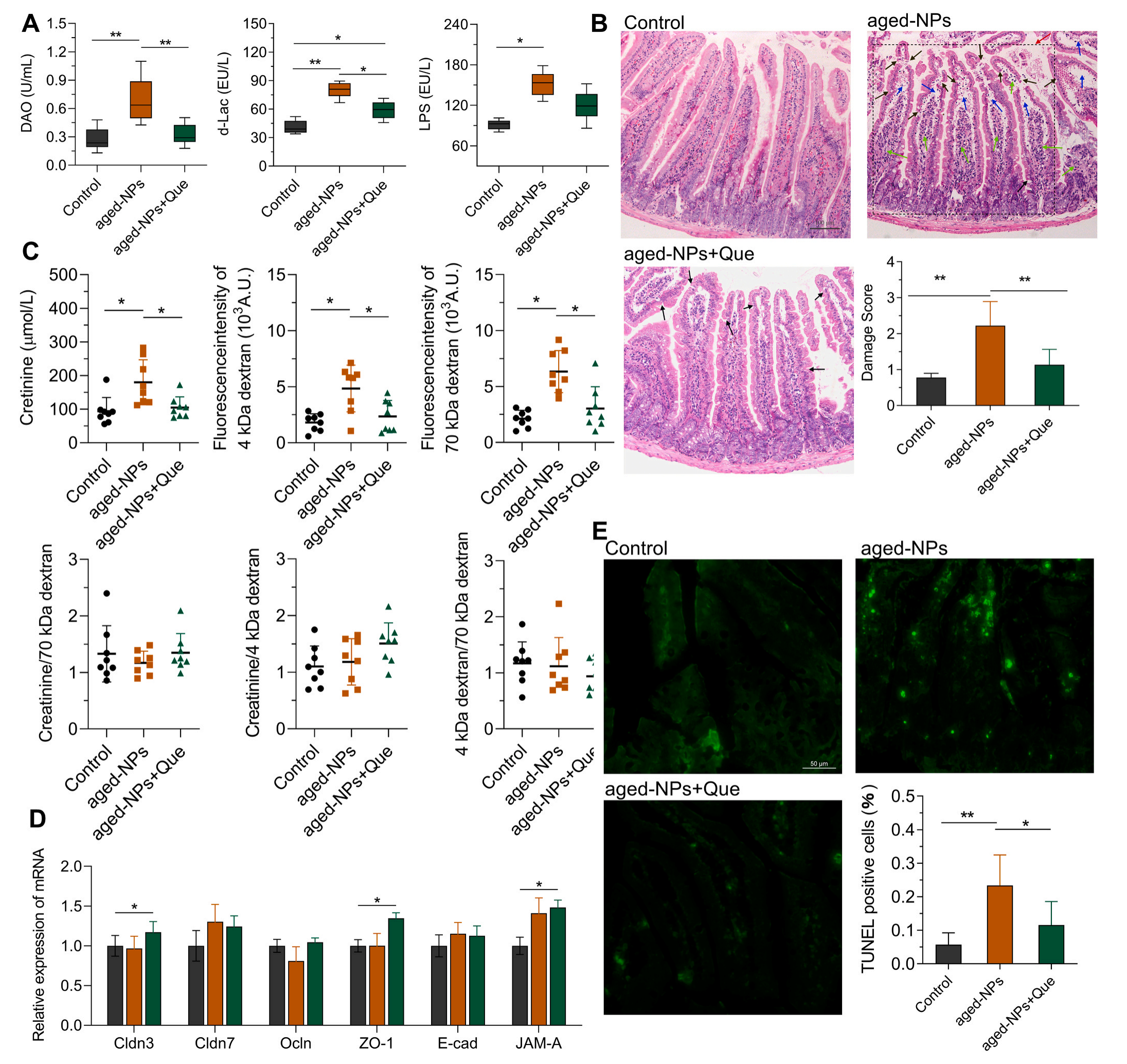
组织病理学结果显示,老化NPs组的血清DAO、d-Lac和LPS水平显著高于对照组,说明老化NPs诱导的肠道通透性增加,而Que降低了这些升高的水平,恢复了肠道屏障的完整性。形态学结果显示老化NPs组的肠绒毛结构有萎缩、变形、长度减少等结构损伤,Que治疗可减轻老化NPs引起的组织学损伤,促进肠腺体恢复,保留绒毛形态,减少淋巴细胞浸润,值得注意的是,Que保护了肠道内部结构,但对肠上皮和管腔之间的界面影响较小。
血清肌酐等指标结果显示,老化NPs刺激显著增加了血清中标记物的水平,表明细胞旁通透性增强,Que减弱了细胞旁通透性,恢复了接近对照的标记水平,这些结果说明肠道屏障的破裂主要归因于肠上皮细胞的丢失和死亡,而不是紧密连接的破坏。磨蚀效应和程序性细胞死亡可能为损伤的主要原因。TUNEL结果显示,与对照组相比,老化NPs组的荧光标记细胞更多,而老化NPs+Que染色的上皮细胞数量减少,表明Que对上皮细胞凋亡具有保护作用。JNK通路的激活通过bax-线粒体途径促进细胞凋亡,MAPK信号通路是KEGG富集通路之一,它在细胞凋亡过程中起着至关重要的作用,p-JNK作为MAPK通路的一个主要分支,p-JNK在老化NPs组显著增强,此外,衰老的nps也增加了JNK的靶蛋白c-Jun的磷酸化水平,结果表明,老化NPs通过JNK信号通路激活bax-线粒体凋亡通路,从而诱导细胞凋亡。在老化NPs处理中,DHE染色显示出较高的红色荧光密度和明显的亮点,表明ROS水平较高,而在老化NPs+Que中没有,添加Que显著降低了老化NPs处理后高过氧化氢和⋅O2-的存在,NOX活性测定结果显示,与对照组相比,老化NPs和老化NPs+Que处理均导致NOX活性增加,且之间无显著差异,表明Que的主要作用是作为一种自由基清除剂,而不是一种自由基生成的抑制剂。
为了探讨细胞凋亡的发生机制,该研究分析了细胞超微结构的改变和凋亡相关蛋白的表达,正常肠内细胞核完整,细胞膜光滑,微绒毛排列整齐,线粒体结构清晰,暴露于老化NPs会导致肠上皮细胞中微绒毛的部分缺失,此外,还发生了细胞扭曲,细胞分裂包括细胞核解体(黑色箭头)、染色质凝结(红色箭头)和细胞质密度增加。老化NPs小鼠的线粒体出现水肿、空泡化和破裂,并伴有嵴的紊乱和破坏(黄色箭头),提示细胞凋亡和线粒体损伤。老化NPs+Que小鼠的微绒毛排列更长、更有规律,表明Que对老化NPs诱导的损伤有有益作用。
此外,Que减轻了肠道内线粒体的混乱和空泡化,同时也消除了凋亡小体。与对照组和老化NPs组相比,老化NPs+Que组的细胞核中Nrf2水平显著升高,相反,在老化NPs+Que处理后,细胞质中Nrf2含量下降,这表明Que诱导的Nrf2核易位增强,与对照组相比,老化NPs导致p-p38/总p38、p-JNK/总JNK和p-c-Jun/cJun的比值显著增加,然而,在老化NPs+Que中观察到它们的显著减少。这表明Que抑制了p38、JNK和c-Jun的磷酸化。
研究总结
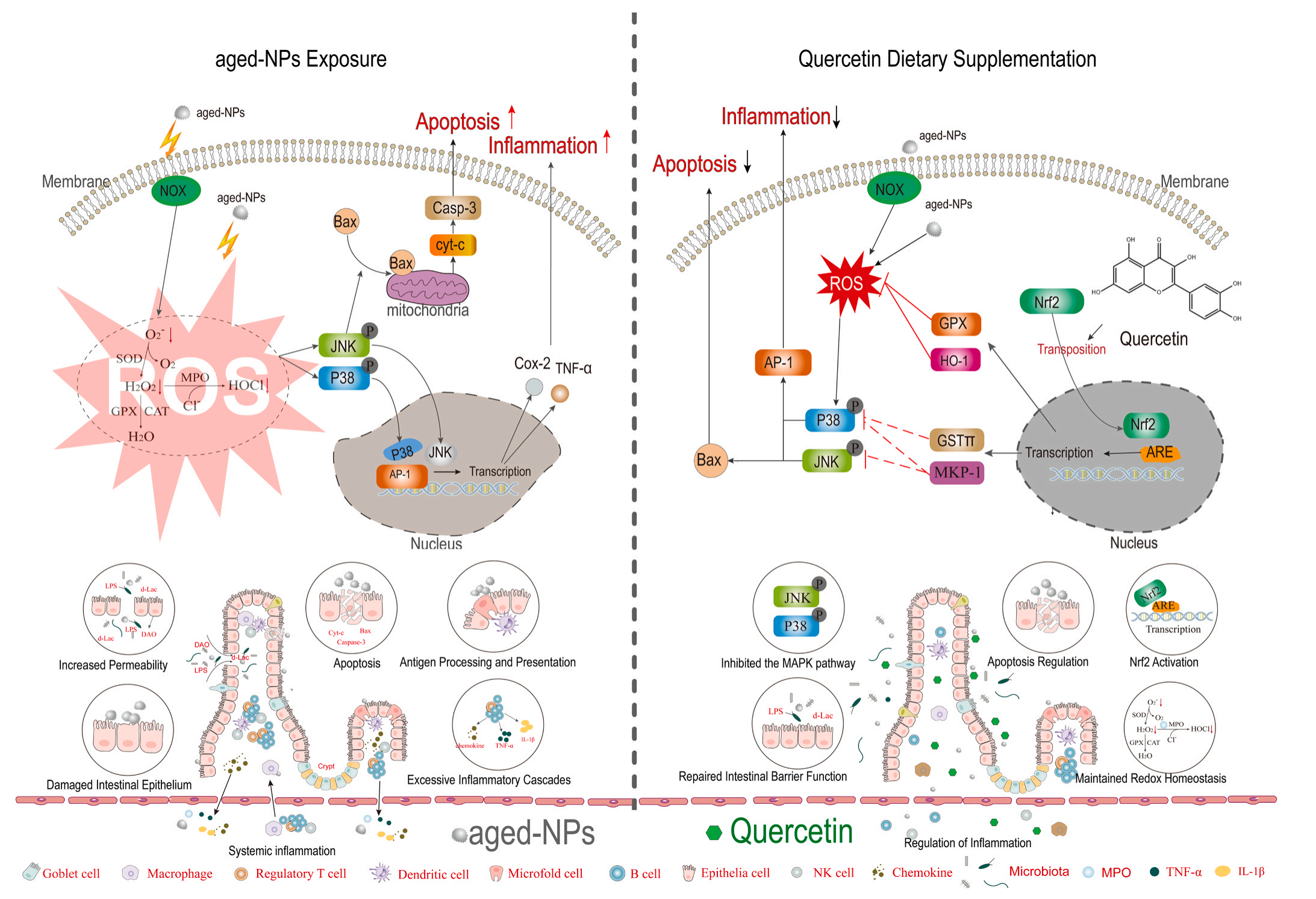
总的来说,该研究发现了膳食化合物对改善NPs引起的肠道损伤的潜力,老化NPs激活了免疫防御,最终增加了ROS的生成,引起全身炎症,其诱导的JNK磷酸化触发了c-Jun/AP-1靶基因的表达,促进了线粒体Bax易位,最终导致凋亡过程。Que作为一种外源性膳食抗氧化剂,促进Nrf2转位到细胞核,上调其下游靶基因HO-1和GSH,有效降低老化NPs诱导的肠道ROS水平和氧化应激。此外,Que刺激了MKP-1和GSTπ的表达,从而抑制了MAPK中关键酶的激活,从而逆转了老化NPs诱导的细胞凋亡和炎症反应。然而,Que可能不能有效缓解老化NPs引起的机械损伤,有待进一步研究揭示其潜在机制,结果表明,Que可减轻因消耗老化NPs而引起的肠道氧化应激、炎症和细胞凋亡,因此,富含Que的饮食在解决和逆转老化NPs造成的肠道损伤方面具有重要的前景。它证明了NPs的环境相关毒性,并为纠正NPs污染造成的人类健康风险提供了一种可能的饮食策略。
参考文献:
Meng X, Ge L, Zhang J, Xue J, Gonzalez-Gil G, Vrouwenvelder JS, Guo S, Li Z.Nanoplastics induced health risk: Insights into intestinal barrier homeostasis and potential remediation strategy by dietary intervention. J Hazard Mater. 2024 Jul 5;472:134509. doi: 10.1016/j.jhazmat.2024.134509. Epub 2024 May 3.







 京公网安备 11011302003368号
京公网安备 11011302003368号