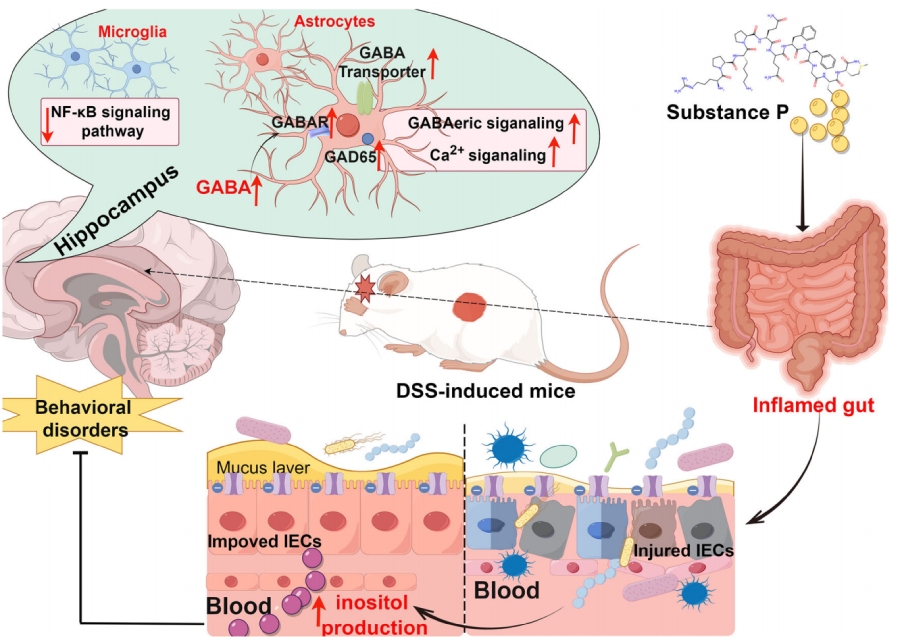
近日,中国农业大学团队在Nature Communications(IF=15.7)发表重磅研究:“Neuropeptide SP protects against colitis and linked anxiety-like behavior through the putative roles of gut microbiota and metabolite inositol”。

该研究为这一难题提供了全新解决方案:神经肽SP(Substance P)可通过重塑肠道菌群、促进菌群代谢物肌醇生成,同步改善DSS诱导的结肠炎与焦虑样行为。这项研究不仅首次阐明了“SP-肠道菌群-肌醇-海马体信号通路”的完整调控链,更以多组学技术与严谨的动物实验验证其机制,为IBD合并精神障碍的治疗开辟了新赛道。百迈客生物为该研究提供了非靶向代谢组和16S rRNA测序服务。
研究背景
炎症性肠病(IBD)包含溃疡性结肠炎和克罗恩病,是一种慢性肠道炎症疾病,患者焦虑发生率高达 30%、抑郁发生率达 25%,但肠道外的精神症状常被忽视。肠-脑轴介导肠道炎症与精神症状的关联,肠道微生物群及其代谢物通过肠 – 脑轴调控脑功能,但硫酸葡聚糖钠(DSS)诱导的肠道菌群变化如何影响情绪相关中枢系统尚不明确。
神经肽P物质(SP)在肠-脑轴各层面均有表达,已被证实具有抗炎、神经保护作用,且能改善DSS诱导的急性结肠炎,但SP是否通过肠道微生物群调控肠道屏障功能和中枢神经系统以改善焦虑样症状,尚未明确。
研究结果
SP改善DSS诱导的小鼠结肠炎症状
该研究采用DSS处理成功诱导出结肠炎小鼠模型。为评估SP在结肠炎发病机制中的作用通过静脉注射SP干预,从“肠道病理-肠道屏障-炎症因子-行为学” 多维度验证SP的保护作用。
SP处理显著降低疾病活动指数(DAI),减轻体重下降,恢复结肠长度,降低脾脏 / 体重比。HE染色显示,SP处理组结肠黏膜上皮完整、隐窝结构正常,黏膜下层无明显水肿和炎症细胞浸润,组织学评分显著低于DSS组;透射电镜观察到SP修复DSS导致的肠上皮细胞间隙增宽、微绒毛缩短卷曲。肠道屏障功能修复AB-PAS染色显示SP缓解DSS诱导的杯状细胞减少;免疫荧光证实SP上调肠道黏液屏障关键成分MUC-2的表达;FITC-葡聚糖检测表明SP降低肠道通透性,减少外来物质渗漏。Luminex检测显示,SP显著降低结肠组织中TNF-α、IL-1β、IL-6、IFN-γ等促炎因子水平,且SP单独处理组无明显异常症状。
DSS撤药后肠道炎症消退,SP仍能改善残留焦虑样行为,表明其对肠脑轴的调控不依赖肠道炎症缓解,具有独立性。
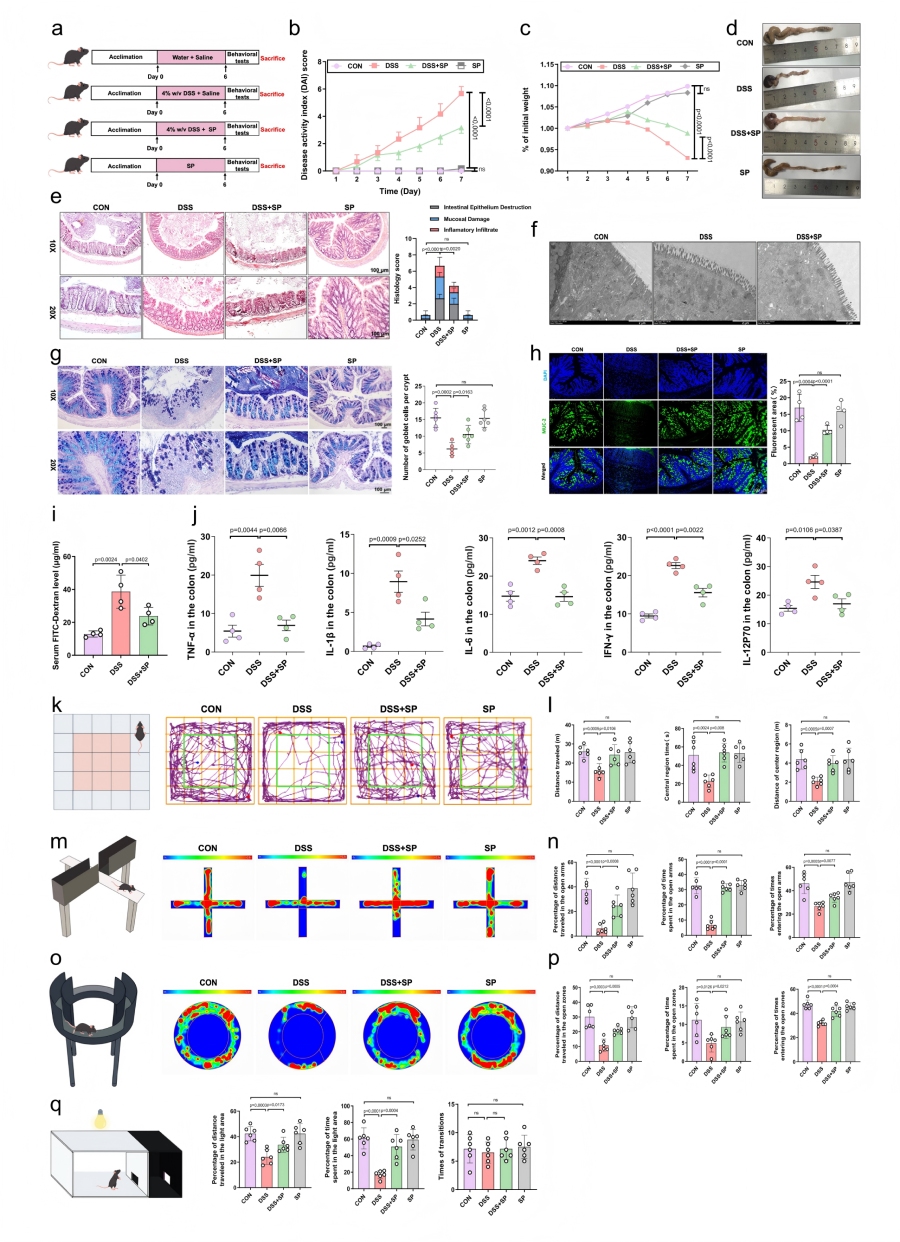
图1 SP改善DSS诱导小鼠的结肠炎症状及焦虑样行为
SP可减轻DSS诱导小鼠的海马损伤及神经炎症
海马损伤可影响情绪调节中枢的功能,进而导致抑郁和焦虑等精神障碍。通过组织学染色、细胞标记与细胞因子检测,探究SPSP在减轻神经炎症中的作用。
SP显著减轻DSS诱导的海马体神经元丢失、核固缩、尼氏小体减少等病理损伤,维持神经元形态完整。检测了海马组织中炎症介质的浓度,结果显示,SP显著降低了DSS处理小鼠海马中IL-1β、 TNF -α、IL-9、 IFN -γ、IL-13、IL-6、G-CSF、GM-CSF、 MIP -1β和IL-12P70的水平,但提高了IL-4、IL-5和IL-10的水平,结果表明,SP通过调节促炎细胞因子与抗炎因子之间的平衡,减轻了DSS诱导的海马神经炎症。
为探究SP对小胶质细胞/星形胶质细胞的影响,统计了各组海马区这两种细胞的数量。发现SP减少DSS诱导的Iba-1阳性小胶质细胞数量(抑制小胶质细胞活化),增加GFAP阳性星形胶质细胞数量(防止星形胶质细胞丢失);Western blot证实SP降低M1型小胶质细胞标志物iNOS的表达,上调星形胶质细胞标志物GFAP的表达。合理推断,SP通过减轻结肠炎小鼠海马区的病理损伤和神经炎症,改善了其焦虑样行为,这可能与抑制小胶质细胞向M1表型极化及防止星形胶质细胞丢失有关。
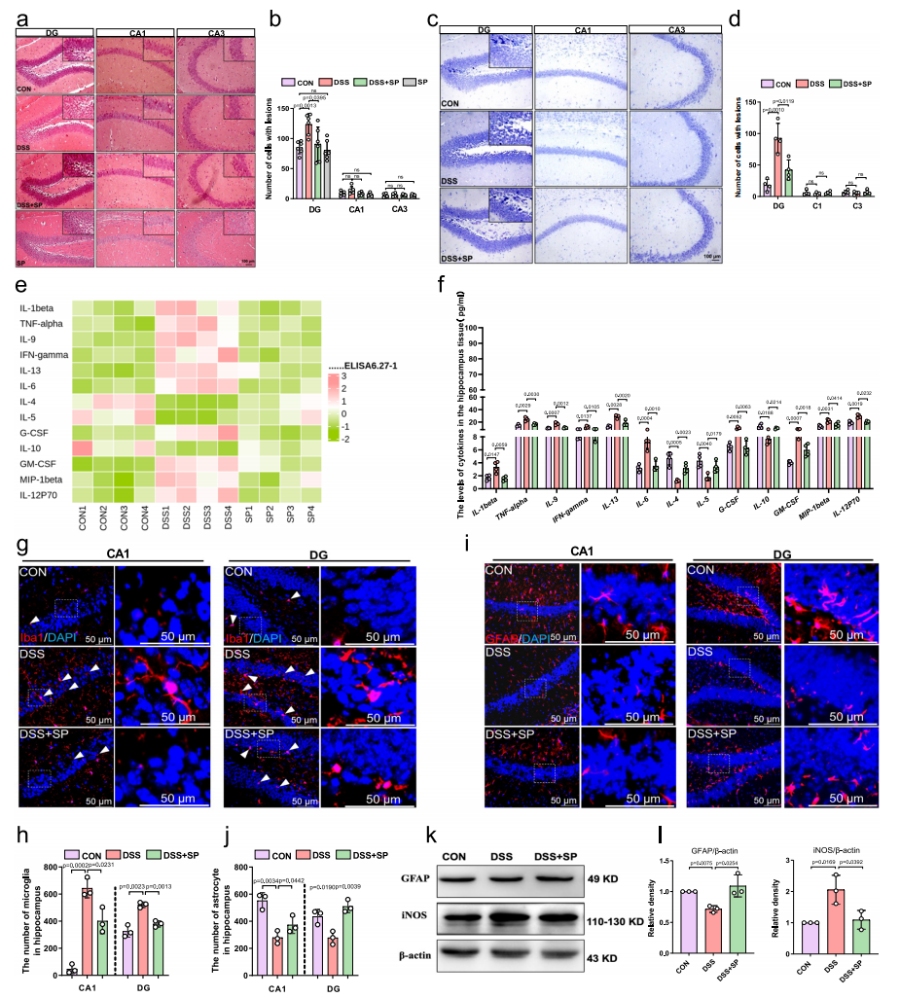
图2 SP减轻DSS诱导小鼠的海马损伤及神经炎症反应
SP改善DSS诱导小鼠肠道菌群失调并改变微生物组功能
探究SP是否通过肠道菌群发挥作用,通过16S rRNA测序分析SP对DSS诱导菌群失调的调控作用,结合PICRUSt2预测菌群代谢功能。
与DSS诱导组相比,SP对肠道菌群丰富度和多样性均未产生显著影响,PCoA分析显示CON组、DSS组和DSS+SP组之间存在显著差异,表明细菌群落结构存在显著差异。在门水平,SP 显著提高厚壁菌门(Firmicutes)相对丰度,降低拟杆菌门(Bacteroidetes)和变形菌门(Proteobacteria)丰度。在科水平,SP 增加毛螺菌科(Lachnospiraceae)、鼠杆菌科(Muribaculaceae)丰度,降低拟杆菌科(Bacteroidaceae)、肠杆菌科(Enterobacteriaceae)丰度。在属水平,DSS+SP组中拟杆菌属(Bacteroides)和拟杆菌亚属(Alistipes)的相对丰度降低,而unclassified_Lachnospiraceae、unclassified_Muribaculaceae和 Lachnospiraceae_NK4A136_group的相对丰度上调。PICRUSt2预测显示,SP显著激活肌醇磷酸代谢、胆汁分泌、NOD 样受体信号通路等功能模块,抑制戊糖磷酸途径、生物膜形成等DSS诱导的异常功能模块。
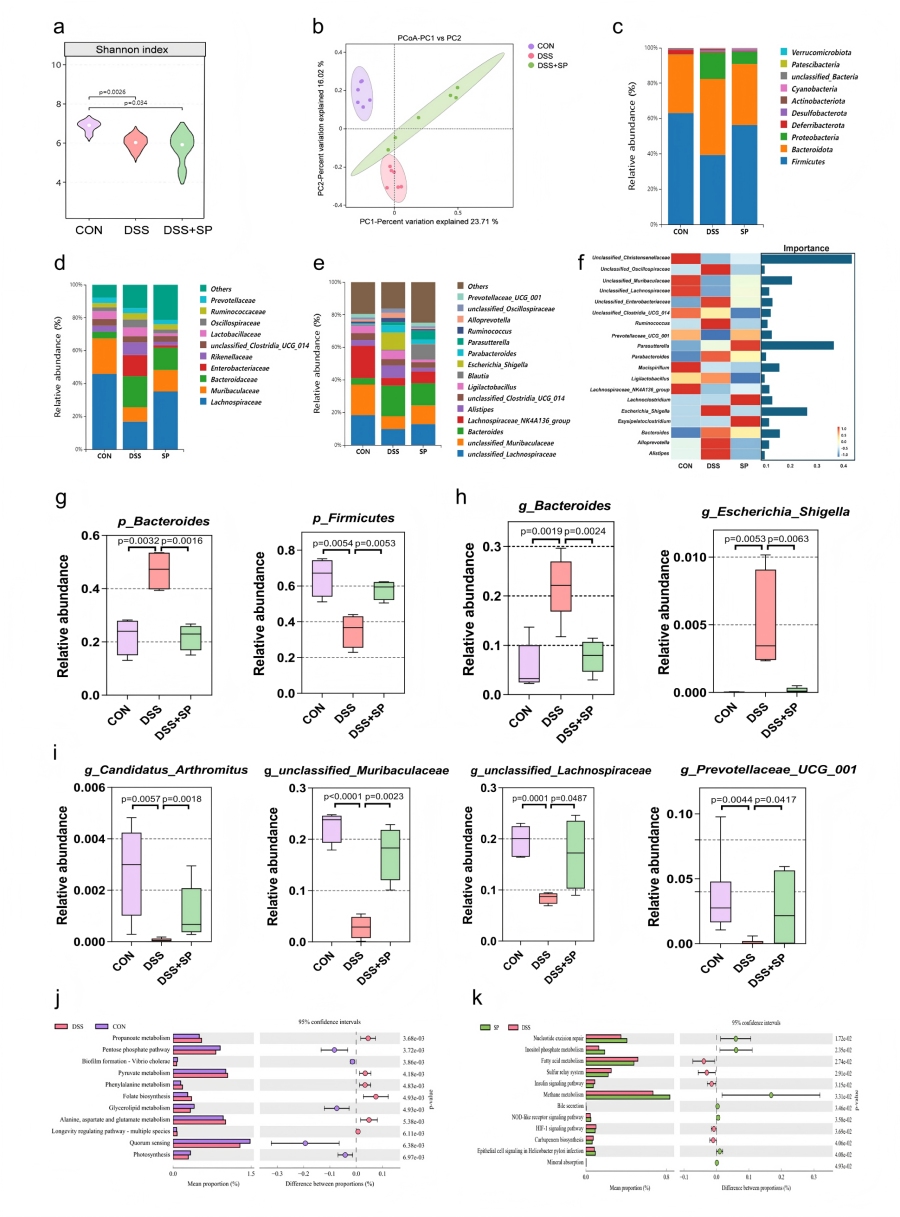
图3 SP可改善DSS诱导小鼠的肠道菌群失调并改变微生物组功能
SP通过调节肠道菌群预防DSS诱导的肠道损伤及焦虑样障碍
为验证肠道菌群是否为SP发挥作用的必需环节,进行了抗生素耗竭实验验证。ABX处理14天成功构建伪无菌小鼠模型后,SP对DSS诱导的结肠炎症状(DAI、体重、结肠长度、肠道结构)和焦虑样行为的改善作用显著减弱,表明SP的保护作用依赖肠道菌群。
同时进行了粪便微生物移植(FMT)实验验证,FMT-DSS+SP组表现出更轻的体重下降、更低的DAI、缓解结肠缩短以及降低的脾脏/体重比,肠道黏膜损伤减轻,杯状细胞数量增加,TNF-α、IL-6等促炎因子水平降低,MPO活性减弱。FMT-DSS+SP组小鼠海马神经元损伤也得到了缓解,促炎因子(TNF-α、IL-1β)mRNA表达降低,抗炎因子IL-4表达升高,小胶质细胞M1表型(iNOS、CD80)表达降低,M2表型(CD206)表达升高,星形胶质细胞GFAP表达上调。此外肠道菌群结构也与FMT-DSS组存在显著差异,厚壁菌门、未分类鼠杆菌科等有益菌群丰度升高,拟杆菌属等有害菌群丰度降低。
直接证实SP的保护作用依赖肠道菌群,排除SP直接穿过血脑屏障发挥作用的可能,明确菌群是SP调控肠脑轴的核心“中间人”。
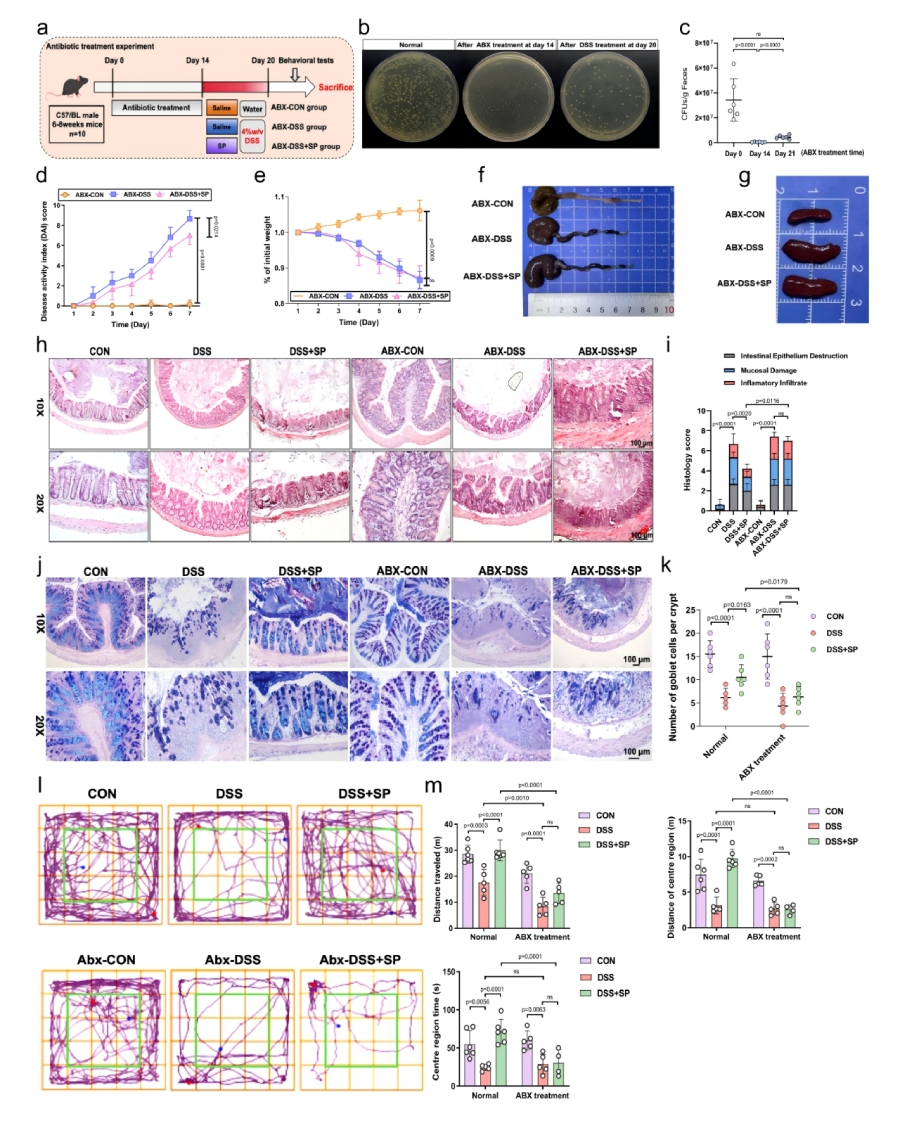
图4 SP以肠道微生物群依赖性方式预防DSS诱导的肠道损伤及焦虑样障碍
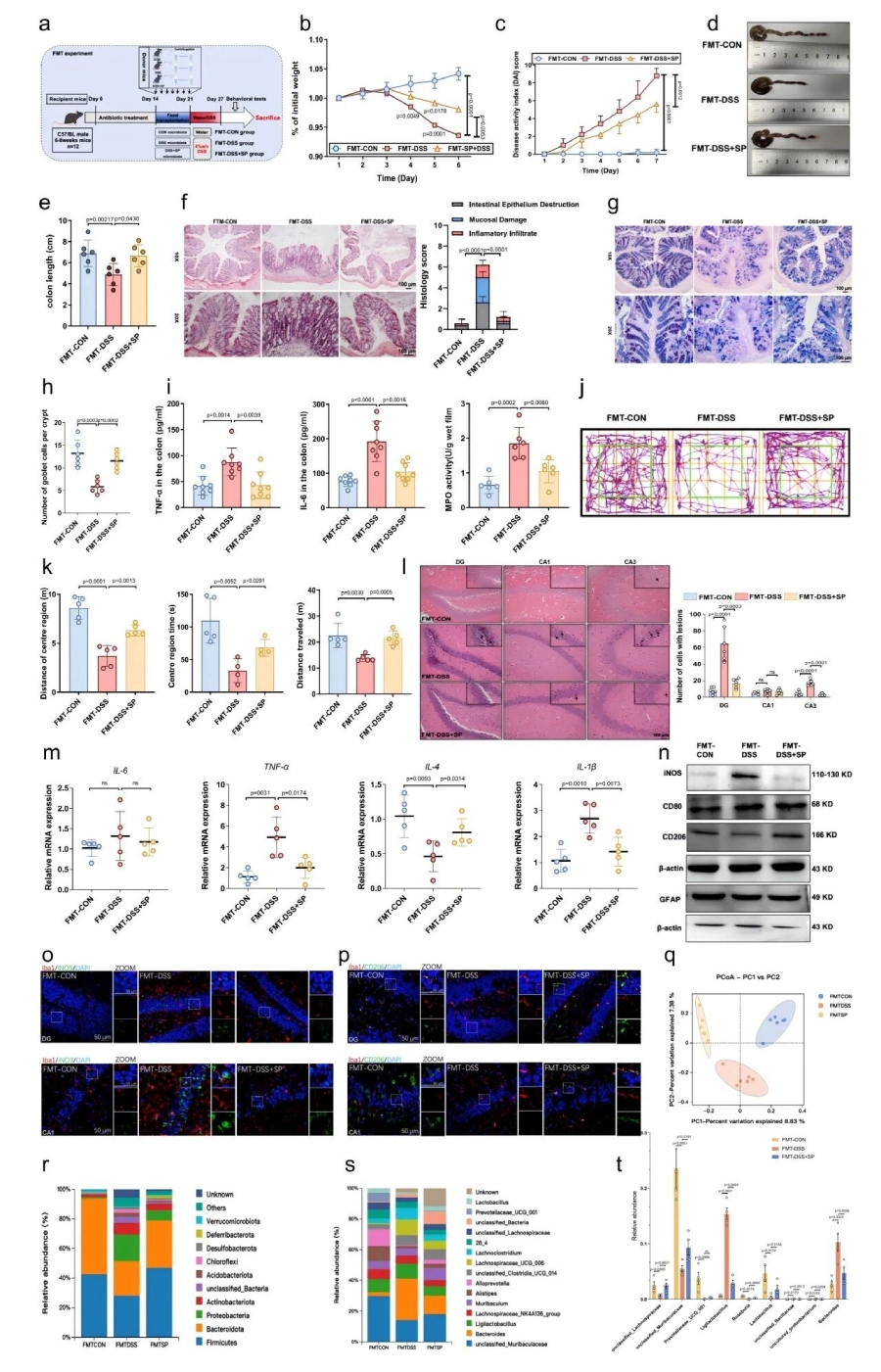
图5 FMT实验表明SP通过调节肠道菌群减轻了DSS诱导的结肠炎和焦虑样行为
SP通过调控肠道菌群影响海马基因表达,涉及NF-κB和GABAergic/Ca²⁺信号通路
通过转录组测序分析FMT处理小鼠海马体的差异表达基因,结合WB、免疫荧光染色,明确SP调控菌群后对脑内信号通路的影响。
RNA-seq显示,FMT-DSS与FMT-CON组存在436个差异表达基因(DEGs),FMT-DSS+SP组与FMT-DSS组存在387个DEGs,其中158个基因为共同调控基因。KEGG分析显示DSS组NF-κB通路激活,而SP通过菌群抑制其激活。qRT-PCR和Western blot证实,SP降低海马组织中IKBα、p65 的mRNA表达及p-p65、p-IKBα的蛋白表达;免疫荧光显示SP减少小胶质细胞中p-IKBα阳性信号,抑制小胶质细胞NF-κB通路激活。KEGG分析显示SP激活神经活性配体-受体相互作用和Ca²⁺信号通路。qRT-PCR显示SP上调海马组织中Gabra1、Gabra3、Gabrb2、Camk2d等基因表达;Western blot证实SP增加GABA_A Rα1、GABA_B R2、GAD65(GABA 合成关键酶)和CaMKII(钙浓度传感器)的蛋白表达。
免疫荧光显示SP增强星形胶质细胞中GABA_A Rα1和CaMKII的阳性表达;流式分选细胞RNA-seq显示,SP抑制小胶质细胞中NF-κB通路相关基因富集,促进星形胶质细胞中GABA能突触和钙信号通路相关基因富集。
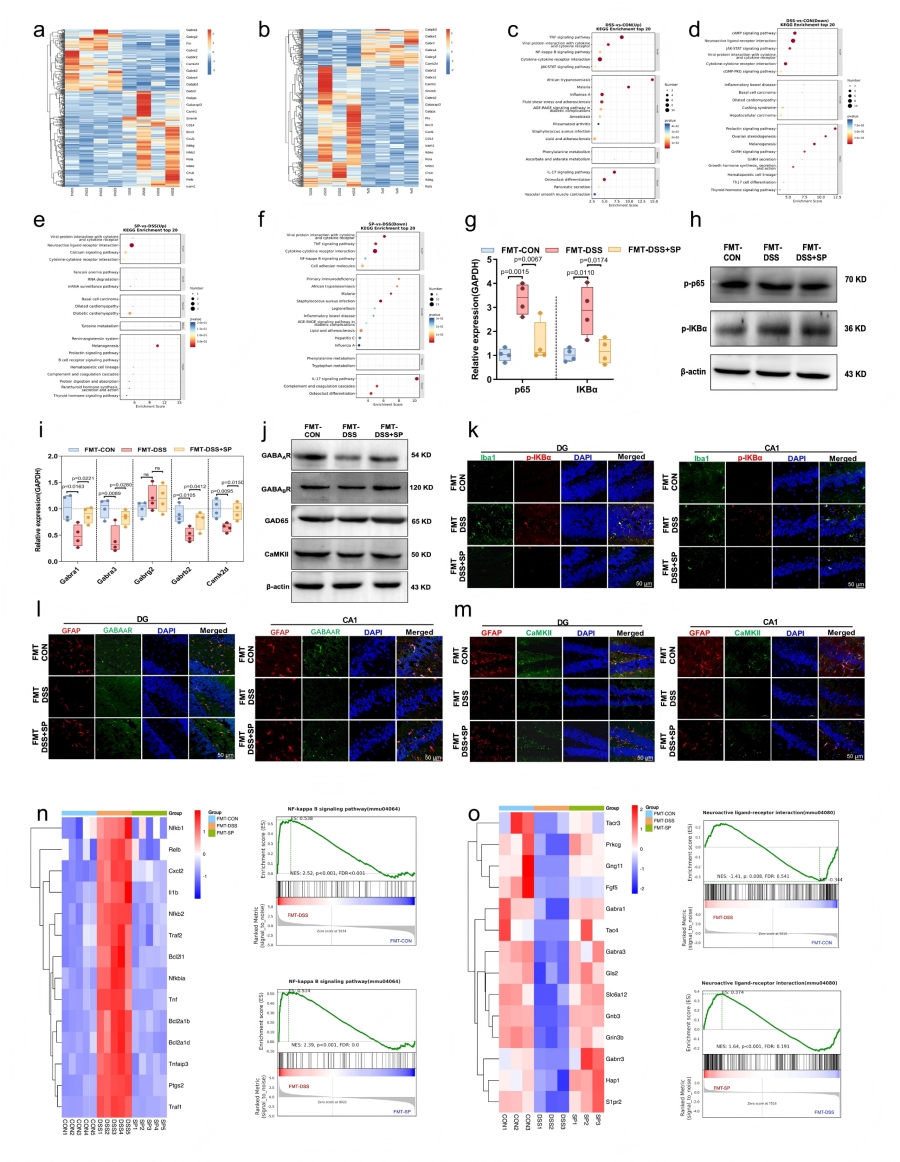
图6 SP通过调节肠道微生物组影响海马基因的表达
SP增强肠道微生物源性代谢物肌醇的富集
肠道菌群通过代谢物介导肠脑轴沟通,采用非靶向代谢组学分析DSS、DSS+SP、CON三组小鼠的结肠内容物代谢谱,筛选SP调控的关键代谢物。
PLS-DA分析显示,三组代谢谱存在显著分离,DSS+SP组代谢表型更接近CON 组,表明SP可逆转 DSS 诱导的代谢紊乱。共鉴定出395个差异代谢物,其中肌醇(inositol)是SP干预后升高最显著的代谢物之一,且富集于肌醇磷酸代谢、半乳糖代谢等通路。
Spearman相关性分析显示,肌醇水平与有益菌群呈正相关,与结肠炎严重程度呈负相关,提示肌醇可能是菌群介导 SP 保护作用的关键 “信使分子”。
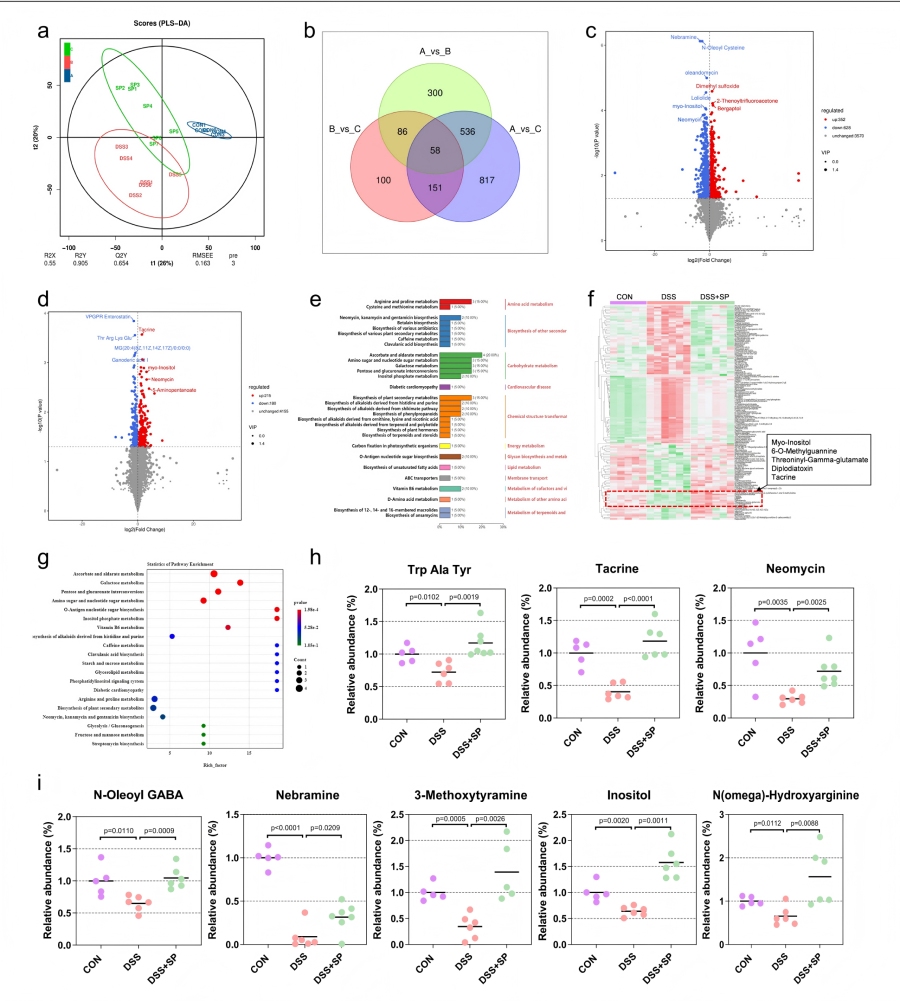
图7 SP可增强肠道微生物群源代谢物肌醇的富集
肌醇给药可改善DSS诱导的结肠炎及焦虑样障碍
通过饮水给予DSS诱导的结肠炎小鼠2%肌醇干预,验证肌醇是否能单独模拟SP的双向保护作用。
肌醇显著抑制DSS诱导的体重丢失和DAI升高,恢复结肠长度,修复肠道上皮损伤,上调E-cadherin,降低结肠组织中IL-1β、IL-6、TNF-α的mRNA表达。肌醇处理组在开放场试验中移动距离、中央区域活动增加,在高架十字迷宫中开放臂停留时间和进入次数增加,焦虑样行为缓解。肌醇缓解 DSS 诱导的海马神经元核固缩和尼氏小体丢失,降低海马组织中促炎因子(IL-6、IL-1β、TNF-α)mRNA 表达,升高抗炎因子IL-10表达;减少Iba-1阳性小胶质细胞数量,促进GABA合成与受体表达,增加星形胶质细胞及GAT1免疫阳性表达。而单独补充肌醇组与对照组(CON)相比,未观察到明显的肠道病理学和行为学改变。综上,这些数据表明肌醇可能是SP发挥有益效应的关键候选代谢物。
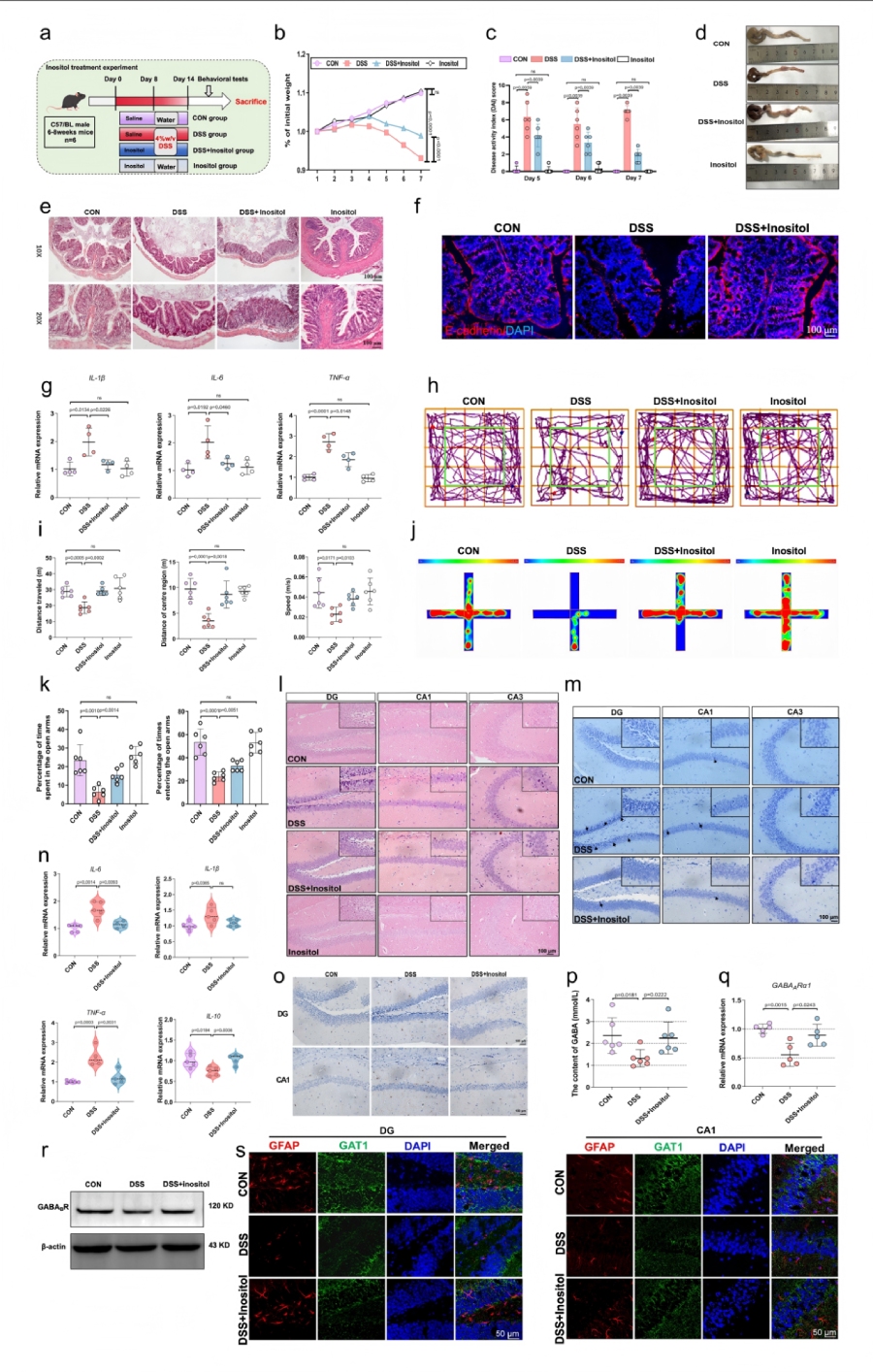
图8 肠道代谢物肌醇介导SP对DSS诱导小鼠结肠炎及焦虑行为的保护作用
肌醇在SP对DSS诱导小鼠焦虑样行为的作用中发挥关键作用
用肌醇合成抑制剂L-690330干预,验证肌醇是否为SP发挥作用的必需分子;同时通过体外细胞实验,验证肌醇对小胶质细胞与星形胶质细胞的直接调控作用。
L-690330处理后,SP对DSS小鼠的抗焦虑作用及海马体保护效应被显著逆转。肌醇水平升高:FMT-DSS+SP组小鼠海马体与血清中肌醇浓度显著高于FMT-DSS组,证实菌群衍生的肌醇可进入血液循环并作用于大脑。体外细胞验证:① 小胶质细胞(BV-2):100μM肌醇可显著降低LPS诱导的TNF-α、IL-1β、IL-6 等促炎因子表达,无细胞毒性;② 星形胶质细胞(C8D1A):肌醇可逆转LPS诱导的GABA受体及CaMKII蛋白表达下调,激活GABAergic/Ca²⁺信号通路。
明确肌醇在SP调控通路中的“不可替代”地位,同时证实肌醇可直接调控神经细胞功能,完善“菌群代谢物 – 脑”的调控链条。
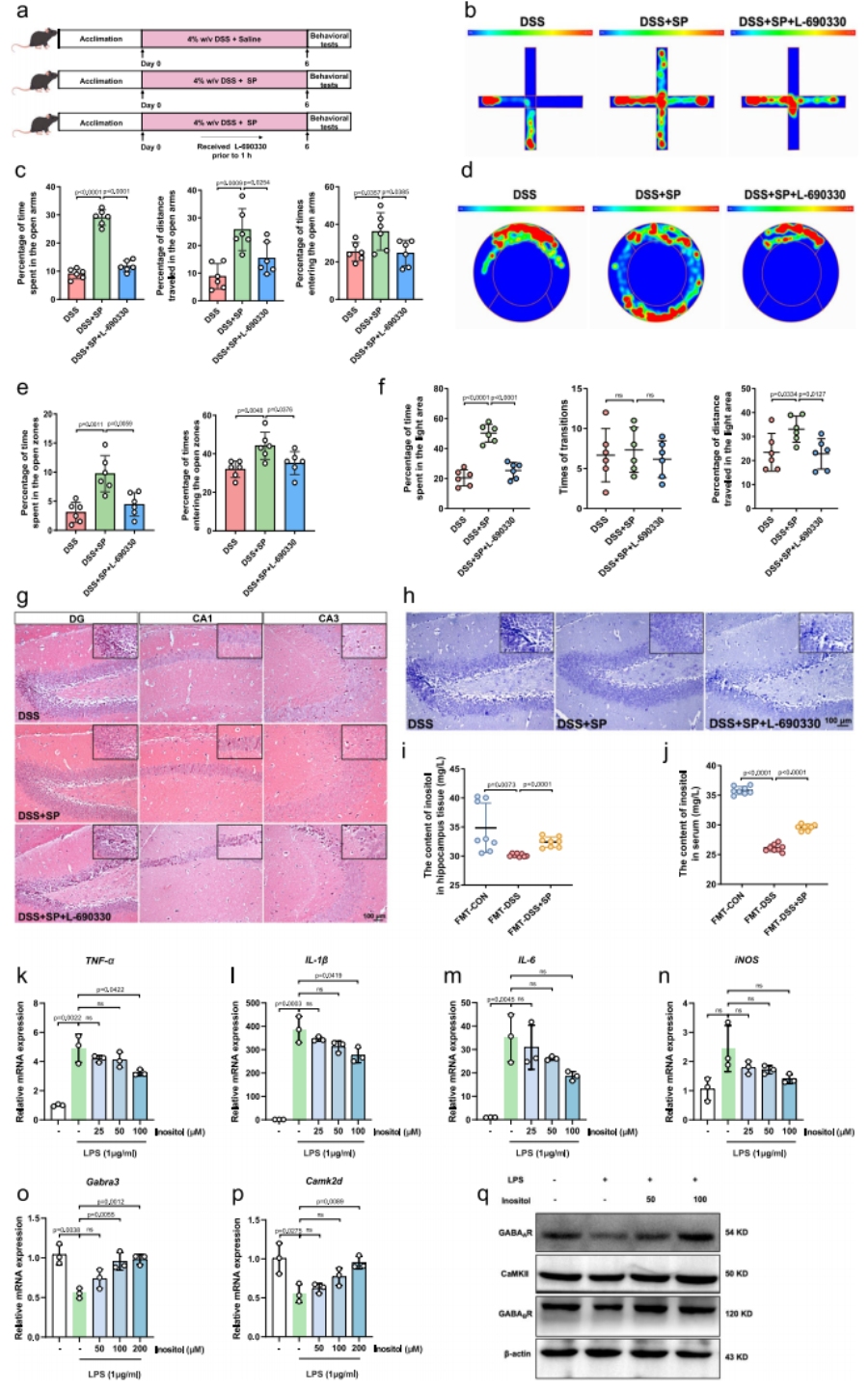
图9 肌醇在SP对DSS诱导小鼠焦虑样行为的作用中发挥关键作用
研究总结
SP通过调节肠道菌群结构,促进有益菌群产生肌醇;肌醇进入循环后作用于海马体,一方面抑制小胶质细胞NF-κB促炎通路,减轻神经炎症;另一方面激活星形胶质细胞GABAergic/Ca²⁺信号通路,增强抗焦虑神经传导;最终实现对结肠炎的肠道保护与焦虑样行为的神经调节,形成“SP-肠道菌群-肌醇-海马体”的完整调控轴。







 京公网安备 11011302003368号
京公网安备 11011302003368号