2024年5月,宁夏回族自治区人民医院在国际学术期刊Aging发表一项重要研究成果,题为:Single-cell BCR and transcriptome analysis reveals peripheral immune signatures in patients with thyroid-associated ophthalmopathy。使用单细胞RNA测序 (scRNA-seq)、scBCR-seq来剖析甲状腺相关眼病患者外周免疫特征。

文章标题:Single-cell BCR and transcriptome analysis reveals peripheral immune signatures in patients with thyroid-associated ophthalmopathy
期刊名称:Aging.
合作单位:宁夏回族自治区人民医院
研究部位:眼
研究方法:scRNA-seq、scBCR-seq、流式细胞术
百迈客生物为该研究提供了单细胞测序服务。
研究背景
甲状腺相关性眼病(Thyroid-associated Ophthalmopathy, TAO)是一种眼眶特异性自身免疫性疾病,可导致毁容,并可能导致失明。目前,TAO的病因尚不清楚。TAO可与甲状腺功能亢进症、甲减症合并使用,甲状腺功能正常的患者数量逐年增加。它是一种器官特异性自身免疫性疾病,与甲状腺功能有关,相对独立。具有特征性眼部体征的TAO的常见症状是眼睑回缩,伴或不伴眼突出,占所有 TAO的70-80%。它是Graves病(Graves’s disease,GD)的主要甲状腺外表现,约20%-50%的GD患者受累。由于对其潜在免疫畸变的了解有限,因此开发有效的治疗方法受到限制。
实验材料
采用scRNA-seq和单细胞BCR测序 (scBCR-seq) 技术来研究具有活性TAO、不活性TAO和NC的个体之间细胞组成和BCR库的变化。
1、scRNA-seq、scBCR-seq
使用来自6名TAO患者和3名NC的血液样本进行scRNA-seq和scBCR-seq。
2、流式细胞术
15名非活动性TAO患者、7名活动性TAO患者和10名NC用于流式细胞术分析。
研究结果
1.TAO患者外周免疫细胞的单细胞转录谱
为了了解疾病不同阶段单细胞转录组的异质性,该研究根据CAS标准将TAO患者分为两组:眼眶炎症明显的为活动组,临床症状轻微的为非活动组。从每位受试者的全血中分离出PBMC以供进一步研究。
该研究使用10x Genomics Chromium平台对总共9个样本进行了scRNA-seq。经过初步质量控制后,总共获得了93,007个PBMC用于后续分析,其中包括来自活性TAO的23,051个细胞、来自非活性TAO的34797个细胞和来自正常对照 (NC) 的35,159个细胞。基于图的聚类分析确定了17个不同的聚类。在手动确认细胞类型注释后,该研究成功将簇分为五种主要的PBMC细胞类型。其中包括各种CD4+ T细胞群 (CD4+)、NK (CD56+)、CD8+T细胞 (CD8A+)、B细胞 (CD19+) 和骨髓细胞 (CD11b+)(图1A,1B)。通过流式细胞术分析验证了scRNA-seq鉴定的这五种细胞类型的存在(图1C)。值得注意的是,17个细胞簇中的12个 (70.6%) 包含来自多个单独样本的至少100个细胞,每个簇内平均有9个单独样本。
接下来,该研究试图根据疾病阶段检查这些人群的患病率变化。作者计算了通过 scRNA分析识别的每个簇相对于每个患者样本的簇总数的百分比(图1D)。研究结果显示,患者的免疫特征存在显着差异,活性TAO显示显着的B细胞浸润 (p=0.047) 和骨髓细胞浸润 (p=0.008) 。相比之下,NK细胞主要在非活性TAO (p=0.022) 和 NC (p=0.059) 中观察到。尽管差异未达到统计学显着性,但非活性TAO和NC样本均显示出CD4+T细胞的富集。CD8+T细胞的比例在这些样本组中表现出最小的变化。这些发现强调了活跃TAO个体中PBMC组成的变化,强调了深入了解细胞亚型多样性和与疾病阶段相关的状态的重要性。
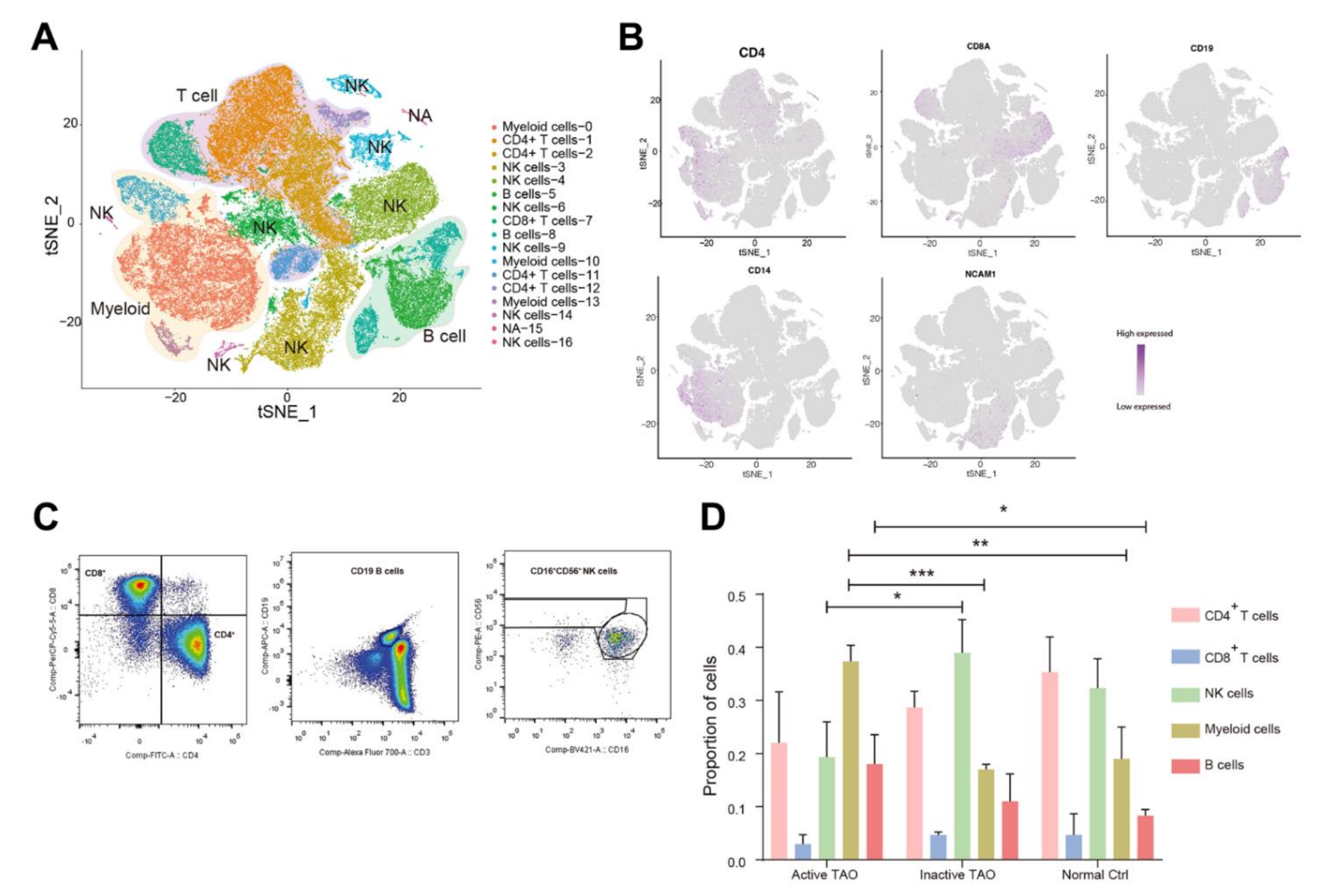
图1-TAO患者外周免疫细胞的单细胞转录谱
2.调节性B细胞参与TAO期间的免疫调节
为了全面了解B细胞的异质性及其在TAO中的作用,该研究基于RNA-seq数据进行了进一步分析,以确定其不同的亚群。使用基于图的聚类,该研究确定了五个亚群,总共包含9493个B 细胞(图2A)。此外,该研究彻底评估了与B细胞谱系相关的一组综合基因的表达,以更深入地了解它们的独特特征。滤泡B细胞的特征是表达IGHD(IgD)和CD23(也称为FCER2)。边缘区B群体表现出JCHAIN(IgM) 和CD21的高表达。Bregs根据CD1d、CD5、CD19、CD24、CD38和CD27的表达进行鉴定。此外,生发中心B细胞被认为是显示高水平CD20 (MS4A1)、CD38 和FCRL3的簇。最后,少量B细胞被鉴定为多淋巴祖细胞,表达CD45RA (PTPRC)、CD34和CD10(MME)(图2B)。每个B细胞亚群的前10个不同表达基因 (DEG) 为该研究的注释提供了额外的证据,并支持每个 B 细胞亚群的独特身份和功能特征。
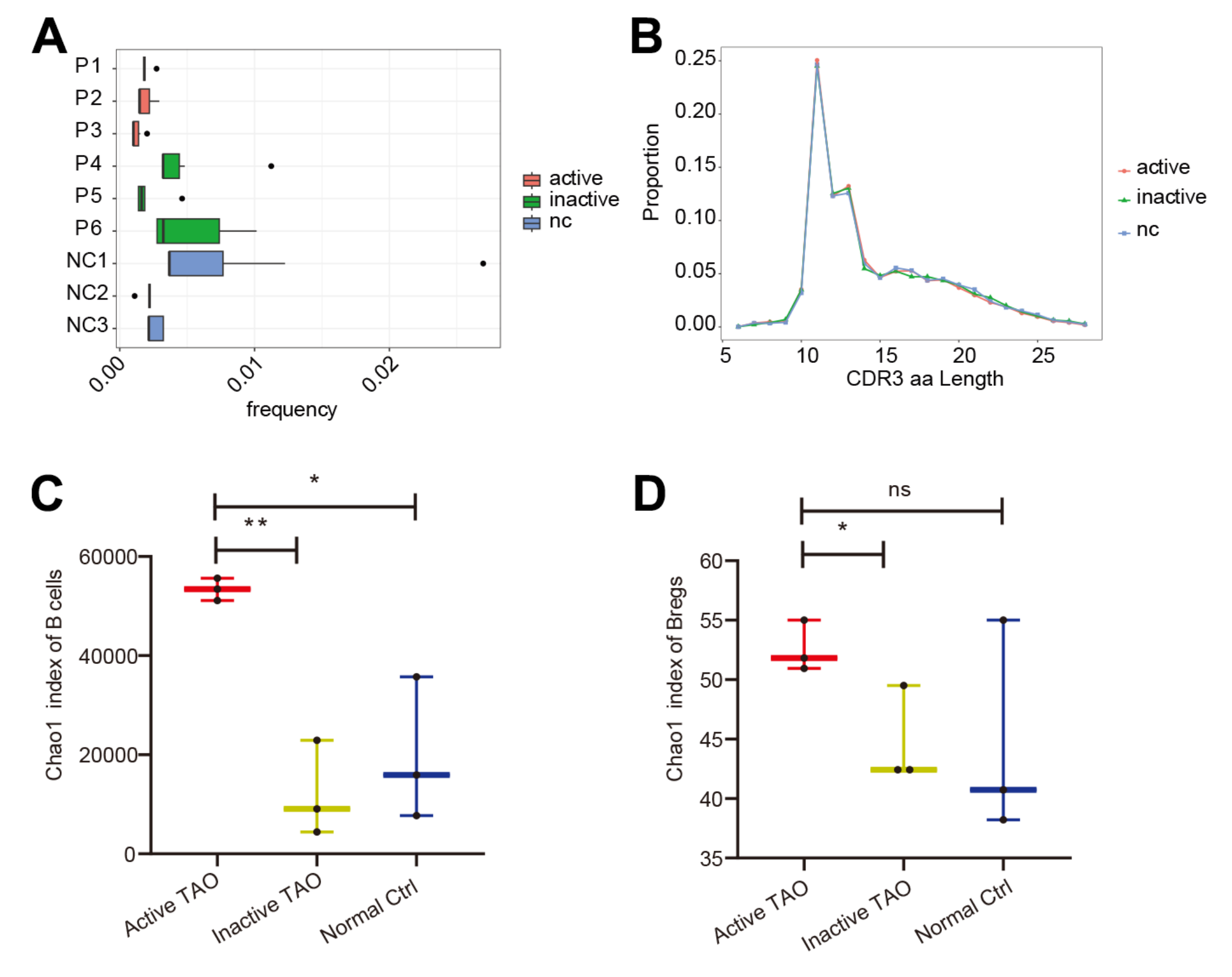
随后检查了疾病不同阶段每个样本中的B细胞组成。虽然三组的Bregs相对比例没有显着差异,但与非活动TAO组和正常对照组相比,活动TAO中的Bregs比例较低(p=0.078和p=0.065)(图2D)。尽管观察到的差异未达到统计显着性,但这一结果表明了数据的潜在趋势。为了验证这些结果,该研究进行了流式细胞术分析,并使用CD19+IL-10+作为识别Bregs细胞群的标记。IL-10由于其抑制促炎症反应的能力而被广泛认为是Breg的标志。该分析证实,与非活动TAO和NC组相比,活动TAO中的Breg频率降低(图2E)。
进行轨迹分析以阐明不同B细胞亚群之间的动态关系。分析发现了3个分支点和5 个不同的状态。状态1的特征是边缘区B细胞和FCRL3高GC B细胞同时分布。状态 2由一小部分滤泡B细胞组成。状态3主要由滤泡B细胞组成。状态4和状态5主要由 Breg组成。此外,所有状态都表现出弥散的多淋巴细胞祖细胞(图2F)。与之前的发现一致,该研究观察到活性TAO中处于状态4和状态5的Bregs细胞密度降低。根据SCENIC分析,发现一组受不同转录因子调控的独特基因在Bregs中特异性表达,而在其他细胞类型中几乎不存在(图2G)。在Bregs中,受RORA、CEBPD、PRDM1、FOSL2和EOMES调控的基因显示出明显更高的表达水平。
GO富集分析显示,Bregs表现出与免疫调节(AIF1、CSK、HLA-DRB5、CYBA)、细胞周期进程、信号转导和细胞凋亡相关的上调基因(ARPC1B、CORO1A、YWHAB),(RHOA,CLIC1,S100A6,NME2)(图2H,2I)。值得注意的是,在活跃的TAO中,Bregs上调的基因在炎症相关的GO术语和细胞过程相关的GO术语中丰富。这些发现强烈表明Bregs可能在TAO过程中调节炎症和免疫反应中发挥关键作用。根据CellPhoneDB分析,Bregs表现出与骨髓细胞的高频率通信(图2J)。这一发现表明Breg和骨髓细胞可能在TAO期间参与协调的免疫调节过程。
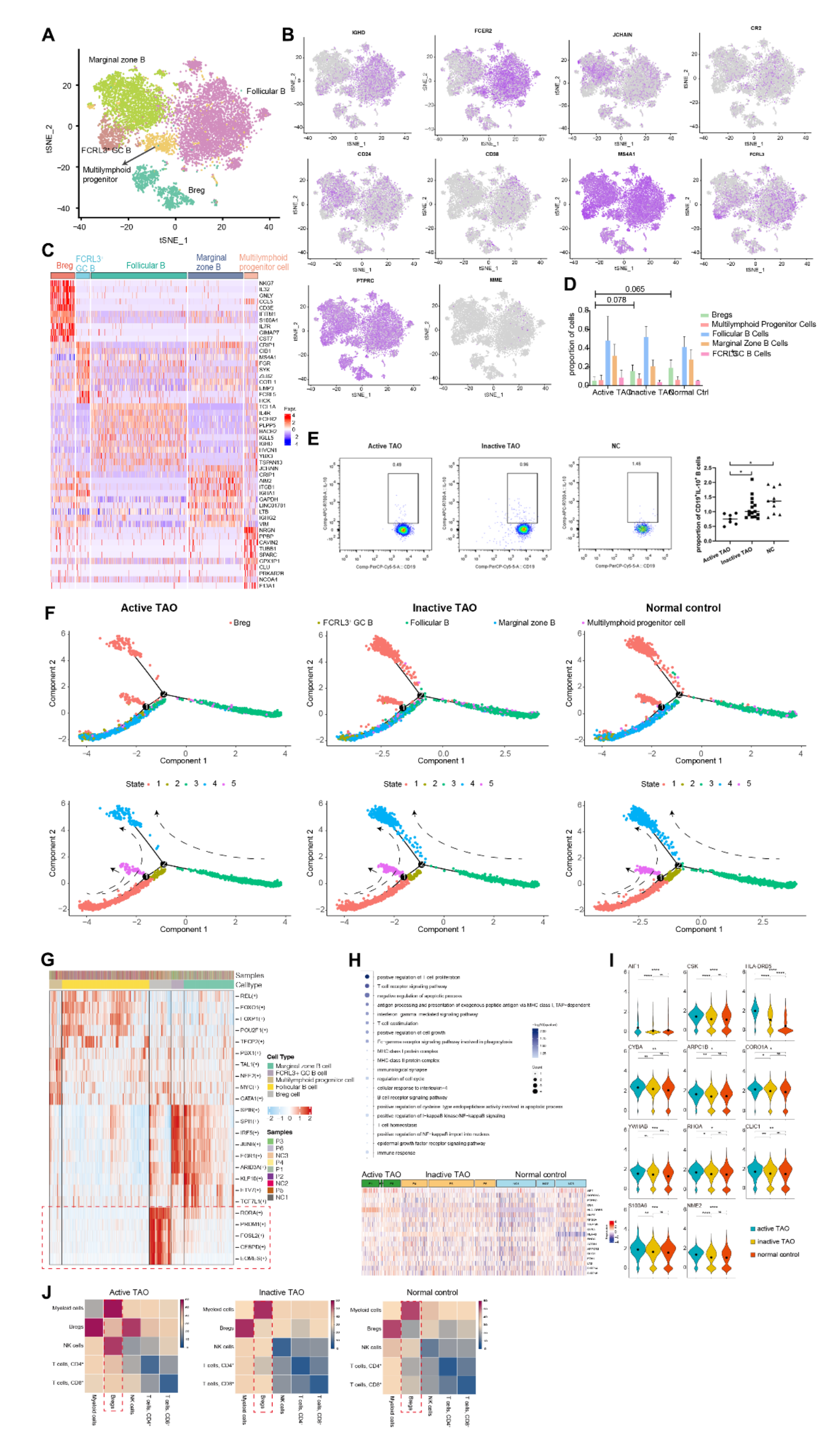
图2-调节性B细胞参与TAO期间的免疫调节
3.scBCR-seq分析发现活性TAO中BCR多样性显着增加
为了全面分析B细胞群中的基因表达和BCR多样性,该研究对scRNA-seq分析中使用的PBMC样本进行了scBCR-seq。在活性TAO中,前10个克隆型的比例(0.17%)与非活性组(0.37%,p=0.010)和NC组(0.41%,p=9.31E-05)(图3A)。然而,对互补决定区3 (CDR3) 长度的分析没有显示任何明显的变化(图3B)。当检查CDR3的多样性时,通过Chao1指数量化,与NC组 (p=0.016) 和非活动TAO组 (p=0.002) (图3C)。Breg细胞中也出现了类似的趋势(图 3D),与NC组相比显着增加(p=0.011),但活性TAO之间没有统计学显着差异组和NC组 (p=0.213)。这些发现表明,虽然活性TAO中前10个克隆型的频率降低,但在这种情况下CDR3序列的多样性增加,这可能对免疫反应的调节有影响,并有助于活性TAO的发病机制。
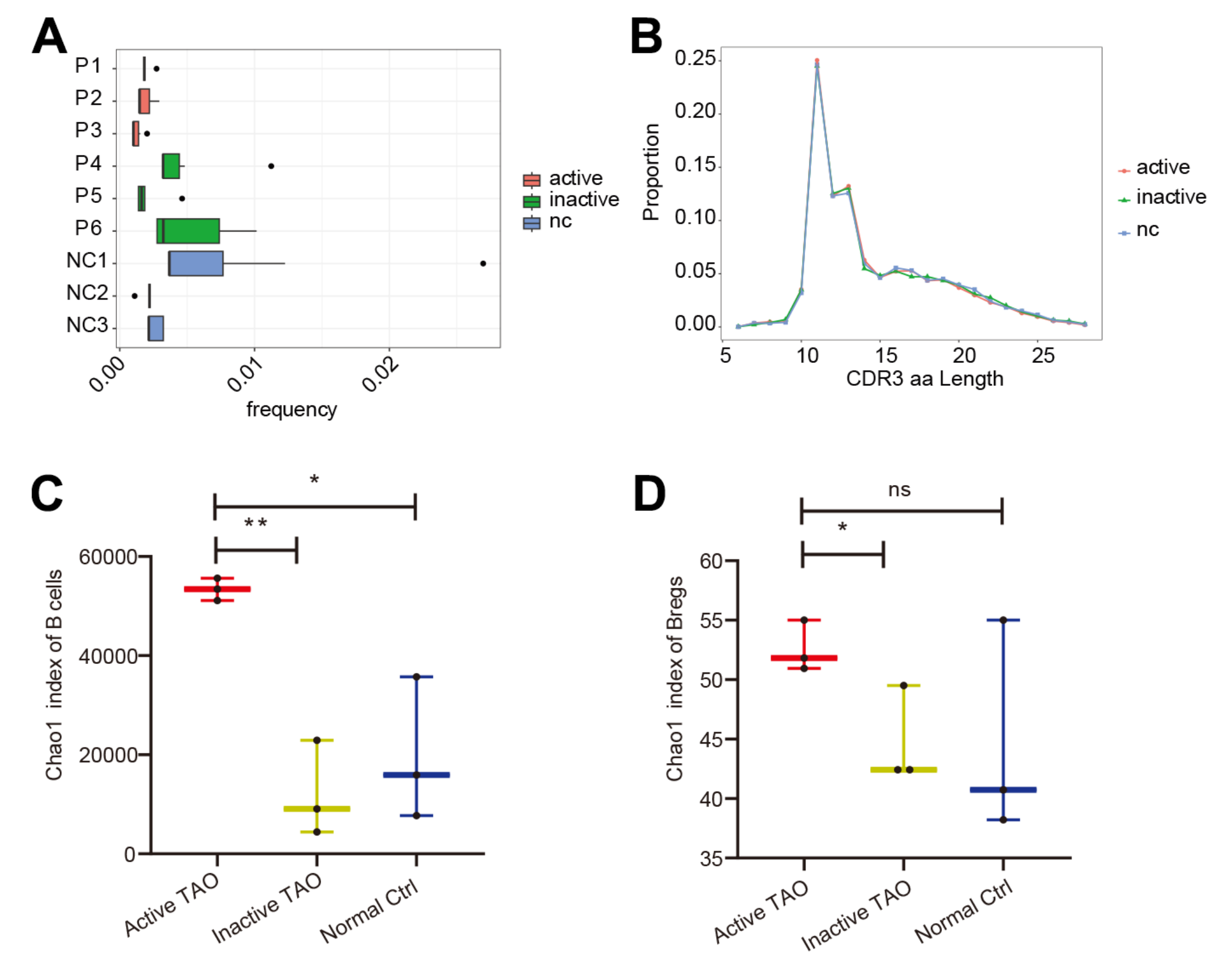
图3-scBCR-seq分析发现活性TAO中BCR多样性显着增加
4.活性TAO中骨髓细胞结构的改变
为了评估骨髓细胞在TAO中的参与情况,该研究鉴定了骨髓细胞的主要亚型,并检查了它们在活性TAO中的配置。分析显示了五种不同的骨髓细胞群,即单核细胞、巨核细胞、树突状细胞 (DC)、单核细胞衍生的DC和红细胞(图4A )。这些细胞类型的鉴定基于差异基因表达和对已建立的谱系标记的检查(图4B)。活性TAO 和非活性TAO之间的比较揭示了单核细胞和DC比例的显着差异。与非活动TAO组相比,活动TAO患者的单核细胞比例显着较高 (p=0.006),而活动TAO中DC的比例显着较低 (p= 0.003) (图4C)。这些发现表明,单核细胞水平增加和DC数量减少可能是TAO患者活动性疾病状态的特征。
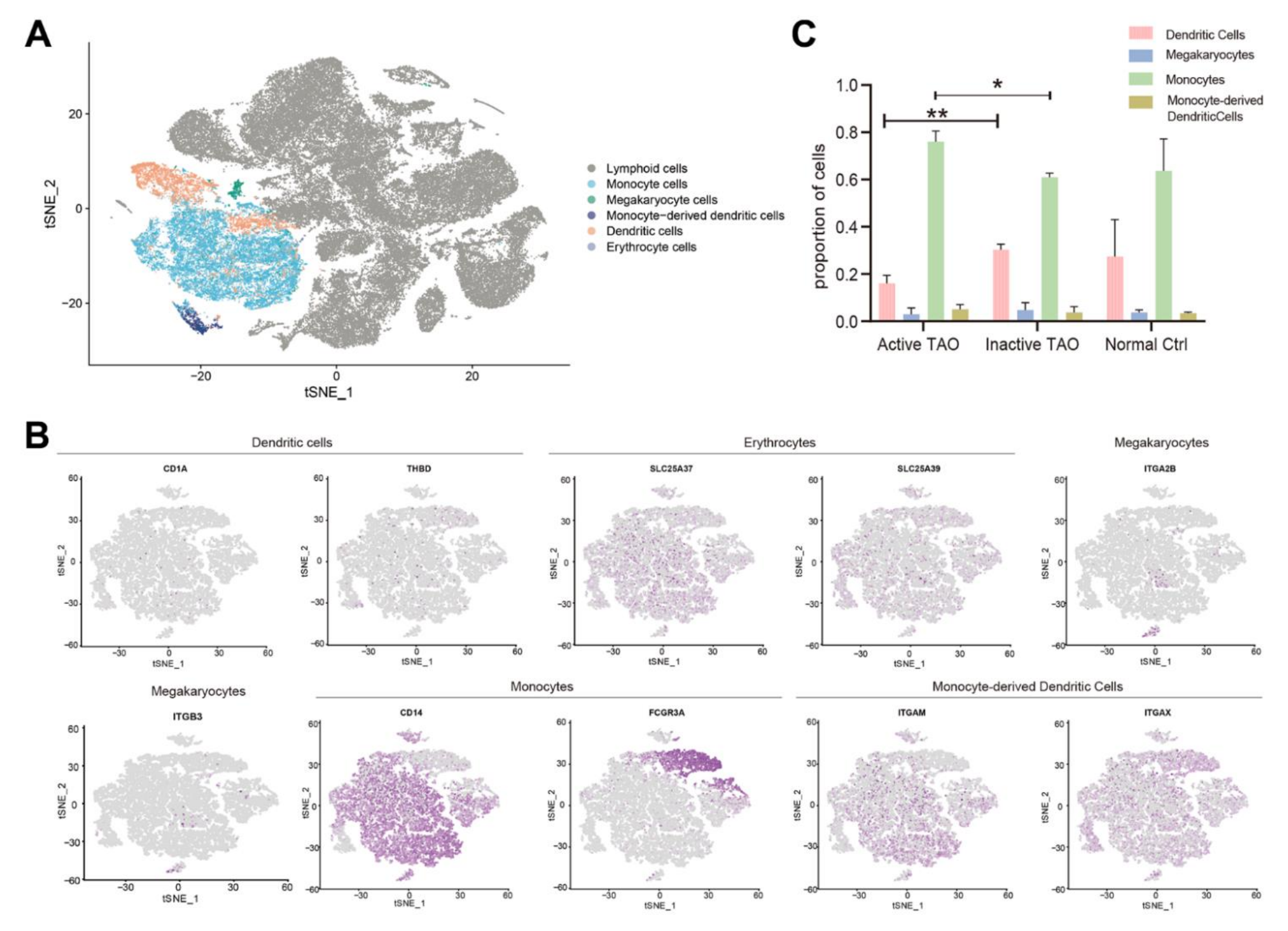
图4-活性TAO中骨髓细胞结构的改变
5.DCs可能参与TAO活跃期间的炎症过程
DC被细分为三个不同的子簇。Cluster 0被指定为cDC1s,其特征是高表达CDKN1C、FCGR3A、SMIM25、IFITM3、LST1和MS4A7,以及CD1C和 CD141的低表达。簇1和簇2被鉴定为cDC2,其炎症基因的表达水平升高,例如 CD14、S100A8、GNLY、NKG7 、IL32和S100A12(图5A、5B)。cDC1s的比例在活性TAO中显着较高,而cDC2s在非活性TAO和NC中更为普遍(图 5C)。鉴于cDC1和cDC2在免疫调节中发挥不同的作用- cDC1专门诱导Th2反应,而cDC2亚群表现出更强大的诱导Th1反应的能力[42],该研究进一步检查了它们的基因表达谱。
关于cDC1,与MHC II抗原呈递(HLA-DRB5、IFI30)、免疫激活(NAPSB)以及发育和神经遗传相关的基因与NC相比,疾病 (NBPF14) 在活性TAO中高度表达(图5D、5E)。对于cDC2,与NC相比,在活性TAO中观察到更高水平的 HLA-DRB5和FCN1(图5D,5E)。富集分析表明,对于两种DC,活性TAO中上调的基因主要与炎症、免疫激活途径和补体激活途径相关的各种过程相关(图 5F)。这些结果表明,在活跃的TAO中,DC的活化可能受到损害,并且在此活跃阶段观察到的炎症可能与这些细胞密切相关。
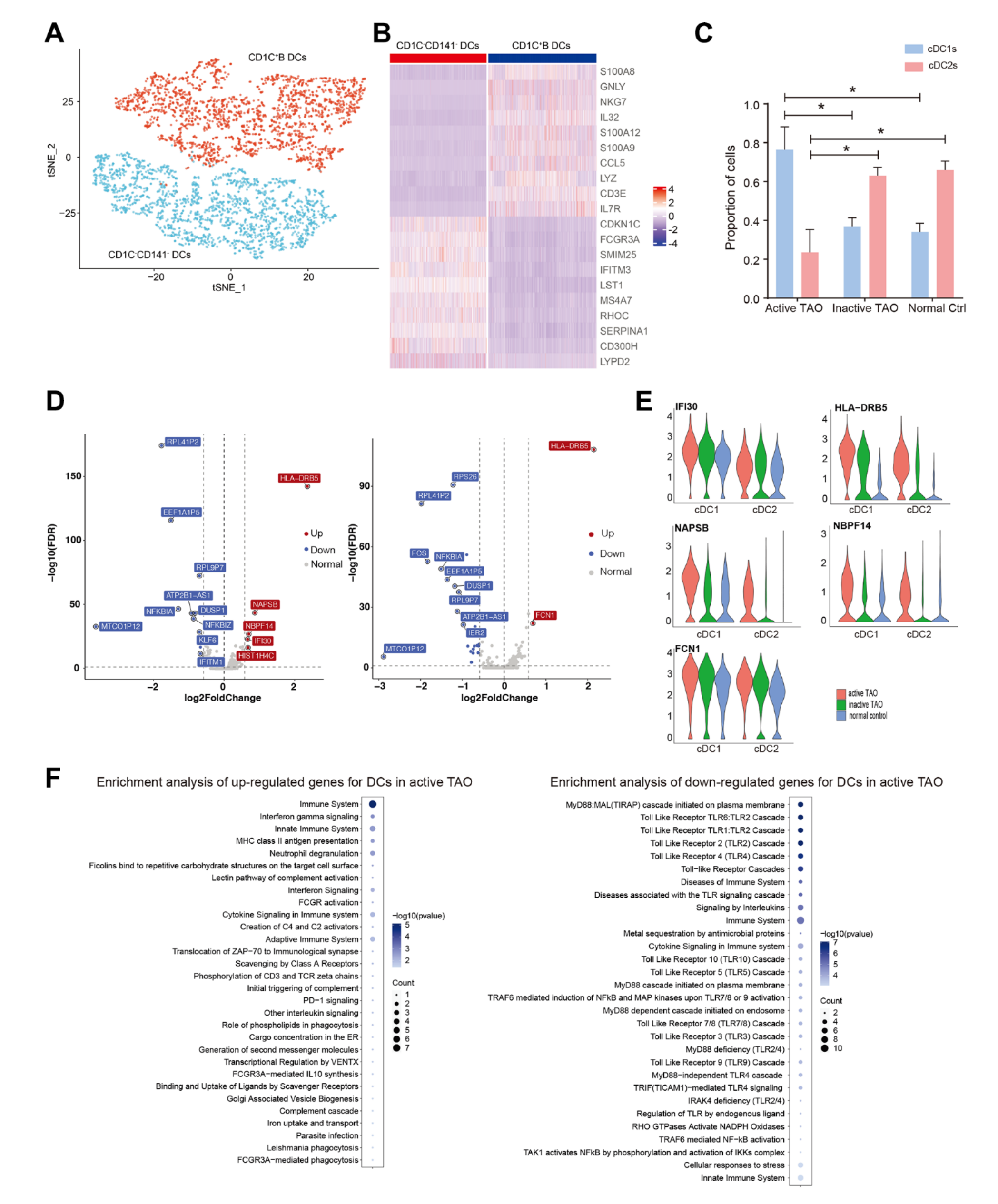
图5-DCs可能参与TAO活跃期间的炎症过程
6.单核细胞通过调节炎症细胞因子的产生在活性TAO中发挥作用
作者的聚类分析成功地从总共 12,959 个单核细胞中识别出三个不同的亚群。第一个簇的特征是经典单核细胞 (CMO),其表现出高表达水平的CD14、S100A8 和 S100A9。第二个簇被鉴定为非经典单核细胞 (NMO),其特征是高表达FCGR3A(也称为 CD16)。第三簇被识别为中间单核细胞 (IMO),CD14和FCGR3A均高表达(图6A、6B)。为了验证这些单核细胞亚簇,进行了流式细胞术分析,确认 CMO为CD14++CD16-,NMO为CD14+CD16++,IMO为CD14++CD16+(图6C)。轨迹推断分析表明,单核细胞遵循从CMO开始并向NMO和IMO状态分支的发育轨迹(图6B)。这些对TAO期间单核细胞发育状态变化的观察表明它们在该疾病中的潜在作用。
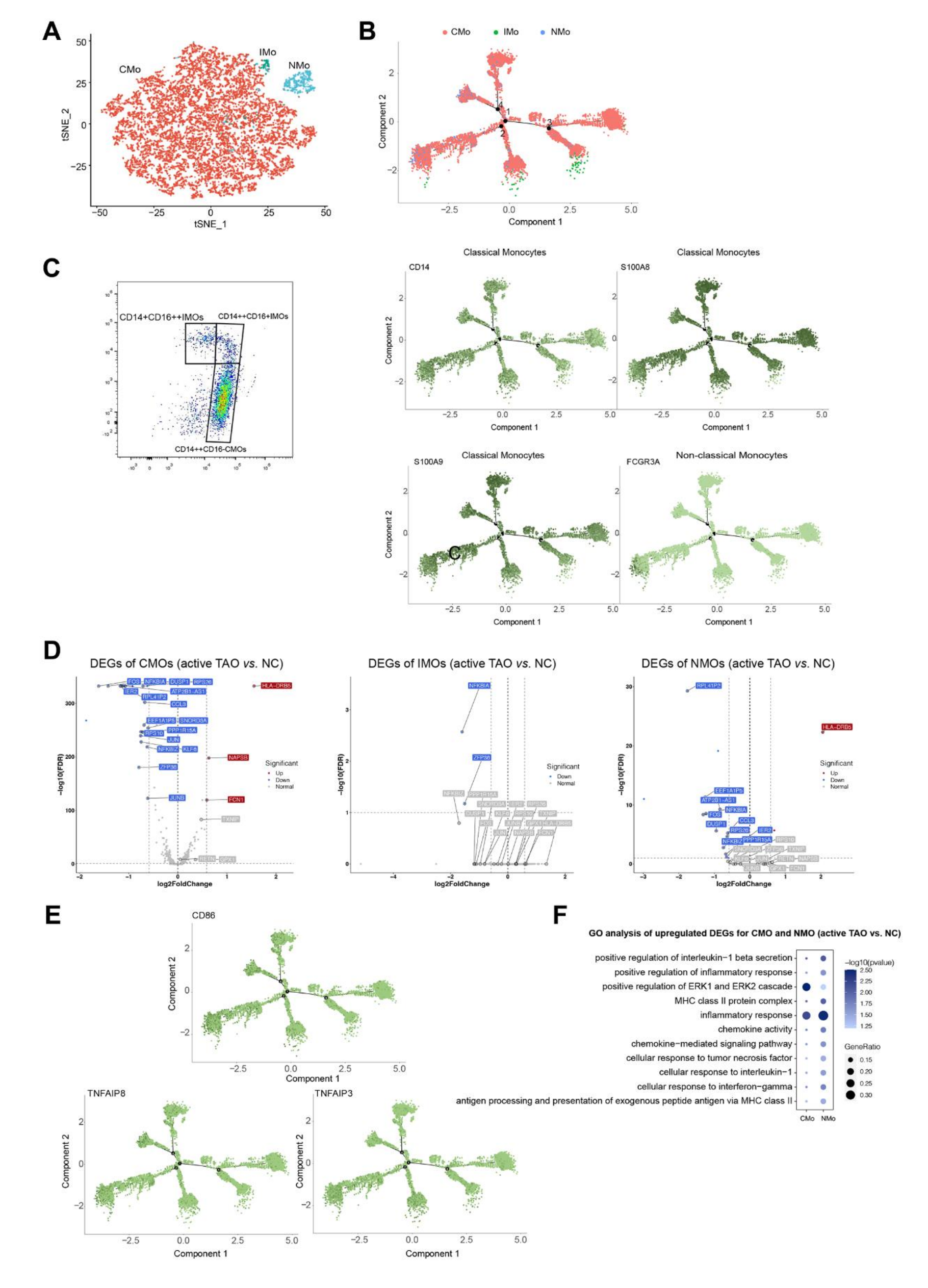
图6-单核细胞通过调节炎症细胞因子的产生在活性TAO中发挥作用
7.TAO中Breg细胞和骨髓细胞之间的串扰
进一步检查了活跃TAO背景下Breg、DC和单核细胞之间的细胞相互作用。该分析总共确定了1,352对重要的相互作用。值得注意的是,Bregs被发现表现出最多数量的配体,而cDC1亚簇则表现出最多数量的受体。值得注意的是,与非活性TAO 和正常对照组(NC)相比,Bregs在活性TAO中显示出配体数量增加(图7A)。
该研究对与炎症和免疫激活相关的相应受体和配体的表达模式进行了详细分析。与非活动性TAO组和正常对照(NC)组相比,活动性TAO患者中Breg与cDC1、cDC2、IMO、NMO或CMO之间的CD22-PTPRC相互作用明显更强(图7B)。此外,该研究观察到活性TAO中存在强大的抑制相互作用,例如Bregs和cDC1、cDC2或IMO之间的BTLA-TNFRSF14。这一发现表明,在TAO活跃的情况下,Bregs可能发挥更大的免疫抑制作用(图7B)。
通过检查在免疫抑制和炎症过程中具有潜在作用的基因的表达水平,研究发现活跃 TAO期间Breg中的CD22、PTPRC、BTLA和TNFRSF14增高。此外,与非活性TAO和正常对照(NC)组相比,活性TAO中的Breg、DC和单核细胞中BTLA和 TNFRSF14的表达水平总体增加(图 7C)。这些发现表明,在活跃的TAO过程中,Breg、DC和单核细胞之间存在复杂的调节相互作用,这可能有助于在疾病中观察到的炎症和免疫反应。
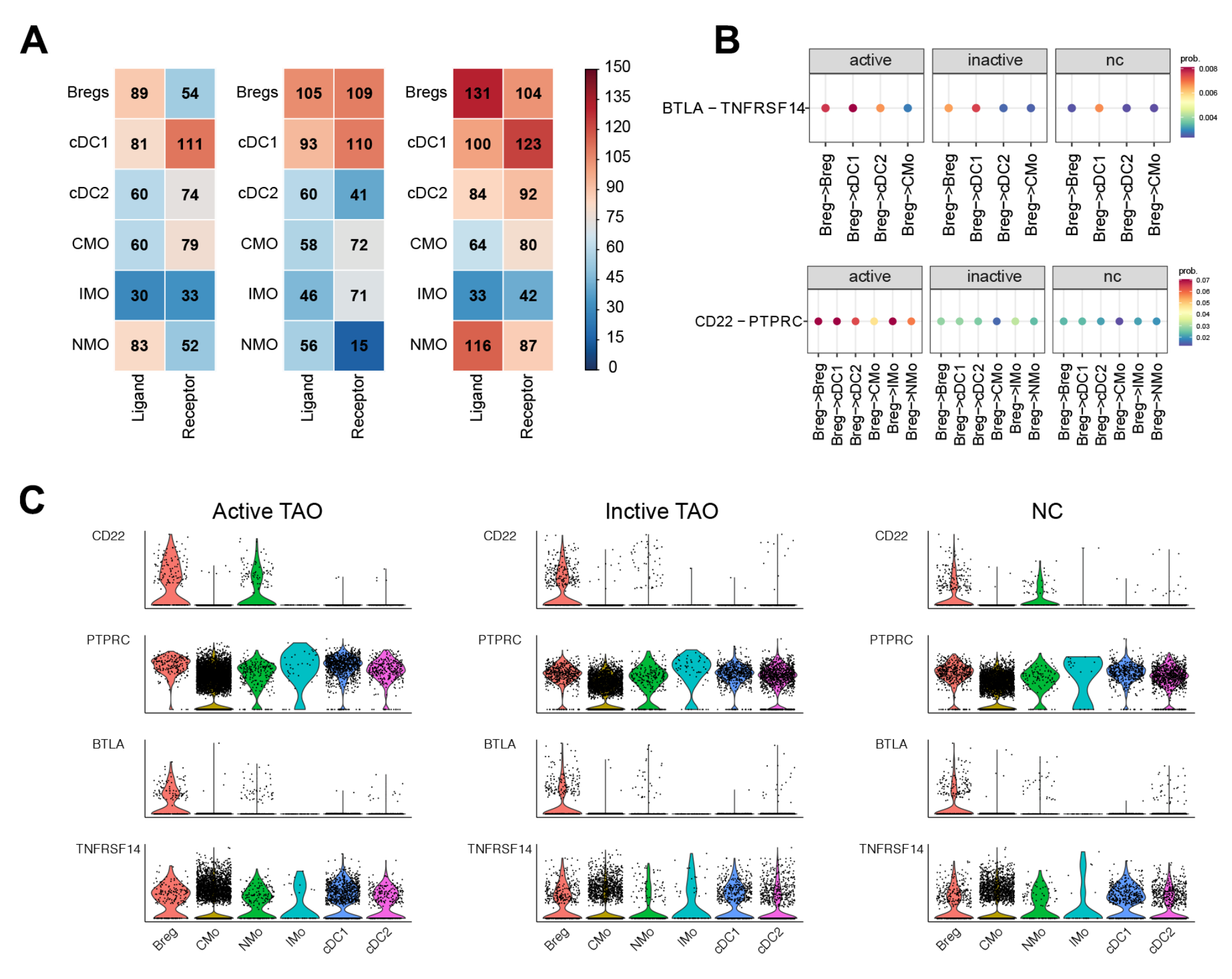
图7-TAO中Breg细胞和骨髓细胞之间的串扰
研究总结
该研究强调了具有活性TAO、非活性TAO和NC的个体中B细胞、DC和单核细胞的比例和转录异质性的显着变化。这些发现为了解活跃TAO期间外周免疫环境中免疫细胞浸润的变化提供了宝贵的见解。
值得注意的是,该研究发现了两个配体-受体对CD22-PTPRC和BTLA-TNFRSF14的潜在抑制作用,这可能有助于减少Bregs 并削弱活性TAO中炎症的抑制作用。这些潜在的致病细胞和分子可能是TAO炎症变化的原因,因此可能被确定为该疾病的新治疗靶点。
此外,该研究描述了TAO中BCR库的免疫特征,揭示了活跃TAO期间BCR多样性的显着增加。该研究揭示了活性TAO中观察到的炎症反应的分子和细胞基础。通过更好地了解这种情况下的免疫失调,该研究为未来开发更有效的免疫治疗策略奠定了基础。随着对潜在机制的进一步验证和探索,这些发现有可能为TAO患者的靶向和个性化治疗做出重大贡献。







 京公网安备 11011302003368号
京公网安备 11011302003368号