外显子是基因组中能够转录组出成熟RNA的部分,外显子组(exome)是基因组中所有外显子的集合。人类拥有约18万个外显子,约占人类基因组的1%,即约3000万个bp(30MB)。全外显子组测序是指通过探针捕获基因组中外显子区域的DNA序列,并进行集中测序分析,从而找到致病变异或锁定与疾病相关的基因,对于遗传性疾病及肿瘤等病变病理成因确认以及治疗靶点锁定有重要作用。
沈阳医学院高兵教授团队在 Redox Biology 杂志发表题为“ Meta-data analysis of kidney stone disease highlights ATP1A1 involvement in renal crystal formation ” 的研究论文,结合全外显子测序与转录组等组学数据分析,解释ATP1A1在肾晶体形成中起到的重要作用,表明ATP1A1可能是治疗钙结石的潜在治疗靶点。ong>

英文标题:Meta-data analysis of kidney stone disease highlights ATP1A1 involvement in renal crystal formation
中文标题:肾结石病的Meta数据分析揭示ATP1A1参与肾晶体形成
发表期刊:Redox Biology
合作单位:沈阳医学院
影响因子:10.7
研究对象:CaOx肾结石患者及对照组样本
研究方法:全外显子测序(WES)+表达谱数据分析
百迈客生物为该研究提供了外显子测序服务。
研究背景
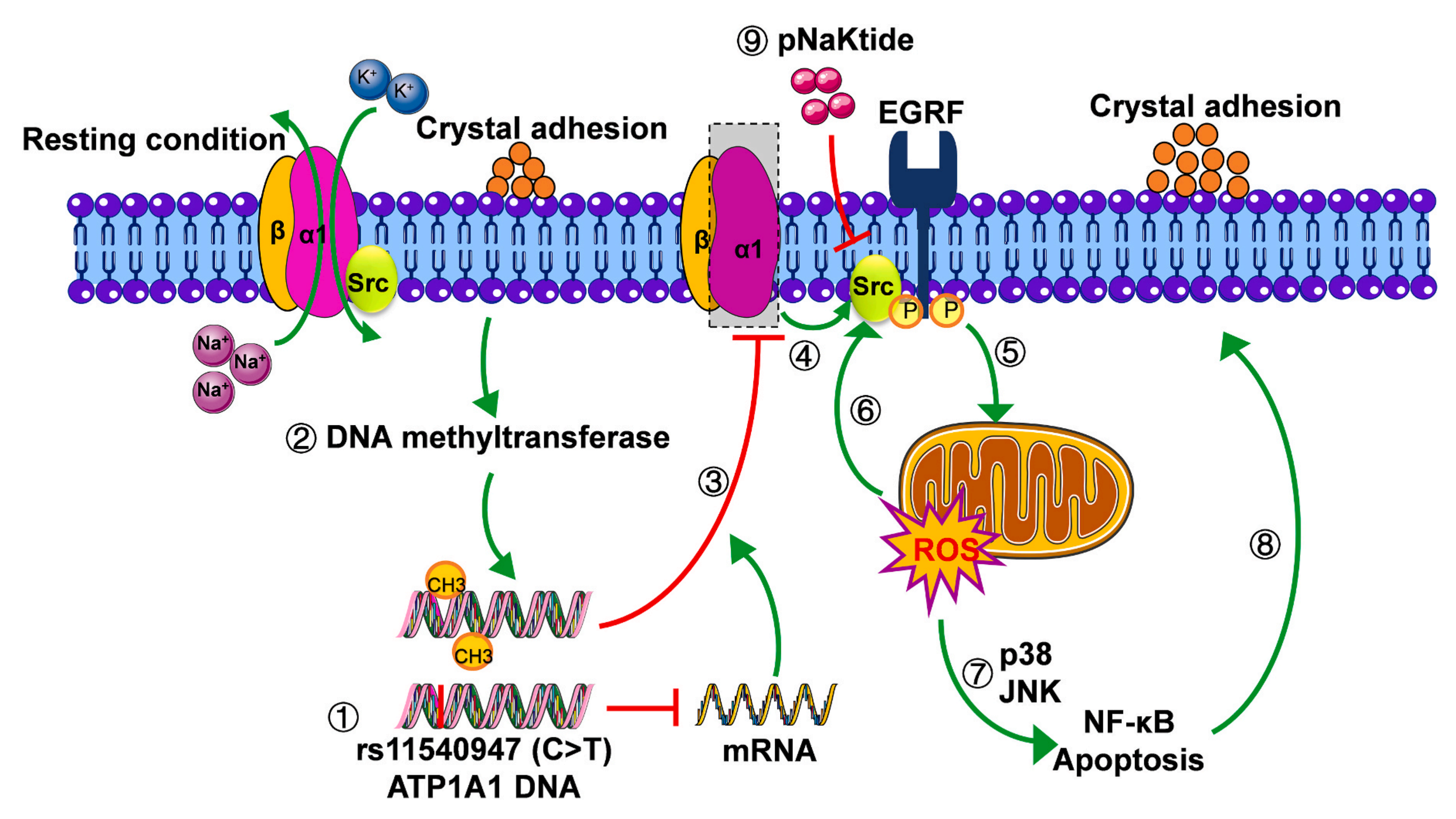
肾结石在全球范围内都威胁着人类的生命健康,近年来发病率和复发率都不断上升,大多数肾结石由草酸钙(Calcium ox)结石组成,晶体-细胞粘附被认为是晶体保留和结石形成中的关键步骤,有研究报道,受损的肾小管上皮细胞对晶体附着的亲和力增加,而晶体沉积通过产生过多的活性氧(ROS)反过来又诱导细胞损伤和炎症反应。Na/K-ATPase(NKA)是一种在肾脏中高度表达的跨膜离子泵,同时其由ATP1A1编码的α1亚基也起到信号转导器的作用,当 ATP1A1 构象改变或被敲低时,Src 就会被磷酸化并激活下游信号级联,进而导致 ROS 的产生,ROS可以激活MAPK级联反应和NF-κB炎症反应,并作为ATP1A1的配体启动ATP1A1/Src信号通路,从而形成NKA/ROS扩增环,诱导氧化应激,然而,ATP1A1在肾结石形成中的作用尚不清楚。本实验结合多组学分析方法,以期提供一种有用的方法,研究肾结石形成病理。
材料方法
实验材料:28例中国汉族CaOx肾结石患者及对照组样本
组学方法:全外显子测序(WES)+表达谱数据分析
研究结果
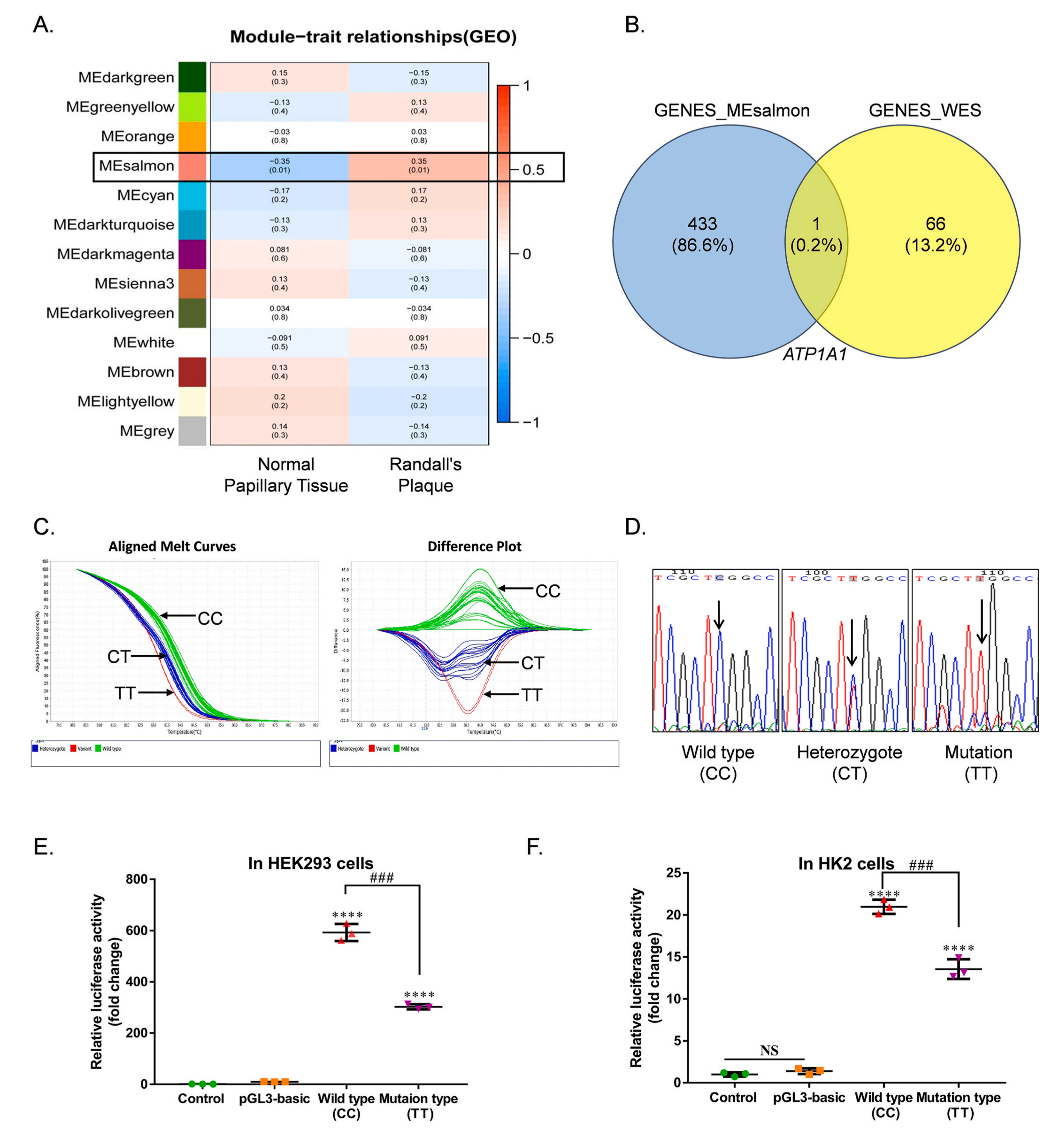
首先该研究从GEO数据中获取了肾脏钙结石患者的表达谱数据化,其中患者的RP组织(Randall斑块)命名为P组,患者的正常组织命名为N组,对其表达谱筛选基因进行WGCNA分析,选择与样本相关性较高的浅橙色模块(434个基因)进行后续研究,GO富集结果表明这些基因在质膜和跨膜转运中富集。KEGG富集分析显示,这些基因参与“醛固酮调节的钠重吸收”、“矿物质吸收”、“内分泌等因子调节的钙重吸收”和“近端小管碳酸氢盐回收”等通路,进一步查看发现,FXYD2、FXYD4、ATP1A4、ATP1A1和ATP1B1等5个编码NKA的基因参与了跨膜转运、吸收和重吸收的过程,表明NKA可能与肾结石密切相关。
为进一步探究肾结石相关关键基因,该研究对28例中国汉族CaOx结石患者进行了WES分析,共鉴定得到76个SNPs,其中错义SNPs31个,编码同义SNPs30个,3′UTR7个SNPs,5′UTR区8个SNPs,作为候选SNPs,这些突变位点定位于67个基因,将这67个基因与WGCNA分析中的434个基因做韦恩图取交集,发现ATP1A1是两个数据集交叉点中的唯一基因,一定程度上说明了ATP1A1在钙结石形成中的潜在作用。
接下来,该研究从WES数据中提取了ATP1A1的SNP,rs11540947 T等位基因在患者组中的突变频率频率为16.1%,而对照组仅为2.4%。为进一步证实rs11540947与钙结石形成的相关性,收集214例钙结石患者和232例匹配对照,通过HRM分析检测rs11540947的基因型,结果显示,CT+TT携带者在患者中比对照组更常见,且在男性中与钙结石有关,但在女性中无显著相关性,SNPrs11540947 (NM_000701:c.-78C > T)位于 ATP1A1 的 5′UTR 中;在ATP1A1的5′UTR中发现了Sp1结合位点和潜在的TATA盒,表明5′UTR具有启动子活性,双荧光素酶报告基因结果也证明了这一点,rs11540947的T等位基因介导了ATP1A1启动子活性的显着降低,这可能会降低ATP1A1在转录水平的表达。对草酸钙一水合物(COM)暴露处理的HK2细胞(人肾近曲小管上皮细胞)进行指标测定,结果显示处理3h后,NKA酶活性和ATP1A1 mRNA水平显著下降,6h后ATP1A1的蛋白水平升高,随后降低,同时COM 暴露后细胞内 ROS 水平显着增加,这可能与ATP1A1/Src信号通路的激活有关,而ATP1A1的过表达抑制了COM诱导的Src、p38、JNK、p65和p50激活;WB结果也显示COM激活的半胱天冬酶3被ATP1A1的过表达以及ATP1A1/Src信号复合物的特异性拮抗剂pNaKtide显着抑制,从而阻断了细胞凋亡过程。
晶体与细胞的粘附是结石形成的关键过程,晶体沉积会损伤肾细胞,因此,作者研究了ATP1A1在晶体-细胞粘附中的作用。该研究观察到用 Ad-hATP1A1 感染和用 pNaKtide 处理后,Ca2+浓度与对照组相比显着降低,表明ATP1A1过表达和pNaKtide可以阻止晶体与细胞的粘附,从而保护细胞免受CaOx晶体诱导的损伤并减少肾结石的形成。DNA启动子中CpG岛的甲基化是基因沉默的常见机制,COM暴露后,DNA甲基转移酶(DNMTs)的mRNA和蛋白质水平均显著升高,而用DNA甲基化抑制剂5Aza-2dc预处理HK2细胞再进行COM暴露处理后,ATP1A1表达量下调;ATP1A1的蛋白水平也被逆转。这些结果表明,改变的DNA甲基化参与了COM诱导的ATP1A1降低。
为了证实ATP1A1对体内晶体形成的影响,该研究构建了CaOx肾病大鼠模型,用 pNaKtide 治疗后尿草酸盐排泄量显着减少,与体外研究结果类似,HYP+CaCl2处理降低了 ATP1A1 mRNA和蛋白质表达水平,激活了 Src、p38、JNK、p65 和 p50,降低 Nrf2 表达,而这些均被pNaKtide逆转,这些结果强调了ATP1A1和ATP1A1/Src信号通路在肾结石形成中的重要性。
研究总结
综上所述,该研究从遗传水平和环境因子影响的转录水平探究肾结石相关关键易感基因,将钙结石形成者Randall斑块(RP)组织的基因表达谱数据与CaOx患者的WES数据相结合,鉴定出ATP1A1这一关键基因,还研究了ATP1A1遗传变异与钙结石风险的关联,并进一步探讨了ATP1A1/Src/ROS信号在体外和体内肾结石形成中的作用,这项研究的发现揭示了ATP1A1基因变异及其表达降低参与肾晶体形成的机制,可能为CaOx结石提供潜在的治疗靶点。
参考文献:
Li Y, Lu X, Yu Z, Wang H, Gao B. Meta-data analysis of kidney stone disease highlights ATP1A1 involvement in renal crystal formation. Redox Biol. 2023 May;61:102648. doi: 10.1016/j.redox.2023.102648. Epub 2023 Feb 27. PMID:36871182.






 京公网安备 11011302003368号
京公网安备 11011302003368号