2022年9月,百迈客合作客户成都中医药大学丁维俊教授团队在《Lipids in Health and Disease》发表题为“Potential novel biomarkers in small intestine for obesity/obesity resistance revealed by multi-omics analysis”的研究论文后,又一篇研究成果“Electroacupuncture promoted intestinal defensins and rescued the dysbiotic cecal microbiota of high-fat diet-induced obese mice”发表在《Life Sciences》(IF:6.78),首次报道了在电针治疗肥胖症期间α防御素在肠道菌群与疾病之间关系中的关键作用。百迈客为该研究提供了ONT全长转录组和全长微生物多样性测序分析服务。

研究背景
肥胖作为一种不断增长的非传染性流行病,影响了超过20亿人。肠道微生物菌群失调已被证明是肥胖和肥胖相关疾病发生和进展的关键因素,包括高血压、II型糖尿病、血脂异常和非酒精性脂肪性肝病(NAFLD)。针灸已被广泛用于治疗肥胖症,研究报道,电针(EA)可以减轻肥胖小鼠的体重,挽救生态失调的肠道微生物群,还可以调节免疫力。然而,EAEA重塑肠道微生物群的潜在机制尚不清楚,如何通过肠道微生物菌群调节肠道先天免疫力对抗肥胖仍有待阐明。
材料方法
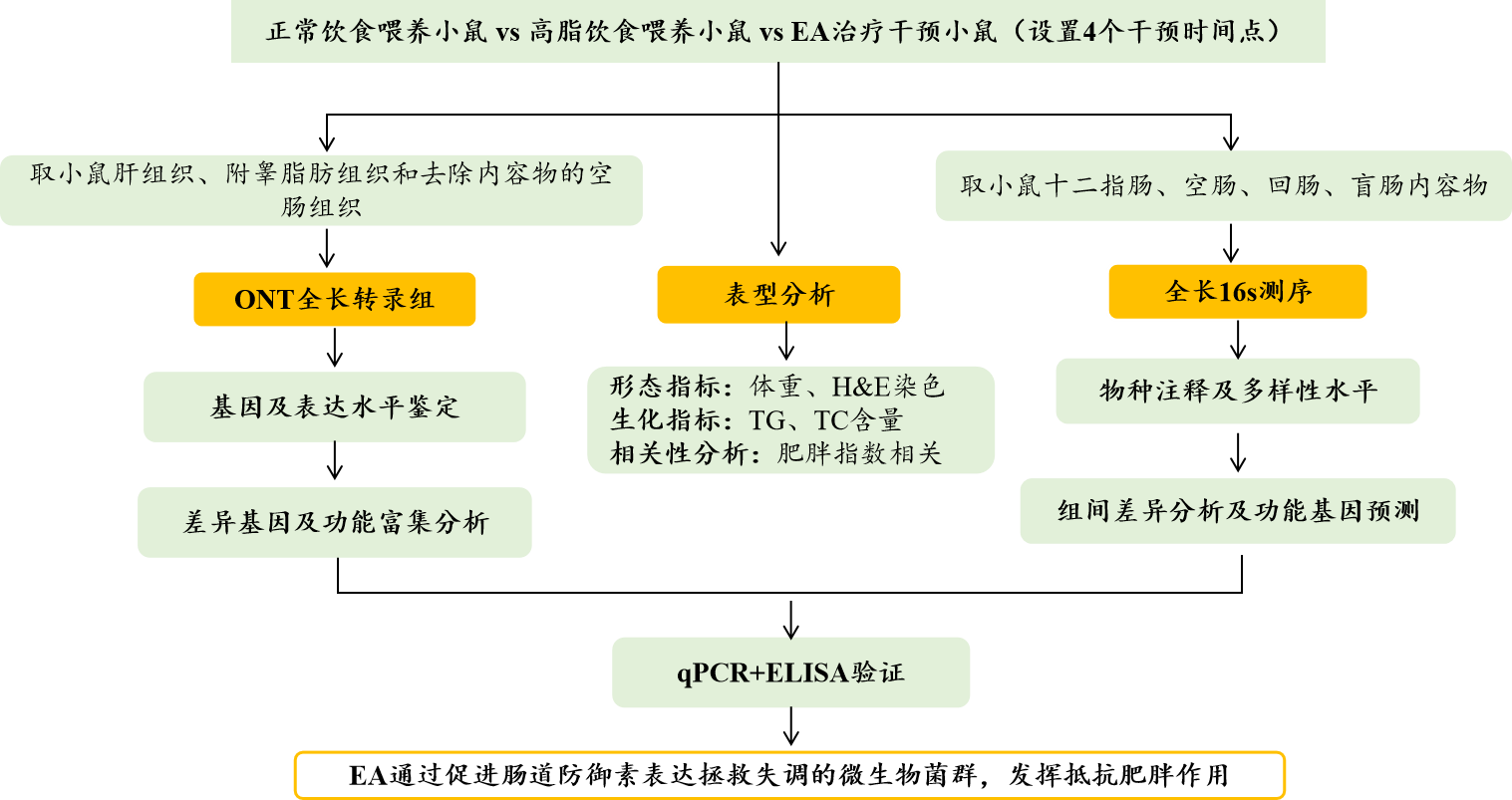
高脂饮食喂养小鼠,构建肥胖小鼠模型,正常饮食小鼠作为对照组,并设置EA干预组,根据干预时间分别设置四个时间点:EA03、EA07、EA14和EA21。
取小鼠十二指肠、空肠、回肠、盲肠内容物,进行全长16S测序;取小鼠肝组织、附睾脂肪组织和去除内容物的空肠组织,进行ONT全长转录组测序。
研究技术路线
研究结论
1.电针(EA)有效降低了持续喂食高脂肪饮食的肥胖小鼠的体重和脂肪堆积;
2.全长16S测序表明肥胖小鼠盲肠中的菌群失调,电针治疗后,肥胖小鼠盲肠菌群组成和功能显著恢复;
3.EA干预21天后,健康对照组的防御素α5(Defa5)表达恢复,而肥胖小鼠空肠中包括fabp1在内的脂肪消化吸收基因表达显著降低;
4. Defa5水平与毛螺菌科呈正相关,与肥胖指标呈负相关,EA还可以减少组织炎症,改善葡萄糖耐量异常,并抑制肠道脂质吸收的关键基因。
主要研究结果
1、肥胖导致微生物群失调,尤其是在盲肠中
α多样性分析结果显示,高脂饮食HFD组与正常对照组的十二指肠、空肠和回肠微生物多样性没有显著差异,但在盲肠中HFD组微生物多样性显著减少(图1F, 1G);β多样性分析结果显示,与其他肠道段相比,只有盲肠微生物菌群在HFD组与正常对照组表现出显著差异(图1H, 1I);此外,top 15的KEGG通路中有7个是基于微生物功能富集,高脂饮食组盲肠微生物的上调通路包括脂质代谢、碳水化合物代谢和聚糖生物合成和代谢,下调通路包括能量代谢相关途径(图1L)。
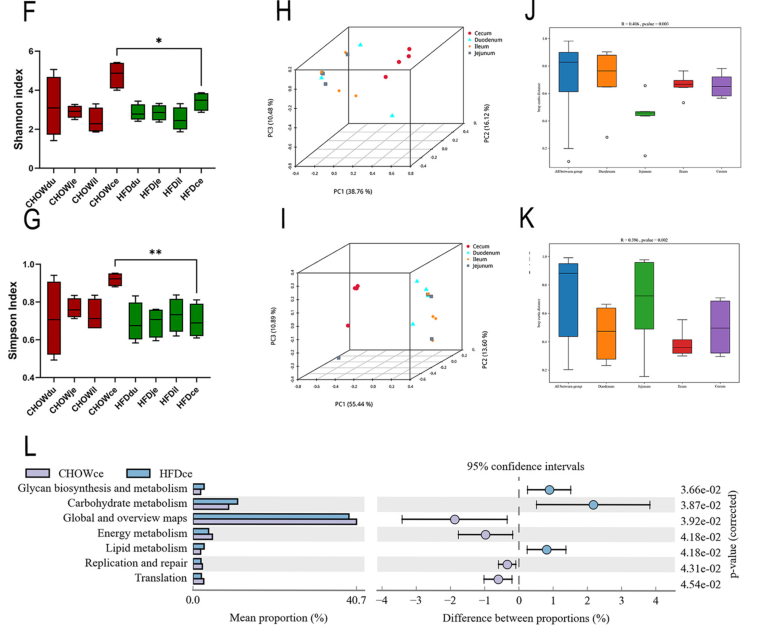
图1 高脂饮食诱导的肥胖小鼠肠道微生物菌群失调
2、EA调控空肠与先天免疫和脂质代谢相关的途径
相较于HFD组,EA组显示出显著地减肥效果(图2A),并减少了附睾、肾脏和腹股沟区域的脂肪堆积。空肠是肠道脂质消化和吸收的主要区域,HFD小鼠的空肠绒毛明显长于食物组(图2B, 2C)。HFD组和正常对照组间共鉴定出994个差异表达基因DEG(图2D-F),HFD组和EA组共鉴定出849个DEG(图2G);通过取两个比较组共有的DEG,作为EA直接调控肥胖的DEG,共检测到共有基因299个,其中上调的有165个,下调的有133个(图2H-J)。
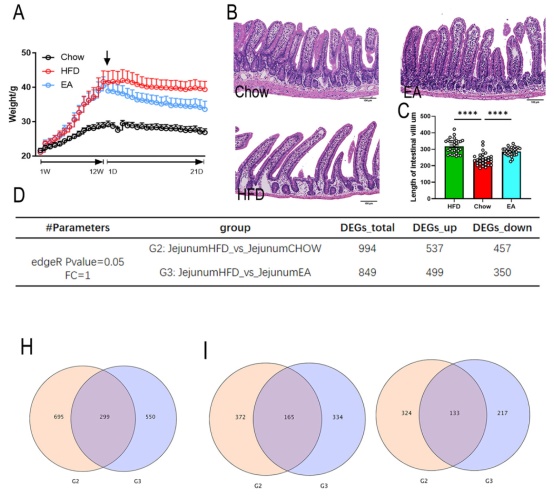
图2 EA处理全长转录组差异表达分析
对共有DEG进行功能富集分析,发现显著富集的通路主要与宿主先天防御和脂质代谢相关(图3A);在去除功能未鉴定的基因或lncRNA后,获得140个上调和92个下调的DEG也进行功能富集分析(图3B, 3C);然后,对top20通路的DEG进行PPI调控网络分析(图3 D, 3E),结果显示,EA主要上调的通路包括α防御素基因在内的NOD样受体信号通路(图3 D),下调的通路脂质代谢(包括脂质消化和吸收途径),以及免疫应答相关通路(谷胱甘肽s-转移酶和MHC II类相关基因)(图3E)。基因表达直方图显示EA干预恢复大量异常表达的DEG,与肠粘膜免疫相关的DEG,如α防御素基因,可以通过EA显著恢复(图3F);与免疫反应相关的H2-Ob和H2-OA仅在空肠区域下调(图3G, 3H);EA干预恢复了fabp1、pla2g2d和acat1的表达水平,主要负责脂肪消化和吸收(图3I);最后,EA干预通过下调apoc1、apoa2和apoc2以及上调npc1来调节胆固醇代谢(图3J-O)。
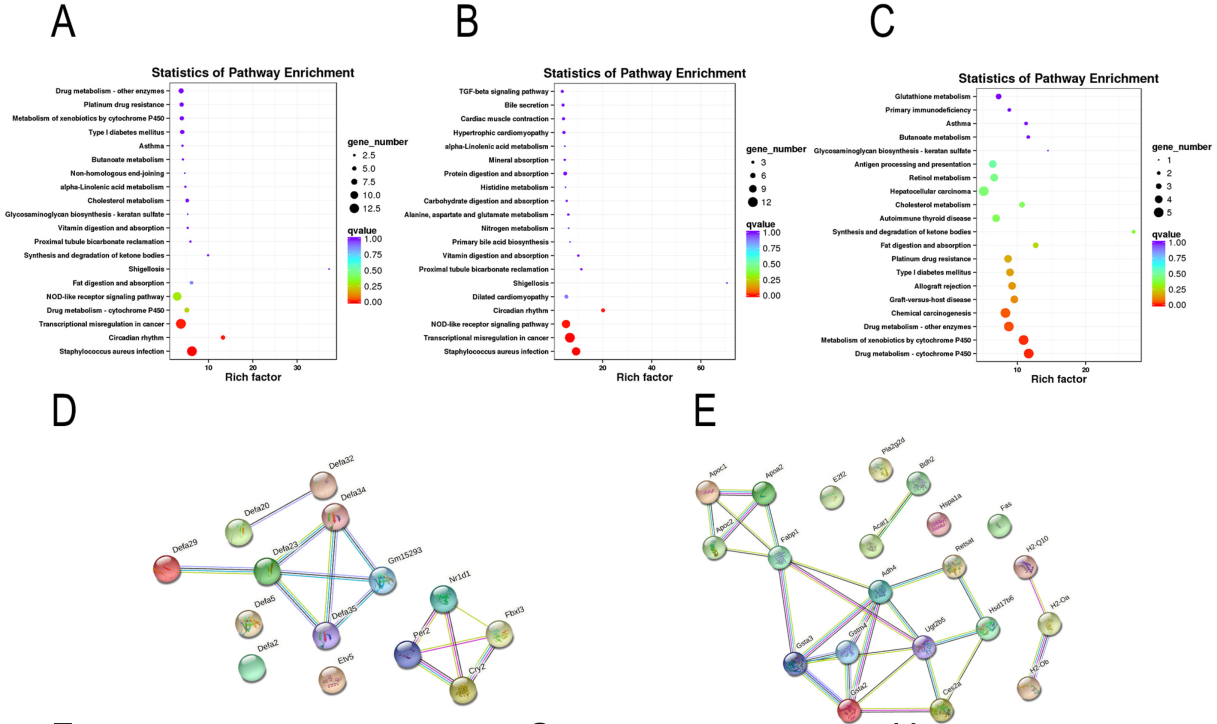

图3 EA干预调节空场防御素和脂质代谢相关基因表达
3、EA 恢复了空肠和盲肠中失调的微生物菌群
在EA干预21天后,HFD组中盲肠微生物组成被显著恢复(图4 A&B),α多样性(图4 C, 4D)和β多样性恢复(图4E-G);通过LEfSe分析鉴定了9种特征细菌(图4H);跟踪EA处理3、7、14和21 d相对丰度的时间序列变化,筛选到肥胖小鼠盲肠10个相关物种,其中8个上调,包括G. Ruminiclostridium和 A. muciniphila;Tax4Fun预测了EA和HFD组间具有显著差异的13种KEGG通路;并且,EA干预能有效地下调脂质代谢途径,上调能量代谢途径(图5)。
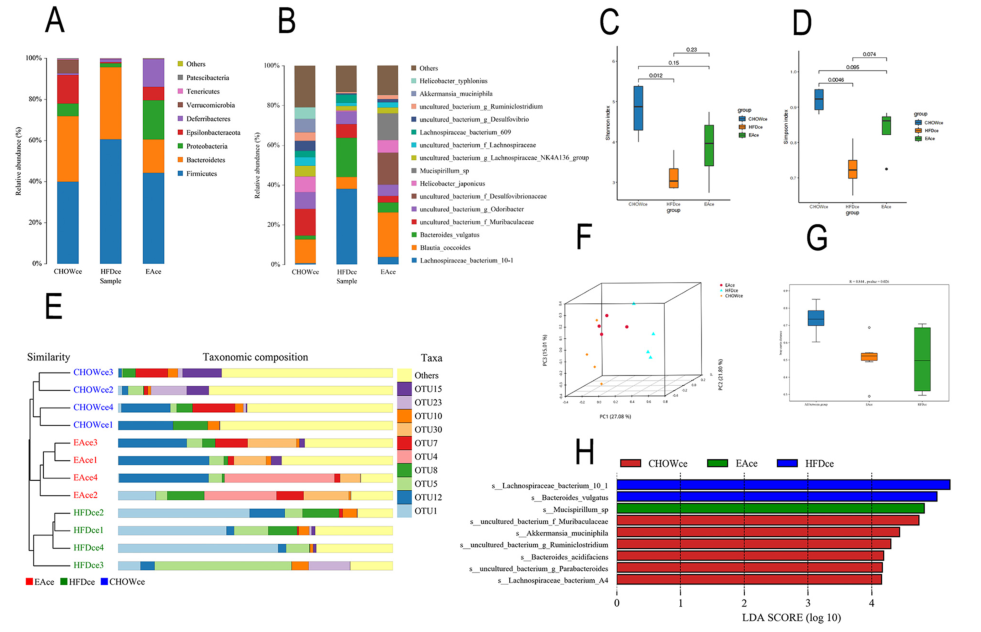
图4 EA干预恢复了HFD喂养小鼠的肠道微生物群
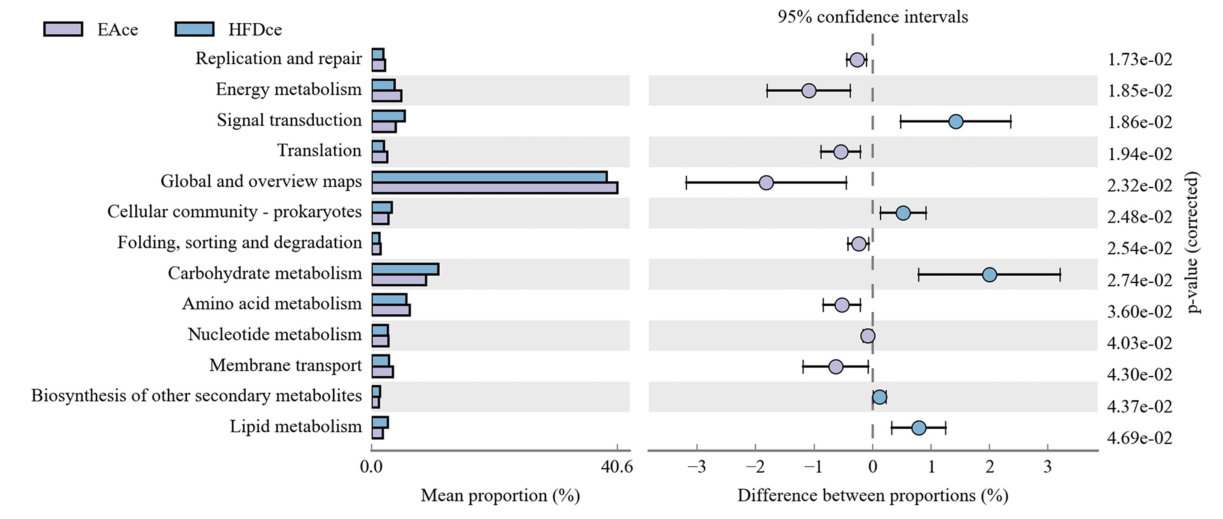
图5 HFD组和EA组功能基因组成的功能预测
4、EA促进防御素表达并抑制肥胖小鼠空肠脂质吸收
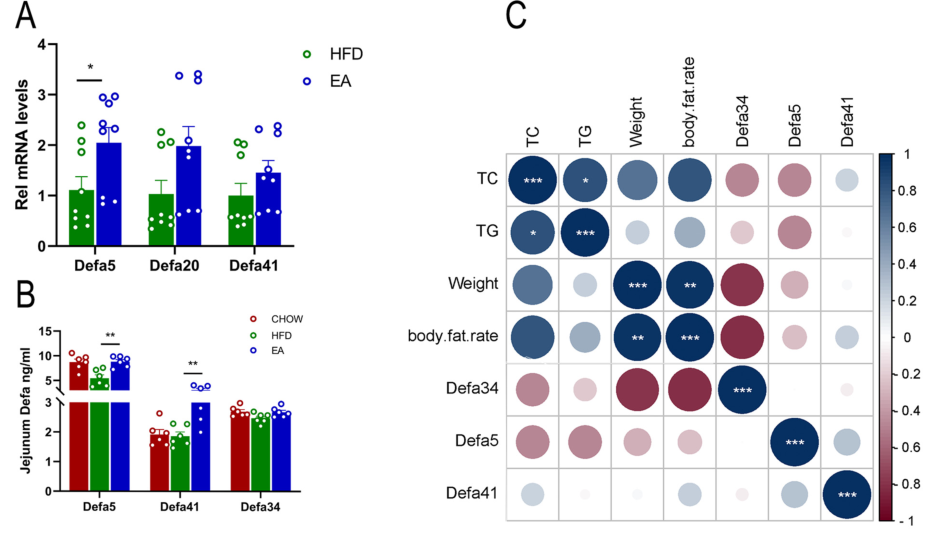
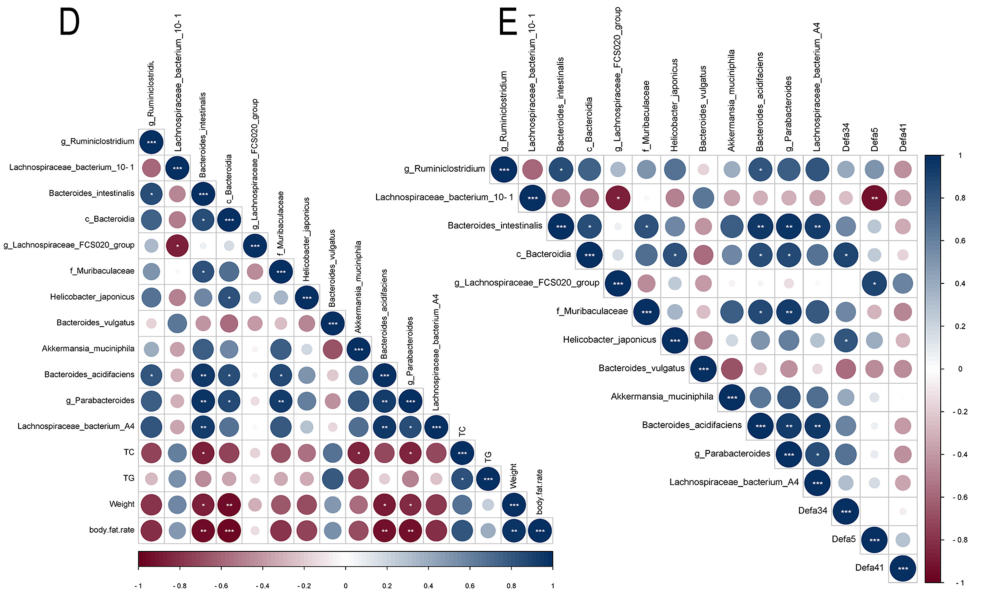
EA促进了肠粘膜免疫中3个代表性基因Defa5、Defa20和Defa41的表达,其中Defa5显著上调(图6A);EA还恢复了这些防御素的蛋白质水平,其中Defa5和Defa41显著增加(图6B)。斯皮尔曼相关系数分析结果显示,Defa5和Defa34的蛋白质水平与关键肥胖指数呈负相关,包括体重、体脂百分比以及甘油三酯TG、总胆固醇TC含量(图6C);,EA下调 Lachnospiraceae bacterium_10_1和 Bacteroides acidifaciens物种的相对丰度,与肥胖小鼠的关键肥胖指数呈正相关(图6D);EA调节的肠道防御素表达与几种肠道菌群相关(图6E)。以上结果表明,肠道防御素的调节是EA拯救肥胖小鼠肠道微生物群的关键机制之一。
研究小结
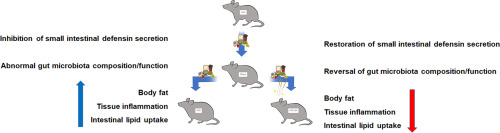
一句话总结:EA通过促进肠道防御素、拯救失调的盲肠微生物菌群,以协同模式减少脂质吸收来发挥抵抗肥胖作用。
参考文献
Xia X, Xie Y, Gong Y, et al. Electroacupuncture promoted intestinal defensins and rescued the dysbiotic cecal microbiota of high-fat diet-induced obese mice. Life Sci. 2022;309:120961. doi:10.1016/j.lfs.2022.120961








 京公网安备 11011302003368号
京公网安备 11011302003368号