目前研究表明,5-甲基胞嘧啶 (5mC) 和 5-羟甲基胞嘧啶 (5hmC) 是哺乳动物基因组中常见的两种表观遗传标记。此外,当5mC在基因启动子中水平升高时,5mC会抑制基因转录。5hmC可能是5mC氧化产物的中间体,并且还稳定地参与到基因组DNA中,具有很高的稳定性。在启动子区域用 5hmC 替换 5mC 可以重新激活基因转录。因此,区分甲基化和羟甲基化启动子至关重要。目前用于分析DNA甲基化的“金标准”是亚硫酸氢盐测序,统计分析的是甲基化 (5mC) 和羟甲基化 (5hmC) 的总和 。而纳米孔测序技术(nanopore,ONT)可以直接从天然的DNA链中检测5mC,精准分析甲基化水平。百迈客是中国大陆目前通过 PromthION/GridION平台及DNA/RNA样本官方认证的公司。截至目前为止,百迈客ONT平台已经建立超过上百种物种类型的文库,拥有大量的项目经验!无论是技术还是项目经验上,我们都实力过硬!
摘要
多个肿瘤抑制基因(TSG)的下调在癌症形成中起重要作用。最近的证据表明,癌症进展涉及表观遗传修饰的全基因组改变,这可能导致肿瘤抑制基因的下调。针对肝细胞癌 (HCC) 细胞,利用纳米孔测序技术在全基因组范围内绘制5-甲基胞嘧啶信号以识别新的TSG。甲基化数据与再生肝脏和原发性HCC的转录谱数据的整合分析共鉴定到13个潜在的肿瘤抑制基因候选者。随后专注于对一种候选物——葡萄糖激酶 (GCK) 进行功能表征的验证。结果表明,GCK的过表达通过诱导细胞内乳酸积累来抑制HCC细胞的增殖,也由于NAD+耗竭而导致能量危机。这表明GCK作为肿瘤抑制基因发挥作用,可能参与HCC的发展。
背景介绍
肝细胞癌 (HCC) 是全球常见的肿瘤类型之一;然而,目前的治疗选择有限,没有有效的医疗策略。HCC通常发生在慢性肝病的背景下,其风险因素包括病毒性或自身免疫性肝炎、慢性酒精滥用和非酒精性脂肪肝。这些风险因素会引发异常的肝脏再生,从而引发HCC的形成。然而,潜在的分子机制仍然很大程度上未知。
据报道,失调的DNA甲基化是HCC发病机制中的早期事件之一。此外,近期有研究数据表明多个肿瘤抑制基因如CDKN2A、HNF4A和TTP,通过启动子甲基化的发生在HCC细胞和再生的肝细胞增殖中起关键作用的,提示启动子甲基化让TSG表达失调可能是HCC形成的一个重要因素。因此,新型TSG的鉴定将为阐述HCC形成的分子机制提供线索。
材料方法
实验材料:HepG2、Huh7、C3A 和 HLF 细胞(肝癌细胞系)
实验技术:ONT甲基化测序,EPIC测序,免疫组织化学 (IHC),免疫印迹杂交,RT-PCR,葡萄糖-6-磷酸(Glucose 6-P)测定,乳酸测定,NAD+/NADH测定,ATP 测定,结晶紫实验
结果
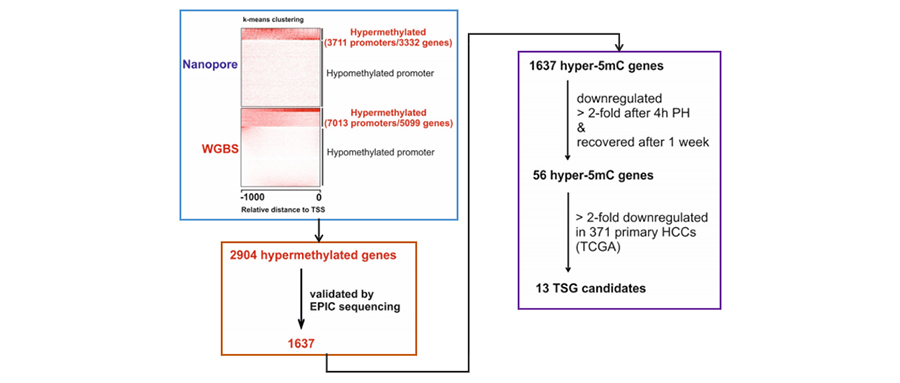
一、HCC细胞中高甲基化基因的鉴定
利用ONT平台对HCC细胞系 (HepG2) 进行测序,并和HepG2细胞的全基因组亚硫酸氢盐测序 (WGBS) 数据进行比较分析,如图1A所示,ONT测序的甲基化信号与 WGBS的甲基化信号具有良好的相关性。ONT测序数据发现甲基化水平在转录起始位点 (TSS) 下降(图1B),ONT测序数据和WGBS数据分别检测到3332和5099个基因的3711和7013个高甲基化启动子(图1C)。发现通过ONT测序检测到的87%的高甲基化基因(2904个基因)也同时被WGBS检测到(图1D)。接下来分析了只有WGBS数据检测到的2195个高甲基化基因的ONT测序覆盖率,以识别可能的羟甲基化基因,发现有489个至少有5条ONT测序的reads覆盖,但是软件并没有检测到有5mc甲基化水平(图1E),提示这些可能是羟甲基化。这些数据表明利用ONT测序数据分析5mC,能够将5mC 与胞嘧啶的其他修饰区分开。为了进一步提取高度可信的甲基化信号,针对约3000万个CpG位点进行了EPIC测序,在ONT测序数据和WGBS数据中检测到的2904个高甲基化基因,有1637个可以通过EPIC测序验证(图1G)。
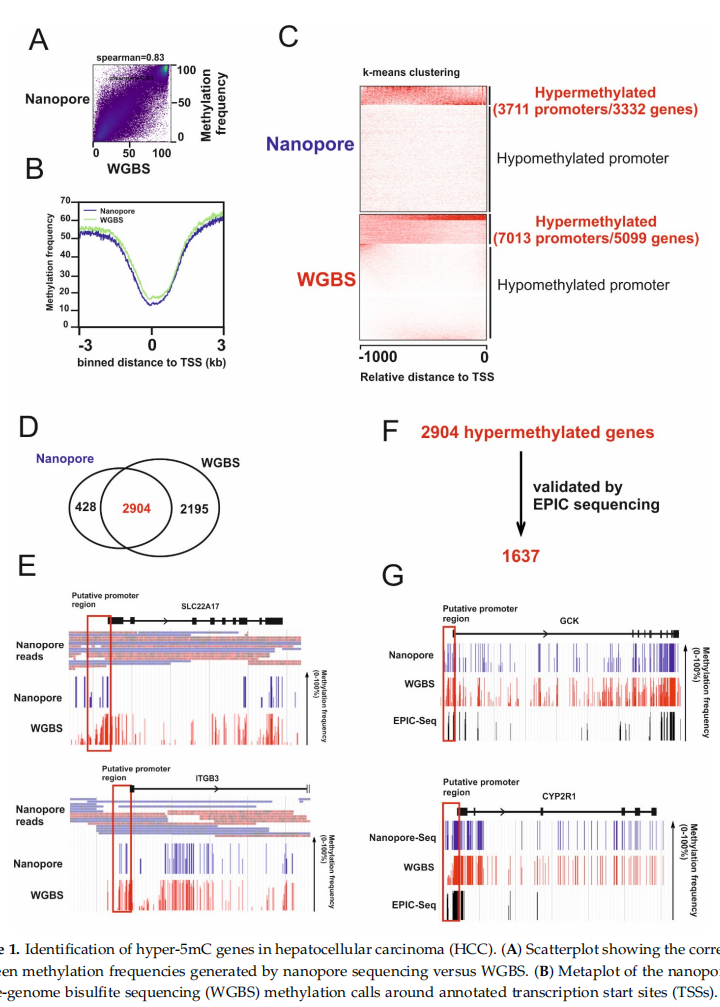
图1 肝细胞癌中高5mC甲基化的基因鉴定
二、HCC中识别新型TSG候选者
在肝再生过程中,增殖基因被激活,而抗增殖基因被抑制,从而使静止的肝细胞重新进入细胞周期。本研究选取小鼠三分之二肝部分切除术 (PH) 之前和之后四小时检测高甲基化基因的表达水平,挑选标准是与对照假手术(SH)相比表达量下调超过两倍的基因,以及这些基因应该在部分肝切除术后一周内恢复表达量(图2A)。基于这些标准,选取了56个基因。之后在TCGA的 371 个人类原发性 HCC和50个正常肝脏的RNA-seq数据中比较这些基因的表达,发现13 个在 HCC 中下调超过两倍(图2BC),其中有3个基因已知是肿瘤抑制基因(图 2C) ,分别是粘附连接相关蛋白 1 (AJAP1)、GATA 结合蛋白 5 (GATA5) 和卵磷脂视黄醇酰基转移酶 (LRAT) 。此外,其余10个潜在的抑癌基因具有不同的功能,包括转录调控 (NFATC2)、细胞迁移 (EFS和CXCL12)、葡萄糖代谢 (GCK) 和细胞生长 (PTH1R 和 SH3YL1)。
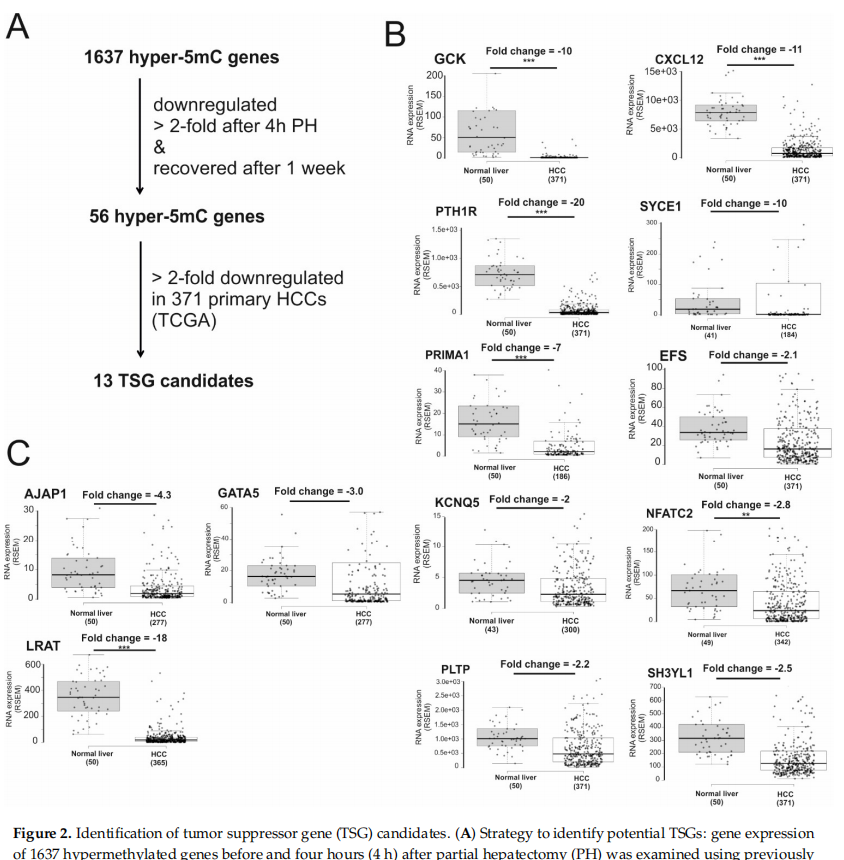
图2 候鉴定选肿瘤抑制基因
三、葡萄糖激酶 (GCK)的异位表达抑制HCC细胞的增殖
由于葡萄糖代谢的重编程是 HCC 的标志之一,进一步关注表征一种TSG 候选物 – 葡萄糖激酶 (GCK) 的抗增殖作用。为了检验GCK是否可能在HCC 细胞中发挥抑癌基因的作用,首先分析了GCK在正常人肝脏和四种HCC细胞系中的表达,即Huh7、HepG2、C3A 细胞和 HLF 细胞(图3A)。发现GCK在正常肝脏中高表达,在Huh7、HepG2、C3A细胞和HLF细胞中未检测到有表达。然后在这些细胞系中过表达带有FLAG 标记的GCK(图3B) ,并使用结晶紫实验检查细胞生长。GCK 的过表达强烈抑制 HepG2 和 C3A 细胞的生长,而在 HLF 和 Huh7 细胞中生长抑制的效果不太明显,但仍很显著(图3C)。利用增殖标记物Ki67进行的免疫组化染色证实了过表达GCK的HepG2和C3A细胞生长受到抑制(图3D)。为了检查GCK过表达后HepG2和C3A细胞的减少,是否是因为增殖受到抑制和受到凋亡诱导,对凋亡标记物PARP进行了免疫印迹杂交实验。如图3E所示,在GCK过表达的细胞中PARP没有增加。这些数据表明GCK的过表达抑制细胞增殖但不诱导细胞凋亡。
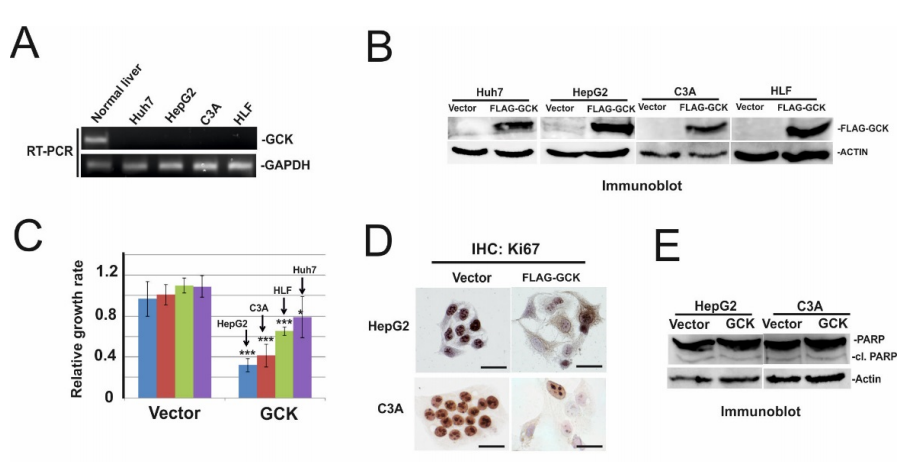
图3 GCK的过表达抑制细胞增殖
四、葡萄糖激酶的异位表达导致细胞内乳酸积累
研究表明在高糖培养基培养的大鼠肝癌细胞中,葡萄糖激酶的过表达会诱导葡萄糖摄取和高水平的乳酸积累。值得注意的是,本研究的细胞也是在高葡萄糖培养基中培养的。因此,检测了对照和GCK过表达细胞中细胞内葡萄糖6-磷酸(葡萄糖 6-P)和乳酸的含量。尽管在HepG2和Huh7细胞中GCK过表达后 Glucose 6-P水平都是增加的(图4A),但是细胞内乳酸仅在HepG2细胞中显著积累(图4B)。丙酮酸转化为乳酸脱氢酶的过程在NAD+的再生中起关键作用,在高浓度的乳酸下,乳酸脱氢酶表现出反馈抑制,NAD+再生率降低。NAD+在糖酵解过程中被还原为NADH,需要持续供应NAD+以维持连续的高糖酵解速率和最*细胞生长速率。NAD+/NADH比率的下降与细胞增殖的减少相关。因此,接下来检测了细胞内乳酸积累对NAD+再生和ATP产生的影响。如图4C所示,在GCK过表达的细胞中NAD+/NADH比率显著下降,并伴随着ATP水平的降低(图4D),提示NAD+消耗导致了细胞内乳酸积累而引起能量危机。
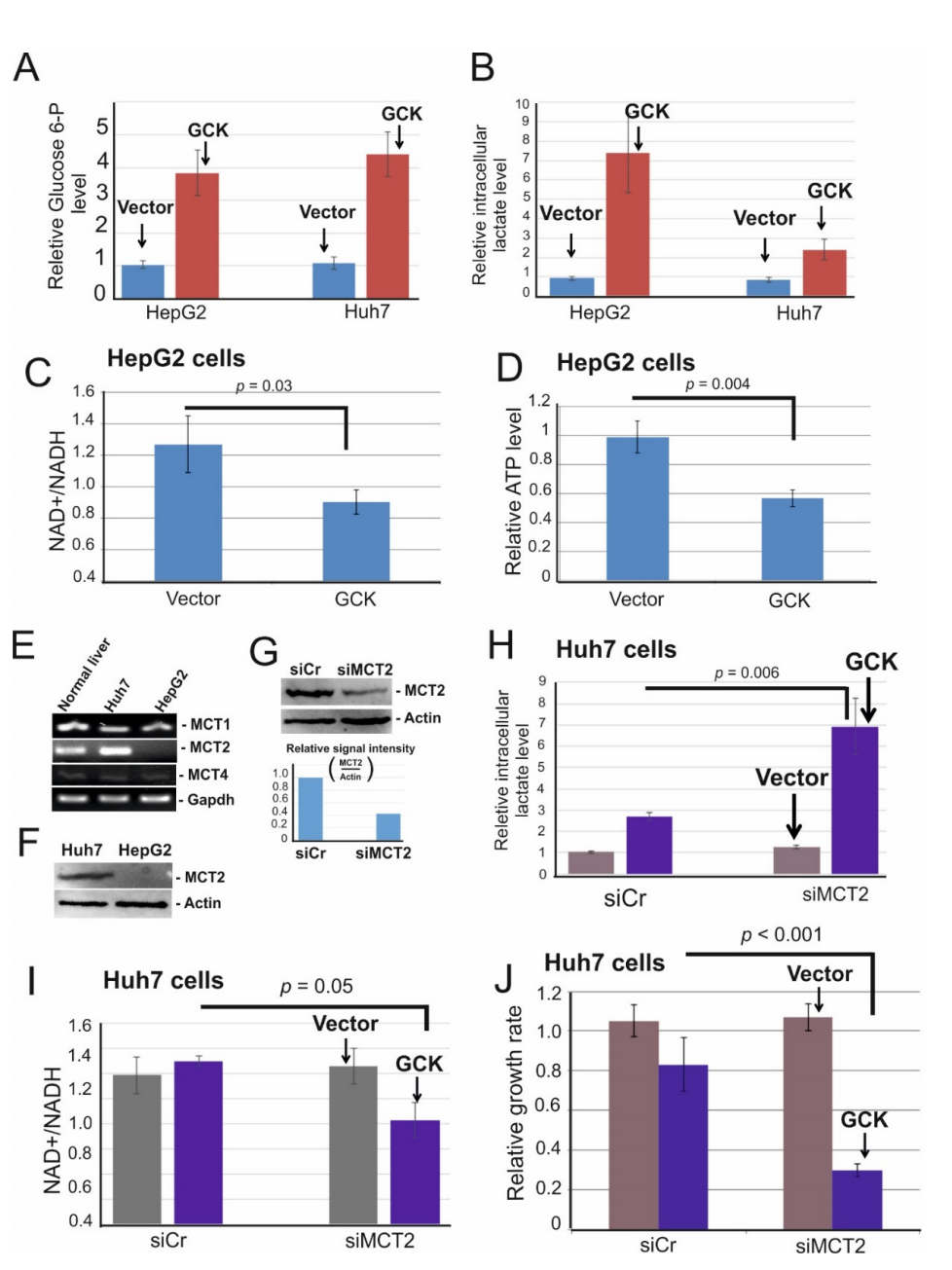
图4 GCK过表达导致细胞内乳酸积累并引起能量危机
五、MCT2 是减少 GCK 过表达细胞中细胞内乳酸积累所必需的
由于GCK过表达并未强烈诱导Huh7细胞中的乳酸积累,这就提出了乳酸是如何在这些细胞中外排的问题。乳酸外排由双向单羧酸转运体(MCTs)介导,已知有四种MCT可转运乳酸,因此检测了在 Huh7 和 HepG2 细胞中MCT变异体的表达。有趣的是,HepG2细胞仅表达MCT1和MCT4,而Huh7 细胞表达了三种变异体(图4E)。还通过免疫印迹杂交实验证实了HepG2 细胞中缺乏 MCT2的表达(图4F)。这些数据提出了随后的问题,即细胞内乳酸积累是否由于HepG2细胞中缺乏MCT2所致。为了检验这种可能性,耗尽了GCK过表达的Huh7细胞中的MCT2(图4G) 并检测了细胞内乳酸的浓度。事实上,MCT2 的消耗显著诱导了乳酸的积累(图4H)。因此,在MCT2耗尽的细胞中,NAD+/NADH 比率显著下降(图4I) 并伴随细胞增殖的减少(图4J)。总之,这些数据表明MCT2的缺乏在GCK过表达的细胞中显著积累了乳酸。
讨论
参考文章:
Davenport CF, Scheithauer T, Dunst A, et al. Genome-Wide Methylation Mapping Using Nanopore Sequencing Technology Identifies Novel Tumor Suppressor Genes in Hepatocellular Carcinoma. Int J Mol Sci. 2021;22(8):3937. Published 2021 Apr 11. doi:10.3390/ijms22083937







 京公网安备 11011302003368号
京公网安备 11011302003368号