1、前言
1.1适用范围
本指南介绍百迈客动物类组织&核酸样品的送样要求及制备方法。采集送样前请详细阅读。信息单中样本名称、组织部位必须与实物相符,避免因信息单与实物不符导致反复核对,影响样本质量、录入周期,导致提取核酸质量不满足建库测序要求,实验周期过长等
1.2声明
对于危害程度为第一、二类的高致病性样品,只接收提取后的核酸样品,不接收组织样。对于危害程度为三、四类的致病性或传染性的组织样,必须先通过销售或运营与医学实验平台负责人沟通,确认无高致病和传染性且能进行后续实验后再安排样品寄送。危害程度的判定标准具体参见《人间传染的病原微生物名录》
1.3提取风险提示
核酸提取质量与物种及组织部位、样本制备、样本交接、提取方法与操作、以及环境等因素息息相关,尤其是三代超长提取对样的要求更高。组织提取时可能受到上下游处理操作的影响,因此较难保证单次提取满足质量要求,望老师知悉理解,并做好组织备份。为保障获得相对较高质量的核酸,请老师务必按照以下指导原则准备样本。对于珍贵样本或微量样本,建议自行提取
2、组织送样量要求
注意:未在表格出现的物种,请单独沟通。送样量结果展示为满足提取一次的量,如样品经过特殊处理或样本状态异常有几率影响得率,为了保证您的实验可以顺利进行,请酌情增加送样量
2.1常规动物类组织送样要求
| 物种 | 举例说明 | 核酸类型 | 产品类型 | 组织部位(g) | ||||||
| 心脏 | 肝脏 | 脾脏 | 肾脏 | 脑 | 肌肉 | 肠道 | ||||
| 常规动物 | 哺乳动物、禽类、爬行动物 | DNA | 重测序 | 0.2 | 0.1 | 0.1 | 0.2 | – | 0.2 | 0.2 |
| SLAF | 0.2 | 0.1 | 0.1 | 0.2 | – | 0.2 | 0.2 | |||
| 甲基化 | 0.2 | 0.1 | 0.1 | 0.2 | – | 0.2 | 0.2 | |||
| ONT动植物重测序 | 0.5 | 0.25 | 0.25 | 0.5 | – | 0.5 | 0.5 | |||
| ONT动植物基因组 | 0.5 | 0.25 | 0.25 | 0.5 | – | 0.5 | 0.5 | |||
| PB动植物基因组 | 1 | 0.5 | 0.5 | 1 | – | 1 | 1 | |||
| Ultra Long ONT | – | 1 | 1 | 1 | – | 1 | 1 | |||
| RNA | 全长转录组(PB) | 0.3 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | ||
| 全长转录组(ONT) | 0.3 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | |||
| 二代转录组 | 0.3 | 0.1 | 0.1 | 0.1 | 0.1 | 0.1 | 0.1 | |||
| 真核小RNA | 0.3 | 0.1 | 0.1 | 0.1 | 0.1 | 0.1 | 0.1 | |||
| 长链非编码RNA | 0.3 | 0.1 | 0.1 | 0.1 | 0.1 | 0.1 | 0.1 | |||
| 节肢动物 | 昆虫(蚊子、苍蝇、蚂蚁) | DNA | 重测序 | – | – | – | – | – | 0.2 | – |
| SLAF | – | – | – | – | – | 0.2 | – | |||
| 甲基化 | – | – | – | – | – | 0.2 | – | |||
| ONT动植物重测序 | – | – | – | – | – | 0.3 | – | |||
| ONT动植物基因组 | – | – | – | – | – | 0.3 | – | |||
| PB动植物基因组 | – | – | – | – | – | 1 | – | |||
| Ultra Long ONT | – | – | – | – | – | 1 | – | |||
| RNA | 全长转录组(PB) | – | – | – | – | – | 0.2 | 0.2 | ||
| 全长转录组(ONT) | – | – | – | – | – | 0.2 | 0.2 | |||
| 二代转录组 | – | – | – | – | – | 0.2 | 0.2 | |||
| 真核小RNA | – | – | – | – | – | 0.2 | 0.2 | |||
| 长链非编码RNA | – | – | – | – | – | 0.2 | 0.2 | |||
| 水产动物 | 虾、蟹、鱼等(针对微小组织类型 需要在干冰上进行,注意操作时间不宜过长) | DNA | 重测序 | – | – | – | – | – | 0.3 | – |
| 外显子 | – | – | – | – | – | 0.3 | – | |||
| 甲基化 | – | – | – | – | – | 0.3 | – | |||
| ONT动植物重测序 | – | – | – | – | – | 1 | – | |||
| ONT动植物基因组 | – | – | – | – | – | 1 | – | |||
| PB动植物基因组 | – | – | – | – | – | 1.5 | – | |||
| Ultra Long ONT | – | – | – | – | – | 1.5 | – | |||
| RNA | 全长转录组(PB) | 0.3 | 0.3 | 0.3 | 0.3 | 0.3 | 0.3 | 0.3 | ||
| 全长转录组(ONT) | 0.3 | 0.3 | 0.3 | 0.3 | 0.3 | 0.3 | 0.3 | |||
| 二代转录组 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | |||
| 真核小RNA | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | |||
| 长链非编码RNA | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | |||
| 物种 | 核酸类型 | 产品类型 | 送样量(g) |
| 皮肤 | DNA | 重测序 | 0.5 |
| 外显子 | 0.5 | ||
| 甲基化 | 0.5 | ||
| ONT动植物重测序 | 1 | ||
| ONT动植物基因组 | 1 | ||
| PB动植物基因组 | 2 | ||
| Ultra Long ONT | – | ||
| RNA | 全长转录组(PB) | 0.5 | |
| 全长转录组(ONT) | 0.5 | ||
| 二代转录组 | 0.3 | ||
| 真核小RNA | 0.3 | ||
| 长链非编码RNA | 0.3 |
2.2动物类血液送样量
| 组织部位 | 物种 | 核酸类型 | 产品类型 | 送样量(ml) |
| 全血 | 哺乳动物 | DNA-EDTA抗凝 | 重测序 | 0.3 |
| SLAF | 0.3 | |||
| 甲基化 | 0.3 | |||
| ONT动植物重测序 | 0.5 | |||
| ONT动植物基因组 | 0.5 | |||
| PB动植物基因组 | 1 | |||
| Ultra Long ONT | 1 | |||
| RNA-PAXgen管送样 | 全长转录组(PB) | 10 | ||
| 全长转录组(ONT) | 10 | |||
| 二代转录组 | 10 | |||
| 真核小RNA | 10 | |||
| 长链非编码RNA | 10 | |||
| RNA-EDTA抗凝 | 全长转录组(PB) | 0.5 | ||
| 全长转录组(ONT) | 0.5 | |||
| 二代转录组 | 0.5 | |||
| 真核小RNA | 0.5 | |||
| 长链非编码RNA | 0.5 | |||
| 禽类 | DNA-EDTA抗凝 | 重测序 | 0.05 | |
| SLAF | 0.05 | |||
| 甲基化 | 0.05 | |||
| ONT动植物重测序 | 0.1 | |||
| ONT动植物基因组 | 0.1 | |||
| PB动植物基因组 | 0.1 | |||
| Ultra Long ONT | 0.1 | |||
| RNA-EDTA抗凝 | 全长转录组(PB) | 0.5 | ||
| 全长转录组(ONT) | 0.5 | |||
| 二代转录组 | 0.5 | |||
| 真核小RNA | 0.5 | |||
| 长链非编码RNA | 0.5 |
2.3动物类细胞送样量
| 组织部位 | 物种 | 核酸类型 | 产品类型 | 送样量(个) |
| 细胞 | DNA | 重测序 | 1*10e6 | |
| SLAF | 1*10e6 | |||
| 甲基化 | 1*10e6 | |||
| ONT动植物重测序 | 5*10e6 | |||
| ONT动植物基因组 | 5*10e6 | |||
| PB动植物基因组 | 5*10e6 | |||
| Ultra Long ONT | 1*10e7 | |||
| RNA | 全长转录组(PB) | 5*10e6 | ||
| 全长转录组(ONT) | 5*10e6 | |||
| 二代转录组 | 3*10e6 | |||
| 真核小RNA | 3*10e6 | |||
| 长链非编码RNA | 3*10e6 | |||
3、核酸送样要求
1)核酸送样需要提供相关检测结果,DNA类核酸可提供以下检测手段中的一种或多种检测结果: Qubit、 NanoDrop、 AGE,同时请采取适当的纯化方法,以避免多糖、多酚、蛋白或者核酸酶对DNA样品的污染,并详细注明溶解DNA所使用的溶解液类型
2)如果您开展的实验项目为miRNA的相关实验,并且提供的是总RNA的样本,请务必确认您采用的总RNA的提取方法保留了小RNA ( 包括miRNA),提取试剂盒型号备注送样信息单中
3.1二代DNA送样量要求
| 产品类型 | SLAF | 重测序 | 甲基化 | 外显子 | FFPE | PCR产物 | PCR-free | chip-seq |
| 浓度ng/ul | 5 | 1 | 5 | 6 | 14 | 0.6 | 40 | 1 |
| 总量ug | 1.5 | 0.1 | 1 | 0.1 | 0.25 | 0.1 | 1 | 0.06 |
| 体积ul | 15 | 15 | 15 | 15 | 20 | 15 | 15 | 15 |
3.2三代DNA送样量要求
| 产品类型 | ONT动植物重测序 | ONT动植物基因组 | PB动植物基因组 | 超长 |
| 浓度ng/ul | 40 | 100 | 50 | 50 |
| 总量ug | 4 | 10 | 15 | 15 |
| 体积ul | 15 | 15 | 15 | 50 |
3.3RNA类送样量要求
1)针对核酸有杂质、污染、粘稠、颜色等情况,需要过柱纯化后送样或者酌情增加送样量
2)核酸样品建议使用1.5ml、2ml EP管装载样品,其他保存管容易破裂且不利于保存样品和后续实验的开展
3)为了防止样品污染和混淆,禁止使用96孔板和深孔板装载样品
4)用乙醇沉淀的样品由于运输中会有少量乙醇挥发,建议将样品管盖用封口膜缠绕4-5圈
5)考虑到核酸可能存在含有杂质、颜色等物质导致会产生大量损失的风险,为保证样本一次检测合格并节约宝贵的重送样时间,送样建议量是高于公司判定标准的,请在核酸量足够的前提下尽量按
| 项目类型 | 初检结果(浓度、体积、纯度) | 样品状态 | ||
| 浓度(ng/ul) | 总量(ug) | 体积(ul) | ||
| 全长转录组(PB) | 100 | 1 | 15 | 正常 |
| 全长转录组(ONT) | 100 | 1 | 15 | 正常 |
| 二代转录组 | 20 | 1 | 15 | 正常 |
| 真核小RNA | 80 | 1 | 15 | 正常 |
| 长链非编码RNA | 80 | 1 | 15 | 正常 |
4、样品制备保存指南
4.1常规动物类样本(脊柱动物、哺乳动物)
常规动物主要包括脊椎动物组织样本主要包括:哺乳动物、禽类、爬行动物以及两栖动物。送样需要选择新鲜采集的样本,尤其是Ultra long ONT建库,样本的取材优先选择核酸含量相对较高的组织,样本制备优先级:血液>内脏>肌肉。活体取下新鲜组织(肌肉、肝脏或其他组织,避免用易于寄生微生物的表皮和肠道、可能有变异细胞的病变组织),立即剔除结缔组织和脂肪组织等非研究所需的组织类型。对肿瘤组织的取材,应尽可能准确地判定肿瘤和正常组织,肿瘤组织应将周围的正常组织切除干净(正常组织也应将周围的肿瘤组织切除干净),肠道组织一定要把内容物清洗干净
4.1.1液氮速冻组织操作流程(所有产品适用)
1)提前准备好冷冻组织的足量液氮,预装样品的冻存管,并在做好标记(尽量不使用汉字命名,命名字符控制在5个以内)
2)活体取下新鲜的组织
3)迅速用预冷的PBS溶液(RNase free)或0.9%生理盐水将组织表面的残留血液冲洗干净
4)如果组织体积较大,将组织切成长宽高均≤0.5 mm 的小块(即黄豆大小)
5)将冻处理好的组织样本混合均匀后保存于2 mL 或更大体积的螺口冻存管(RNase free)中,标注编号
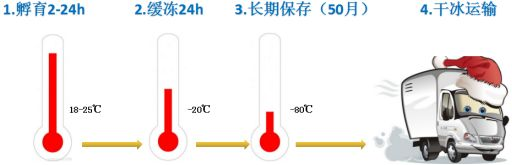
6)立即(20s内)置于液氮中冷冻 3~4 h,然后转移至-80 °C长期保存
7)干冰运输
4.1.2TRIzol保存样品制备流程(仅RNA细胞组织适用)
1)如果使用 TRIzol裂解液保存送样,请务必先进行液氮研磨破碎,样品量取参考标准送样量的1/3,然后溶于 TRIzol 中,组织样品切勿过量
2)震荡混匀,常温裂解 5 min 后,使用低温离心机12000g离心10min,将上清液转至新的2.0ml离心管中(拍质控照片,方便核查),转移至-80℃低温保存,运输时选择干冰寄送
3)禁止使用trizol保存组织样品送样
4.1.3RNAlater® Tissue Collection保存样品制备流程(仅RNA适用)
1)用RNAlater® Solution保存组织之前,需要将组织切割成长宽高均≤ 0.5 mm的小块
2)如果组织带血液或其他体液,需要过夜后更换一次RNAlater® Solution;不要将刚浸入RNAlater Solution中的样本立即冷冻,需将样本置于4 °C 保存过夜(使Solution充分浸润组织样本),然后转移至-20 °C 或-80 °C 长期保存
3)RNAlater® Solution 不会影响组织结构,可以把已保存的组织从 RNAlater® Solution中取出,切下实验所需的用量,把剩余的组织再放入到原来的保存液中继续保存
4)保存于RNAlater® Solution中样本,-20 °C 存放时,样本不会结冻,但可能会有晶体析出,这并不影响后续的 RNA 提取工作;-80 °C 存放时,样本会结冻, 在进行 RNA 提取前,需置于冰上融化再进行后续操作,解冻后的样本可再次放入-80 °C 保存
5)一般来讲,生物样本保存于RNAlater® Solution中,37 °C可存放1天,25 °C(室温)可存放1周,4 °C 可存放1个月,-20 °C 或-80 °C 可长期保存。但鉴于生物样本的特殊性及实验可重复性,建议所有保存于RNAlater® Solution中样本,都要置于-20 °C 或-80 °C 长期保存
4.2全血
DNA类产品推荐使用EDTA抗凝管采集后分装,RNA类产品优先推荐使用PAXgene血液RNA管采集。血样建议为新鲜采集,不建议保存时间过长。血液相关产品仅接收全血或分离的细胞样本,不接收血清、血浆
4.2.1DNA常规产品制备操作流程
1)用医用抗凝管或已装有抗凝剂(选用柠檬酸钠或 EDTA 抗凝剂,由于会影响实验所以不可用肝素)的旋盖管收集全血样本
2)上下轻轻颠倒混匀十次后,分装到常规EP管中(体积不要超过EP管的一半),转移至-20或-80 °C长期保存(实际根据采血管的说明要求操作)
3)干冰运输
注1:血液采集管请尽量不要用需专门对应提取试剂盒的采血管,以防送样后我们因无对应试剂盒影响提取时间(尽量送样前沟通)
注2:采集完血液之后需将血液转移至EP管中,玻璃材质采血管冷冻之后易碎

4.2.2Ultra Long ONT样本制备流程
4.2.2.1新鲜血液
1)采集血液( 5- 10mL),然后加入含 EDTA 抗凝管中(不可使用肝素 、柠檬酸钠等抗凝管,建议使用 Cell-Free 采血管,做好标记(样本名称,日期,体积)
2)轻轻颠倒混匀十次,室温正立放置
3)冰袋(4 °C )运输需避开节假日(注意冰袋尽可能多放,样本置于中间,保证箱体温度维持在 4 °C)。从血液离体算起,运输至实验人员手中不可超过 3 天
4.2.2.2冻存血液
1)血液用抗凝管采集后轻轻颠倒混匀十次
2)哺乳动物血液分装到 2ml 离心管里,1ml/管(至少2管,若血量不足,可根据实际情况送样)
3)鱼类、禽类、两栖类全血分装到 1.5ml 离心管里, 100ul/管(至少5管,若血量不足,可根据实际情况送样)
4)做好标记(样本名称, 日期,体积),液氮速冻,干冰寄送
4.2.3RNA产品制备操作流程
4.2.3.1PAXgene血液RNA管制备流程(人和灵长类动物优先选择该方式送样)
1)PAXgene管的介绍
在研究细胞内 RNA 使用的许多分子测试中,采集全血是第一步。 这类测试中的最大挑战是细胞内 RNA不稳定,在采血后几小时内迅速降解。 此外,通过基因诱导过程,某些种类的 RNA 采血后在体外增加。 体外 RNA 降解和基因诱导均会导致体内基因转录物相对数量估计过低或过高。 PAXgene 血液RNA 管含有一种附加剂,通过减少体外 RNA 降解和尽量减少基因诱导,可稳定体内基因转录谱。 与PAXgene 血液 RNA 套件配套使用时,PAXgene 血液 RNA 管可以实现准确的基因转录物检测和定量
2)采集前准备
A.PAXgene Blood RNA Tube(2.5mL采血管,含专用RNA稳定剂)
B.符合标准的静脉采血装置(无菌针头、持针器、止血带等)
C.毒用品(酒精棉片、碘伏等)
D.生物安全防护装备(手套、护目镜等)
3)采集流程
A.确保 PAXgene 血液 RNA 管使用前在 18-25˚C 温度下,且正确贴有标本识别标签
B.如果 PAXgene 血液 RNA 管是待抽吸的唯一试管,应当先抽血至“丢弃管”,再抽血至 PAXgene 血液 RNA 管,这样便可以灌注放血过程中使用的采血装置的内部空间。 否则,PAXgene 血液 RNA 管应是放血程序中最后抽吸的试管
C.采用您所在机构推荐的标准静脉穿刺技术程序,使用采血装置和试管固定器,采血2.5ml至 PAXgene 血液RNA 管
D.采血后立即轻轻地将PAXgene 血液 RNA 管倒置 8–10 次
E.在室温下 (18–25˚C) 直立存储 PAXgene 血液 RNA 管至少 2 小时,最多 72 小时,然后再处理或转移至冷藏室 (2–8˚C) 或冷冻室 (-20˚C)。 若需要 -70˚C / -80˚C 的存储温度,请参见“PAXgene 血液RNA 管内所采集标本的冷冻和解冻程序” 以获取详细信息
4)注意事项
A.确保采血管在有效期内,无漏液或变色(正常试剂为淡黄色)
B.不可预先打开管盖,避免稳定剂失效
C.一旦受到碰撞,冷冻的 PAXgene 血液 RNA 管就容易破裂。为降低在运输期间破裂的风险,请按照处理玻璃管的方式来处理冷冻的试管。使用者必须确认自己的 PAXgene 血液 RNA 管冷冻和运输协议
D.PAXgene 血液 RNA 管填充不足会导致血液与附加剂的比率错误,且可能导致分析结果错误或产品性能欠佳
E.PAXgene血液 RNA 系统不适用于采集和纯化病毒 RNA
4.2.3.2EDTA抗凝管送样制备流程
1)用医用抗凝管或已装有抗凝剂(选用柠檬酸钠或 EDTA 抗凝剂,由于会影响实验所以不可用肝素)的旋盖管收集全血样本
2)上下轻轻颠倒混匀十次后,分装到常规EP管中(体积不要超过EP管的一半),转移至-20或-80 °C长期保存(实际根据采血管的说明要求操作)
3)干冰运输
4.3昆虫
1)昆虫样本,需进行表面微生物的清洗,某些吸血性昆虫,例如蚊子,血吸虫,该类型样本可能存在外源污染,需要进行切腹,去除肠道处理。较大个体的选取不带肠道部分的组织,将组织切成长宽高均≤0.5 cm 的小块(即黄豆大小),对于较小个体只能用整个个体的,应进行适当的饥饿处理(注意保证昆虫的活性)
2)提前准备好冷冻组织的足量液氮,预装样品的冻存管,并做好标记(尽量不使用汉字命名,命名字符控制在5个以内)
3)转移至-80℃低温保存,送样时选择干冰运输寄送
注1:小型昆虫组织务必在信息单中备注微量样本需液氮交接防止降解。同时该类样本因只满足一次或低于常规一次提取用量,我们无法保证100%提取合格
注2:蜜蜂送样时尽量要求老师取胸部肌肉送样,整个蜜蜂送样提取的核酸状态大多数异常,影响后续实验。不建议送实验室剔除,因为组织速冻过之后再剔除会化冻,提取降解的可能性较大
4.4微生物
4.4.1细菌
1)显微镜下观察细菌生长状态,建议收集生长期处于对数期的细菌
2)将适量体积的菌液转移至2 mL 旋盖尖底离心管(无菌,无核酸酶)中,于室温下14000 ×g 离心1 min
3)弃掉培养基,将细菌菌体沉淀迅速置于液氮中冷冻1-3 h以上(冻存时间视组织量而定,保证样品冻存充分),然后转移至-80 °C长期保存
4)将样品管置于管架上固定好后埋在干冰箱的中间部位,大体积干冰运输
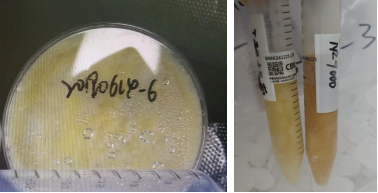
5)以下为不规范送样图片:菌体平板(左图),菌液送样(右图)
4.4.2真菌
4.4.2.1单细胞真菌
单细胞真菌以酵母菌为代表。一次提取反应所需酵母菌的量需≤1×107个,以 5×106-1× 107个为宜。您要做的项目要求送样量较大时,可以将样品按上述数量要求分装后单独保存
1)显微镜下观察酵母菌生长状态,最好收集生长期处于对数期的酵母菌
2)将适量体积的酵母菌液转移至将2 mL旋盖尖底离心管中(无菌,无核酸酶),于室温下14000×g 离心1 min
3)弃尽培养基,将酵母细胞沉淀迅速置于液氮中冷冻1-3 h以上(冻存时间视组织量而定,保证样品冻存充分),然后转移至-80 °C长期保存
4)将样品管置于管架上固定好后埋在干冰箱的中间部位,大体积干冰运输
4.4.2.2多细胞真菌(大型真菌)
1)取完整菌体,先用大量清水冲洗其表面杂质,再用纯水清洗一遍,使用吸水纸吸干表面的水份后,用剪刀将组织分割为小块,做好标记(样本名称,日期,,体 积)放液氮里速冻,干冰寄送
2)菌丝:将无菌棉签轻轻触碰菌落或菌斑的中心部分,避免碰到边缘或其他细菌来源。然后,将棉签迅速划过培养基表面,以收集菌丝转移至将2 mL旋盖尖底离心管中(无菌,无核酸酶),于室温下14000×g 离心1 min。(可根据样品量收集多管或使用15mL螺旋管收集)
4.5水产类
水产类包括淡水鱼类、海水鱼类、贝类、藻类。送样需要选择新鲜采集的样本
1)优先选用新鲜采集的样品送样,稀有样本可酌情选取冻存组织。采集样品时应选取核酸含量较多的部位
2)取得活体组织后,用清水清洗,以去除污物,吸干表面液体
3)活体取材后用预冷的0.9%生理盐水进行清洗,去除血渍和污物
4)将样品分割成50 mg左右的小块(约黄豆大小),样品分割和处理时应尽量在冰上进行,防止样品降解。避免装样太满以至冻裂,造成样品污染
注:水产类样品需尽量保证为新鲜个体。尽量避免寄送保存时间较长或经过反复冻融的组织样品。针对软体动物可先使用75%的乙醇进行漂洗,漂洗干净后液氮冷冻,干冰运输;针对刺胞动物,可去除头部和肠道等部位,保留肌肉外壁用于提取
4.6细胞
4.6.1贴壁细胞
4.6.1.1液氮速冻法
1)确定细胞生长状态良好;离心得到细胞沉淀(依据客户实验室细胞离心步骤,注意细胞离心要适度,不要使细胞离心过实而造成裂解液不能充分渗透,4度离心机,转速800g为宜)
2)弃去培养基,加入 1 mlLPBS(RNase free,室温),轻轻将细胞沉淀悬起, 转移至 2 mL 旋盖尖底离心管(RNase free)中
3)离心(依据客户实验室细胞离心步骤,注意细胞离心要适度,不要使细胞离心过实而造成裂解液不能充分渗透,4度离心机,转速800g为宜)得到细胞沉淀,弃去PBS,液氮速冻2h之后转移至-80℃低温保存,送样时选择干冰运输寄送
4.6.1.2TRIzol裂解法
1)离心收集的细胞迅速溶于 TRIzol 裂解,每 5 X 10^6个细胞加 1 mL TRIzol
2)细胞溶于 TRIzol 后,如出现成团,需用吸头将细胞团吹打散,或者激烈震荡混匀,使细胞完全溶于 TRIzol 中充分裂解
3)室温静置5min,之后转移至-80℃低温保存,送样时选择干冰运输寄送
4.6.2悬浮细胞
4.6.2.1液氮速冻法
1)确定细胞生长状态良好;离心得到细胞沉淀(依据客户实验室细胞离心步骤,注意细胞离心要适度,不要使细胞离心过实而造成裂解液不能充分渗透,4度离心机,转速800g为宜)
2)弃去培养基,加入 1 mlLPBS(RNase free,室温),轻轻将细胞沉淀悬起, 转移至 2 mL 旋盖尖底离心管(RNase free)中
3)离心(依据客户实验室细胞离心步骤,注意细胞离心要适度,不要使细胞离心过实而造成裂解液不能充分渗透,4度离心机,转速800g为宜)得到细胞沉淀,弃去PBS,液氮速冻2h之后转移至-80℃低温保存,送样时选择干冰运输寄送
4.6.2.2TRIzol裂解法
1)离心收集的细胞迅速溶于 TRIzol 裂解,每 5 X 10^6个细胞加 1 mL TRIzol
2)细胞溶于 TRIzol 后,如出现成团,需用吸头将细胞团吹打散,或者激烈震荡混匀,使细胞完全溶于 TRIzol 中充分裂解
3)室温静置5min,之后转移至-80℃低温保存,送样时选择干冰运输寄送
5、注意事项
核酸提取质量与物种及组织部位、采集方法及保存状态、提取方法及操作、实验器材及环境等因素均有密不可分的联系,尤其是三代超长提取对样本的质量、总量要求更高,望知悉及理解,并做好样本备份。为了保障获得高质量的核酸,请务必按照送样手册所规定的准备样本。对珍贵样本或者微量样本,建议自行提取。
1)组织速冻时间:组织离体后,胞内核酸便开始降解,尤其是 RNA,故采集时,目的组织离体后,需立即速冻,建议 3min 内完成,越快越好。速冻时间过短会导致速冻不彻底,核酸有降解风险
2)组织送样量:建议送样量适用于 95%的物种组织,少部分组织因胞内核酸量较低,需适当增加送样量,比如动物皮肤、毛发等。请严格按照上方组织送样量要求送样,送样量过少或过多均不利于提取实验。采样量较少会导致提取的核酸总量、浓度不合格,采样量过多反而会造成速冻不彻底、提取取样困难、冻融降解等危险
3)组织状态:不建议送组织状态差或非生长旺盛期样品,核酸有一定几率降解
4)组织保存管的选择:所有组织样品务必使用离心管或螺纹管保存,切勿直接装入密封袋(低温冻脆易破裂,导致样品泄露,交叉污染)保存
5)组织样品保存方法选择:首选液氮速冻;没有液氮条件的,可直接放入-80℃冰箱冻存。未使用液氮速冻或液氮速冻时间过短都有一定几率导致核酸降解
6)组织送样方式的选择:干冰运输,且需要保证干冰的充足,冰袋和常温送样,有几率导致核酸的降解。除RNA类样品可使用RNAlater保存送样,其余产品均建议送速冻组织,不建议使用保护液送样,化开离心会有几率导致核酸降解;不建议酒精送样,固定不彻底,有一定几率残留核酸酶,降解核酸
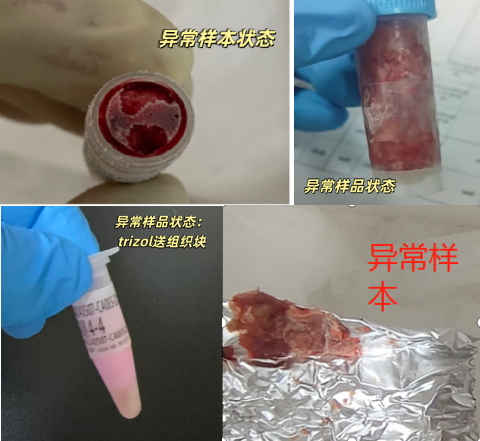
7)冻融组织: 组织冻存后,一旦冻融,核酸降解概率大于 80%,几乎不可能提取成功,此类组织不建议送样。请各位老师送样前注意组织保存状态, 确保组织未发生过冻融情况
8)带血组织:由于血液没有专业的保护剂,去除不净一起速冻送样会影响组织的完整性
9)长年保存的组织:保存时间超过一年的组织不建议送样
10)组织分离要求:正常组织样本中不能含有病变组织,而病变组织样本中也不可以夹带有正常组织,提取实验时无法精确取样,无法称重。组织量过多的不能全部取样,只随机选取适量组织提取
11)对于同一个组织样品需要同时提取 DNA和 RNA 的,请务必分成两管分批次送样。样本的特殊处理包括:盐处理、温度处理、药物处理、病毒侵染、伤害处理、干旱处理等胁迫处理方式,不同程度的处理对样本的核酸质量会造成不同程度的影响,常见的会导致核酸 的降解或者得率降低。因此,经过特殊处理的样本,在送样时,务必请在样本信息单中进行详细的备注,以便尽量提高提取的成功率和避免样本的浪费
6、不合格样品存在风险
6.1样本总量不足、浓度过低存在风险
1)文库构建失败
2)文库产量低不能上机测序或测序数据量不足
3)导致数据随机性异常
4)数据质量差
6.2降解样本风险
1)文库构建失败
2)文库产量低不能上机测序或测序数据量不足
3)导致数据随机性异常
4)数据质量差
5)导致数据duplication比例高、随机性差
6)导致Small RNA rRNA比例高,影响有效数据,文库片段异常
6.3蛋白或其他杂质污染
1)可能影响Small RNA电泳分离,造成切胶不准,影响问题质量
2)可能影响RNA-seq磁珠分离导致建库失败,或即使达到上机要求也可能导致文库随机性差等问题
3)文库构建失败
4)文库产量低不能上机测序或测序数据量不足
6.4目标RNA含量低
1)总RNA达到要求,但由于样本特异性,small RNA含量低于正常样本,导致建库失败
2)总RNA达到要求,但由于处理或组织部位的特异性,mRNA降解或含量低,导致建库失败或者测序数据中rRNA 数据比例高








 京公网安备 11011302003368号
京公网安备 11011302003368号