又又一篇高分ONT全长转录组的合作应用文章发表啦!趁着新鲜出炉,小编带大家看看别人的高分文章怎么组装的,又是讲了怎样的故事,下面一起学习讨论一下该文的详细内容。Tip:作者排名中Wenzheng QU同学是来自百迈客哦!
英文题目:Collagen β(1-O) galactosyltransferase 2 deficiency contributes to
lipodystrophy and aggravates NAFLD related to HMW adiponectin in mice
中文题目:Colgalt2缺乏可导致小鼠脂质营养不良,加重与HMW脂联素相关的NAFLD
发表杂志:Metabolism
影响因子:6.159
发表时间:2021年4月15日
合作单位:首都医科大学
非酒精性脂肪肝(NAFLD) 是世界范围内最普遍的慢性肝病,影响了近25%的全球人口。根据组织学特征,NAFLD可分为非酒精性脂肪肝(NAFL)和非酒精性脂肪性肝炎(NASH)。随着NAFLD的进展,近20%的NAFLD患者可能会出现NASH,而部分NAFLD患者(4% NAFL和20% NASH)可能在其一生中发展为肝硬化。目前,NAFLD的有效治疗仍然有限,重要原因之一是其发病机制尚未完全阐明。
研究概要总结
目的
课题组前期研究结果显示,Colgalt1基因敲除导致小鼠E11.5天胚胎死亡,及抑制胶原分泌。本研究旨在阐明胶原β(1-O)半乳糖转移酶2(Colgalt2)在非酒精性脂肪肝(NAFLD)发病机制中的作用。
方法
采用高脂饲料(HFD)或缺乏蛋氨酸-胆碱的饲料(MCD)喂养Colgalt2−/−小鼠。利用ONT全长转录组技术对肝脏组织进行测序。进一步,在体外诱导肝细胞脂肪变性和前脂肪细胞分化。
结果
在6周龄时,Colgalt2−/−小鼠体重增加,肝脏脂肪堆积。在HFD或正常饮食的小鼠中,Colgalt2敲除加重肝脂肪变性。Colgalt2敲除促进MCD喂养小鼠的NASH。在HFD小鼠中,Colgalt2敲除导致脂肪萎缩,并降低血浆HMW(高分子量)、总脂联素和瘦素水平。在HFD喂养的小鼠中,Colgalt2敲除也降低了血液中HMW/总脂联素,而脂联素的mRNA和蛋白质水平在WT和Colgalt2−/−小鼠中没有差异。ONT全长转录组测序分析结果显示脂联素受体下游信号通路和脂肪生成基因的转录变化,包括AMPK信号通路、脂肪细胞因子信号通路和脂质代谢(Cidea、Cidec、CD36和PPARγ)。Colgalt2敲除对油酸OA诱导的HepG2细胞或原代肝细胞的脂质堆积与对照组细胞无显著差异。然而,干扰Colgalt2可抑制脂肪细胞生成,并降低PPARγ(脂肪生成相关转录因子)在前脂肪细胞分化过程中的表达。
结论
在小鼠中,Colgalt2敲除导致脂肪萎缩加重与HMW脂联素相关的NAFLD。
实验设计
构建Colgalt2−/− (C57BL/ 6J背景)小鼠。
高脂肪饮食模式
8周龄雄性Colgalt2+/+(WT)和Colgalt2−/− 小鼠,随机分为正常饮食组Chow(N=10)或高脂饮食组HFD(N=12)16周。每周测量体重(BW)。造模结束后,牺牲小鼠。对肝脏和附睾白色脂肪组织(eWAT)进行称重并收集以备后续实验。血浆储存于−80°C.
蛋氨酸和胆碱缺乏饮食模型
7周龄雄性WT和Colgalt2−/− 小鼠维持蛋氨酸胆碱充足饮食MCS(N=6)或蛋氨酸胆碱缺乏饮食MCD(N=8),持续3周。造模结束后,牺牲小鼠,称取体重和肝重。采集血浆和肝脏样本作进一步分析实验。
实验技术: 葡萄糖耐量(GTT)和胰岛素耐量(ITT)检测,血浆生化分析及肝甘油三酯含量测定,H&E染色,油红O染色及免疫组化染色,ONT全长转录组测序(ONT全长转录组测序由百迈客协助完成),WB和qRT-RCR验证。
测序平台:Nanopore

Colgalt2缺乏机制原理图
文章结果
1、Colgalt2基因敲除小鼠中体重和肝脏脂质积累增加
通过肝组织的PCR和western blotting,结果显示Colgalt2−/−小鼠中不表达COLGALT2。在3,6,8周龄时分别对Colgalt2−/−和WT小鼠称重,结果显示Colgalt2敲除增加了小鼠的体重(图1a)。通过透射电镜观察发现,6周龄Colgalt2−/−小鼠肝细胞中有脂滴聚集(图1b)。然而,在6-8 周龄时,WT小鼠和Colgalt2−/−小鼠的肝油红O染色和TG含量没有明显差异(图1c)。

图1 Colgalt2丢失增加了体重和肝脏脂质积累
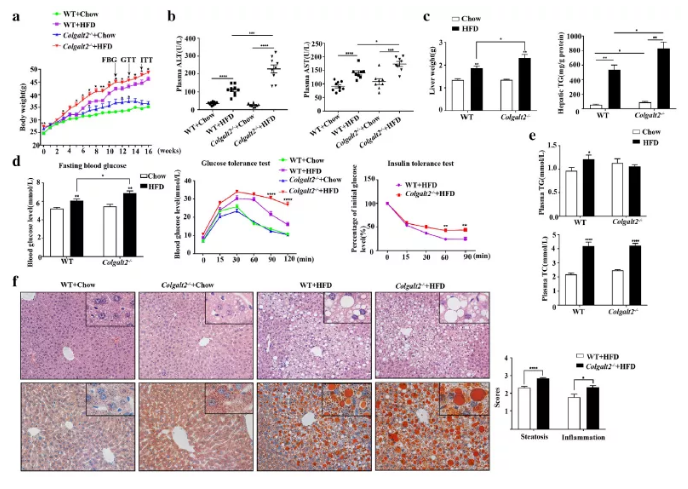
2、在HFD喂养的小鼠中发现Colgalt2敲除增加肝脏脂肪变性和胰岛素抵抗
为了研究Colgalt2敲除对HFD诱导的NAFLD的影响,雄性WT和Colgalt2−/−小鼠分别饲喂HFD或正常饲料16周。结果发现Colgalt2−/−小鼠的体重增加大于HFD组的WT小鼠(图2a)。此外,与WT小鼠相比,HFD喂养的Colgalt2−/−小鼠的肝脏TG含量增加了54%,标准饲料组的Colgalt2−/−小鼠的肝脏TG含量增加了60%(图2c)。同时,在HFD或标准饲料喂养的小鼠中,肝切片的H&E和油红O染色显示,Colgalt2−/−小鼠的肝脂肪变性比WT小鼠更严重(图2f)。
血液ALT和AST水平表明HFD喂养的Colgalt2−/−小鼠的肝损伤加重。HFD喂养的Colgalt2−/−小鼠血浆中ALT和AST水平分别比WT小鼠高2倍和1.2倍(图2b)。然而,HFD喂养的Colgalt2−/−小鼠和WT小鼠的血浆TG、TC和HDL水平没有显著差异(图2e)。此外,空腹血糖(FBG)、GTT和ITT表明HFD小鼠的胰岛素敏感性受损(图2c)。在HFD喂养的小鼠中,与WT小鼠相比Colgalt2−/−小鼠的FBG水平在11周后增加了13%(图2c)。GTT和ITT检测发现HFD小鼠的循环葡萄糖水平高于正常饲料喂养的小鼠,且在Colgalt2敲除小鼠中也明显增加(图2c)。
图2. HFD喂养的Colgalt2−/−小鼠增强肝脏脂肪变性和胰岛素抵抗
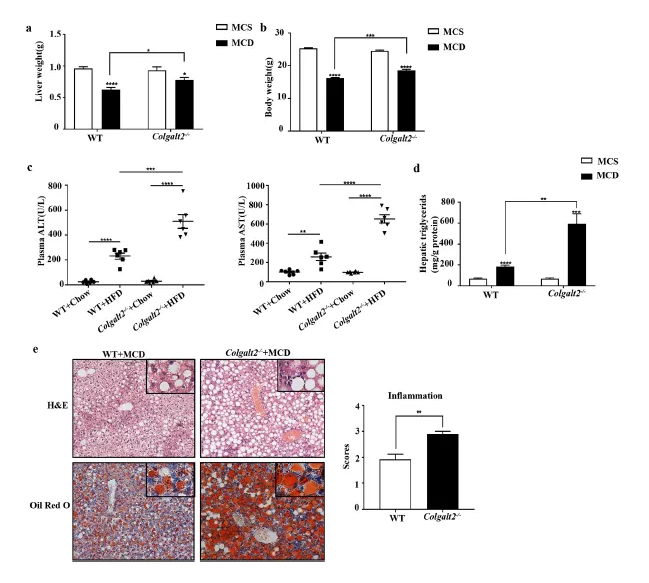
3、Colgalt2敲除增加MCD诱导的脂肪性肝炎
NASH是NAFLD疾病进展阶段。为了研究 Colgalt2对MCD诱导的脂肪性肝炎的影响,WT和Colgalt2−/−小鼠连续喂食MCD饮食3周。与WT小鼠相比,Colgalt2−/−小鼠的体重和肝脏重量增加(图3a和b)。在MCD喂养的小鼠中,Colgalt2−/−小鼠的ALT和AST血浆水平及AST均显著升高(图3 c)。H&E和油红O染色显示,MCD喂养的Colgalt2−/−小鼠的肝脏脂肪变性和炎症浸润比WT小鼠更严重(图3e)。与此同时,与WT小鼠相比,MCD喂养的Colgalt2−/−小鼠肝脏TG含量显著增加(图3d)。在MCD饮食组中,Colgalt2−/−小鼠的炎症评分明显高于WT小鼠(图3e)。
图3. Colgalt2缺乏加重MCD诱导的小鼠肝脂肪变性和脂肪性肝炎
4、Colgalt2敲除导致脂肪萎缩,降低小鼠血浆HMW脂联素和瘦素水平
脂联素对肝细胞有重要的抗脂肪变性作用。因此,为了检测Colgalt2对脂联素的影响,作者研究了脂联素在白色脂肪组织WAT中的表达、血浆总脂联素和HMW脂联素水平。出人意料的是,在Colgalt2缺陷的小鼠中观察到部分脂肪营养不良。与WT小鼠相比,Colgalt2−/−小鼠(6周龄)的eWAT体重降低(图4b)。此外,在HFD喂养16周后,Colgalt2敲除抑制小鼠的脂肪组织扩张,而在WT小鼠脂肪组织明显体积增大(图4b)。脂肪形成由复杂的转录因子网络(C/EBP家族成员,PPARγ,SREBP-1c等) 控制,这些因子在脂联素基因表达、代谢和其他脂肪特异性基因中发挥重要作用。在HFD喂养的Colgalt2−/−小鼠中,C/EBPα、C/EBPβ和脂肪生成标记物SREBP1a有降低趋势(图4d)。此外,在HFD喂养的Colgalt2−/−小鼠中,p-SREBP-1c和n-SREBP- 1c蛋白表达明显下调(图4e)。
接下来,作者检测了Colgalt2是否与脂联素的表达和HMW脂联素的血浆水平有关。HFD喂养16周后,WT小鼠eWAT组织中COLGALT2表达降低(图4d)。在eWAT中,HFD喂养的小鼠与喂食标准饲料的小鼠相比,脂联素蛋白表达降低(图4e)。然而,HFD喂养的Colgalt2−/−小鼠和WT小鼠的eWAT组织中脂联素mRNA和蛋白质表达没有显著差异(图4d和e)。同时结果显示,喂养正常饲料的Colgalt2−/−小鼠和WT小鼠的循环总脂联素没有显著差异(图4f)。为了明确脂肪组织中脂联素的分泌,分析了脂联素水平与eWAT质量的关系。结果显示Colgalt2缺失降低了HFD小鼠血浆总脂联素和HMW脂联素的水平(图4f)。此外,与标准饲料小鼠相比,饲喂HFD 16周的WT和Colgalt2−/−小鼠血浆中总脂联素或HMW脂联素水平与eWAT体重相关(图4f)。WAT分泌的脂联素和瘦素是介导糖脂代谢的脂肪因子;因此,测量了饲喂HFD的WT和Colgalt2−/−小鼠的血浆瘦素水平。结果显示,Colgalt2缺乏降低了小鼠高脂饮食喂养16周的血浆瘦蛋白水平。
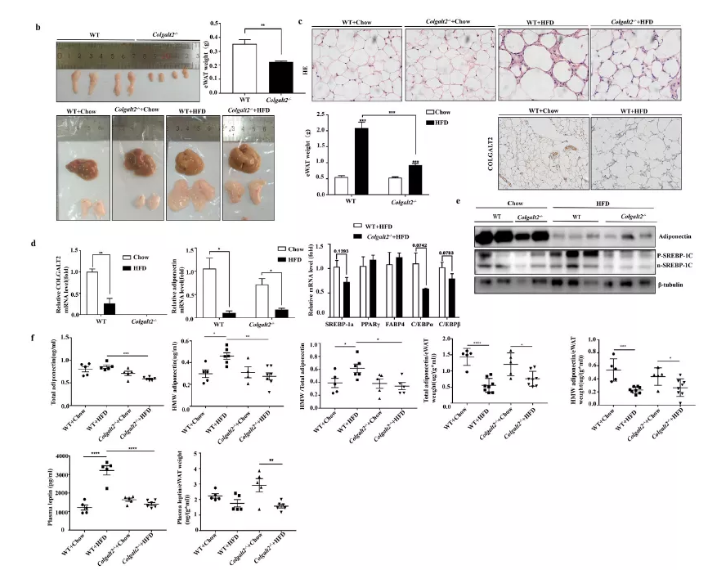 图4 Colgalt2敲除导致小鼠脂肪萎缩,降低血浆HMW 脂联素和瘦蛋白水平
图4 Colgalt2敲除导致小鼠脂肪萎缩,降低血浆HMW 脂联素和瘦蛋白水平
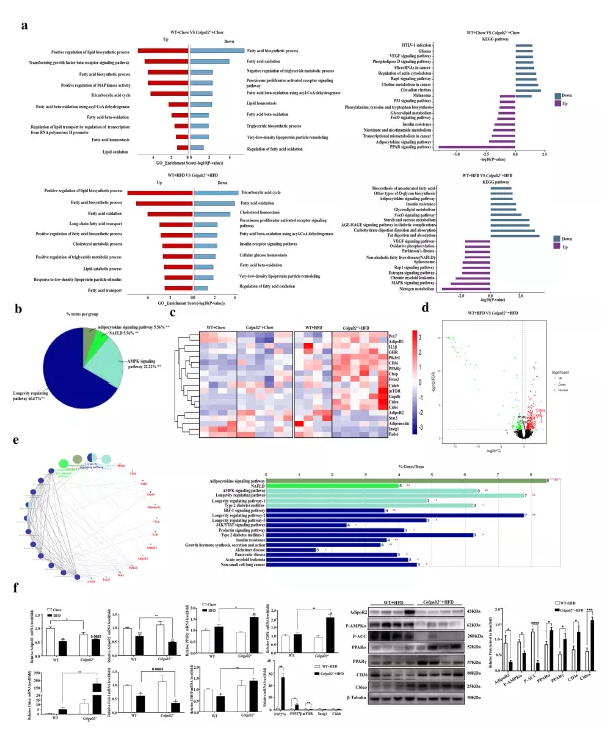
5、利用ONT全长转录组技术揭示脂联素/脂联素受体信号通路和脂肪生成基因机制
为了探索NAFLD中Colgalt2缺乏的潜在机制,作者对WT小鼠和饲喂HFD或标准饲料的Colgalt2−/−小鼠肝组织进行ONT全长转录组测序。结果显示,与WT小鼠相比,HFD喂养的Colgalt2−/−小鼠中有321个DEGs。为了明确DEGs的功能,分别对上调和下调的 DEGs进行KEGG通路富集分析(P < 0.05) (图5a)。对于上调的基因,KEGG分析显示这些差异表达基因显著富集于MAPK信号通路、NAFLD、和氧化磷酸化。下调的基因富集于脂肪消化和吸收、甘油脂代谢。在这些途径中,19个差异表达基因与脂代谢密切相关,包括adipoR1、adipoR2和脂质合成相关的分子,包括Cidea和Cidec (FSP27)、Cd36和PPARγ(图5c)。为了进一步研究这19个基因在这些通路中的作用,使用ClueGO和CluePedia工具解读这些通路网络(图5 d)。这些基因在AMPK信号通路、脂肪细胞因子信号通路和NAFLD等中富集(图5 b和e)。
与WT小鼠相比,HFD喂养的Colgalt2−/−小鼠的肝脏中AdipoR2 mRNA和蛋白表达水平分别下降到约70%和65%(图5f)。然而,与WT小鼠相比,标准饲料组肝脏的adipoR1 mRNA和蛋白表达水平低于HFD组的Colgalt2−/−小鼠(图5f)。接下来,研究了adipoR与AMPKα和PPARα信号通路相关的下游分子在肝脏中的变化。与WT小鼠相比,HFD喂养Colgalt2−/−小鼠肝脏中AMPKα激活和AMPKα磷酸化显著降低(图5f)。AMPKα通过ACC磷酸化抑制脂肪生成。与WT小鼠相比,HFD喂养的Colgalt2−/−小鼠肝脏中ACC的磷酸化显著降低(图5f)。在HFD喂养的Colgalt2−/−小鼠中PPARα的表达高于WT小鼠(图6f)。对肝脏组织的ONT全长转录组数据分析也显示,在Colgalt2−/−小鼠中脂肪生成基因表达上调。与HFD喂养的WT小鼠相比,HFD喂养的Colgalt2−/−小鼠的肝脏显示PPARγ、CD36、Cidea、FSP27α和FSP27β mRNA水平增加(图5f)。与WT小鼠相比,HFD喂养的Colgalt2−/−小鼠肝脏中脂质代谢相关的分子的蛋白水平均上调,包括PPARγ、CD36和Cidea(图5f)。
图5. WT和Colgalt2−/−小鼠肝脏组织ONT全长转录组数据分析结果
6、Colgalt2敲除下调脂肪形成相关转录因子在脂肪细胞分化过程中的表达
接下来,研究了Colgalt2是否会调控体外肝细胞中的脂质积累。在干扰COLGALT2的hepG2细胞和对照细胞中,用500 μM OA处理24 h后,COLGALT2降低,而rh-脂联素(500 ng/ml)处理显著提高了OA处理下COLGALT2的表达(图6a)。然而,干扰COLGALT2的hepG2细胞与对照组细胞在OA处理24 h后,TG含量没有显著差异(图6b)。
为了探究COLGALT2缺乏在脂肪萎缩中的作用, 在3T3-L1细胞中诱导了前脂肪细胞分化,从Colgalt2−/−和WT小鼠的eWAT中分离原代前脂肪细胞(图6d)。油红 O染色结果显示干扰Colgalt2降低了前脂肪细胞分化为脂肪细胞(图6e)。此外,干扰Colgalt2下调了脂肪前细胞向脂肪细胞分化过程中PPARγ的表达(图6e)。此外,从Colgalt2−/−和WT小鼠的eWAT中分离出原代前脂肪细胞,结果显示,Colgalt2敲除降低了PPARγ mRNA水平(图6d)。然而,来自Colgalt2−/−和WT小鼠的原代前脂肪细胞分化后,C/EBPα、C/EBPβ或SREBP-1c mRNA水平无显著差异。
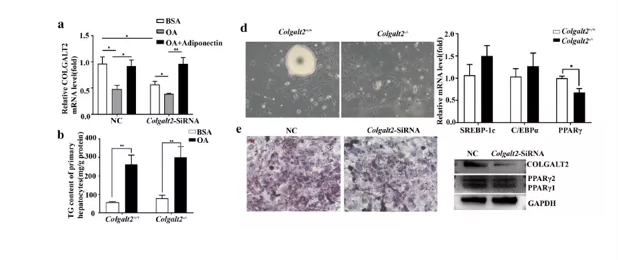
图6 Colgalt2缺乏抑制前脂肪细胞分化和脂肪形成相关转录因子的表达
总结
在本研究中,首次证实了Colgalt2缺乏抑制脂肪生成并导致脂肪萎缩减少脂联素分泌加重NAFLD。在体外,Colgalt2缺乏不直接影响肝细胞中TG的积累,但抑制脂肪细胞形成,减少脂肪分化过程中与脂肪形成相关的转录因子PPARγ的表达。Colgalt2缺乏降低血浆HMW和总脂联素水平,从而调节脂质代谢,这与脂联素受体及其下游AMPKα/ACC信号通路有关。这些数据可能为NAFLD发病机制提供了一个新的见解的思路。
文献下载:
https://international.biocloud.net/zh/article/detail/33865898
(复制链接到浏览器获取原文,如果没有云平台账号需要先注册)
往期阅读
【成功案例】四川大学华西医院利用ONT测序平台进行新冠病毒全基因组测序
【成功案例】中山眼科中心应用nanopore平台进行中国汉族人口结构变异研究
ONT全长转录组应用3:探索疾病发病新机制-精准治疗
ONT全长转录组文章写作宝典基础版
ONT全长转录组应用2:基因融合,轻松助你拿下CNS
ONT全长转录组应用1:可变剪切,轻松助你拿下CNS
ONT全长转录组测序揭示了精神疾病风险基因CACNA1C的复杂剪接特征
ONT全长转录组文章写作要点第一期
ONT全长转录组文章写作要点第二期
ONT全长转录组使慢淋转录本结构变异无所遁形







 京公网安备 11011302003368号
京公网安备 11011302003368号