1.1适用范围
本指南介绍百迈客平台单细胞产品的送样要求及制备方法,采集送样前请详细阅读。
1.2声明
我国法定的传染病分为三大类:甲类(一类)传染病包括霍乱和鼠疫;乙类(二类)传染病包括传染性非典肺炎、新型冠状病毒 (2019-nCoV)肺炎、艾滋病、病毒性肝炎、人感染高致病性禽流感、脊髓灰质炎、麻疹、流行性出血热、狂犬病、登革热、流行性乙型肝炎、细菌性和阿米巴性痢疾、肺结核、伤寒和副伤寒、炭疽、流行性脑脊髓膜炎、白喉、百日咳、新生儿破伤风、猩红热、布鲁士病、梅毒、淋病、钩端螺旋体病、血吸虫、疟疾。丙类(三类)传染病包括流行性感冒、流行性腮腺炎、流行性和地方性斑疹、伤寒、风疹、麻风病、急性出血性结膜炎、黑热病、丝虫病、包虫病、还有除了霍乱、细菌、阿米巴性痢疾、伤寒和副伤寒以外的感染性腹泻。
涉及上述传染病的科学研究需符合国家的相关规定,为严格遵守国家法律法规,本着对社会及相关操作人员负责的态度,我司要求客户方真实准确地提供样品的生物安全性信息,对样品是否含有上述感染性病原体进行事先说明。样品中含有上述感染性病原体时,客户方需要提供符合生物安全等级要求的实验室以便开展相关实验,实验进行时,客户方有义务协助我方实验员做好实验安全防护。客户方不得隐瞒样品的生物安全性信息,若出现样品含有感染性病原体而客户事先未告知我司的情况,一经发现我司将停止进行相关项目,已产生的费用由客户方承担。如因客户方提供的生物安全性信息不实、隐瞒样品感染性等有关情况等造成实验员及相关人员被感染、疾病传播等严重后果的,我司将按规定报告国家相关部门,并将通过法律等手段追究相关责任。
2.1送样量要求
目前百迈客单细胞产品包含:单细胞转录组、单细胞核转录组、单细胞免疫组库、单细胞ATAC,不同类型单细胞产品具体送样量要求如下表:
| 产品 | 样本类型 | 样本量要求 |
| 单细胞转录组、单细胞免疫组库 | 常规新鲜组织 | ≥200mg |
| 脊髓、皮质、脑胶质瘤 | ≥300mg | |
| 关节滑膜 | ≥400mg | |
| 冠状动脉、主动脉、椎间盘、脂肪、软骨、硬骨、坐骨神经 | ≥500mg | |
| 穿刺样本 | ≥3条 | |
| 外周血 | ≥3mL | |
| 脑脊液 | ≥10mL | |
| 腹水 | 5-10mL | |
| 肺泡灌洗液 | ≥50mL | |
| 流式分选细胞 | ≥5*105个 | |
| 原代/培养/冻存细胞 | ≥1*106个 | |
| 单细胞核转录组、单细胞ATAC | 组织 | ≥150mg(RNA提取另算) |
| 穿刺样本 | ≥3条(长度大于1 cm) | |
| 外周血 | ≥3mL | |
| 流式分选细胞 | ≥5*105个 | |
| 原代/培养/冻存细胞 | ≥1*106个 |
2.2样本质量要求
| 产品名称 | 质控标准 |
|
单细胞转录组 单细胞免疫组库 |
细胞总数:>5×105个; 活性:> 85%; 直径:<40μm; 体积:> 100μl; 浓度:700~1200 cell/μl; 结团率:<15%; 不含Ca2+、Mg2+ |
|
单细胞ATAC 单细胞核转录组 |
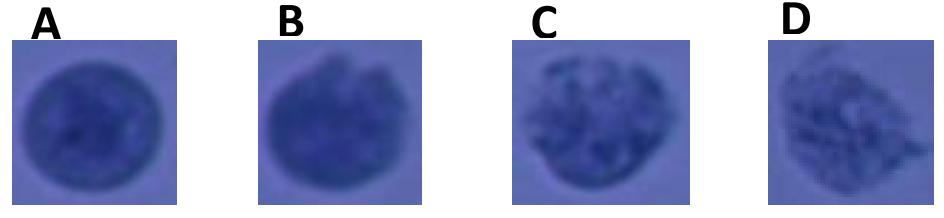
细胞总数:>5×105个(最少为1×105个); 细胞活性:<5%; 体积:> 100μl; 浓度:700~1200 nucleus/μl; 结团率:<10%; 核膜完整性:将细胞核分为 ABCD级,要求A级细胞核>80% |
3.1动物单细胞转录组/单细胞免疫组库
3.1.1 新鲜动物组织样本
1)采集前准备:
实验前分别提前24小时4℃预冷4个冰袋,-20℃预冷2个冰袋。
2)组织处理:
A.新鲜组织从活体取下,要求组织量至少为200mg(黄豆粒大小);
B.去除周围的脂肪、结缔组织或者坏死组织,用预冷的无菌PBS或者生理盐水清洗2遍,清洗掉血水等杂质;
C.将清洗干净的目标组织样本切割成5cm-1cm左右的组织块,尽量不超过1cm,保证组织块能够充分接触组织保存液,完全浸没在组织保存液中,快速转移到解离实验室进行单细胞悬液制备,或者寄送到百迈客实验室进行解离。
3)样本寄送与运输:
A.离心管用Parafilm 封口膜密封好,在每个样品管上清晰、简明地标记样品名称(采用质量较好的油性笔,并避免与乙醇等有机溶剂接触),样品名称请避免出现汉字,采用字母和数字表示,长度控制在8个字符以内;
B.样本管用气泡膜或纱布包裹,避免样品管直接接触冰袋而导致组织冰冻而坏死,请根据运输时间确认冰袋的数量,确保样本运输到达目的地时,样本温度保持在2-8℃。
4)注意事项:
A.取样时用无菌手术刀或剪刀进行取样,如必须用电刀取样请避免电刀灼烧部位,取样避免坏死部位,取样不能有血凝块;
B.公司承接样本及样本注意事项详情请见”单细胞(核)物种组织白名单”。
C.采样前可以提前联系百迈客当地销售经理获取组织保护液,由百迈客实验室寄送分装好的组织保存液(美天旎,货号130-100-008),组织保护液在2-8℃保存,不建议过多囤放以防滋生细菌,使用前观察试剂状态是否为无色透明液体,无沉淀、无异样;
D.组织在组织保护液中的最佳储存时间为48h,可维持组织样本的细胞活性及完整细胞表位,具体操作方法可参考《百迈客组织保存液寄样指南》视频,可以联系百迈客当地销售经理获取。

送样不规范示例:

A.样本没有纱布包裹,与冰袋直接接触,导致样本结冰,解离活率不足;
B.组织太多,占满整个管子,组织与保护液接触面积很少,使保护液无法有效的保持组织活性;
C.样本结冰,组织被完全冻住,解离活率很低;
D.未将管口包裹住,样本运输过程中管口打开,保护液和部分组织洒落在管外。
3.1.2 血液样本
1)样本采集:
A.采集新鲜外周血至少3mL,迅速置于EDTA抗凝管(紫色)中保存,取样完成后需要立即轻柔管上下颠倒采血管4-6次,保证EDTA抗凝效果;
B.4℃、24h内转移到实验室,分离PBMC后进行后续实验;
C.或者利用淋巴细胞分离液分选出外周血单核细胞PBMC(分选步骤可参考第3.2部分),加入细胞冻存液梯度冻存,具体操作见第3.1.3部分(推荐上门服务);
2)样本寄送与运输:
A.离心管用Parafilm 封口膜密封好,在每个样品管上清晰、简明地标记样品名称(采用质量较好的油性笔,并避免与乙醇等有机溶剂接触),样品名称请避免出现汉字,采用字母和数字表示,长度控制在8个字符以内;
B.样本管用气泡膜包裹,避免样品管直接接触冰袋而导致组织冰冻而坏死,请根据运输时间确认冰袋的数量,确保样本运输到达目的地时,样本温度保持在2-8℃。
3)注意事项:
A.取样前需要确认EDTA抗凝管在保质期范围内,只能用EDTA紫色抗凝管;
B.百迈客可以提供PBMC分离服务;
C.血液离体时间不超过24h。
3.1.3 PBMC/细胞悬液样本
PBMC样本与细胞悬液样本,如果没有预约上门服务,需要按细胞梯度冻存的方式冻存起来,干冰寄送,细胞梯度冻存操作步骤如下:
A.冻存前准备:提前30min从-80℃冰箱取出梯度降温盒并恢复至室温备用;
B.准备好900μL血清+100μL DMSO的细胞冻存液;
C.收集PBMC或细胞,用预冷的无菌PBS清洗1-2遍,将配好的冻存液进行细胞重悬;
D.将重悬好的细胞悬液分装到细胞冻存管中,并在冻存管侧壁做好标记;
E.将冻存管放入梯度降温盒中,放入-80℃冰箱,冻存的细胞在梯度降温盒中放置24h后可取出放置在液氮保存,或者直接放置在干冰上进行冷冻运输,寄送到百迈客实验室。
3.1.4 穿刺样本
1)样本采集:对于穿刺样本,在采集样本过程中,使用粗针(穿刺针管外径≥1.2mm)穿刺采集3条样本。
2)注意事项:
A.组织处理、样本寄送与运输参考第1.1部分;
B.采集时需注意的是不能用真空针采样;
C.穿刺样品量较少,建议送样量≥3条,通过增加穿刺样本数可以提高成功率。
3.2 动物单细胞核转录组/单细胞ATAC
3.2.1 冷冻组织样品
1)样本采集与寄送:
A.新鲜组织从活体取下,要求组织量至少为250mg;
B.去除周围的脂肪、结缔组织或者坏死组织,用预冷的无菌PBS或者生理盐水清洗2遍,清洗掉血水等杂质,并用纱布或无尘纸擦干组织表面水分;
C.将清洗干净的目标组织样本切割成5cm-1cm左右的组织块,尽量不超过1cm,组织分成两份,一份150mg,一份100mg并做区分标记,分别转入两个冻存管中,150mg提取细胞核,100mg提取质检RNA(要求 RIN≥6.0);
D.立即液氮速冻30min以上,再转移到-80℃保存或干冰寄送,确保组织寄送到实验室后为冷冻状态。
2)注意事项:
心脏、肌肉、皮肤、肺癌、子宫、病变纤维化和器官硬化类组织,提核后会产生较多的碎片,需要进行流式分选去碎片;如果涉及到以上样本,请送样前提前告知,以便开始提核实验前预约好流式细胞仪,以免耽误实验进度。
3.2.2 冻存细胞样本
1)冻存前细胞质检:冻存前对细胞质量进行检测,要求细胞活性大于90%、细胞结团率小于 10%,样品无细胞碎片等杂质;原代细胞或培养细胞总数大于1×106个,流式分选细胞大于5×105个,并提供质检结果。
2)细胞梯度冻存:
A.冻存前准备:提前30min从-80℃冰箱取出梯度降温盒并恢复至室温备用;
B.准备好900μL血清+100μL DMSO的细胞冻存液;
C.收集PBMC或细胞,用预冷的无菌PBS清洗1-2遍,将配好的冻存液进行细胞重悬;
D.将重悬好的细胞悬液分装到细胞冻存管中,并在冻存管侧壁做好标记;
E.将冻存管放入梯度降温盒中,放入-80℃冰箱,冻存的细胞在梯度降温盒中放置24h后可取出放置在液氮保存,或者直接放置在干冰上进行冷冻运输,寄送到百迈客实验室。
3.2.3 其他类
血液样本参考第3.1.2部分,PBMC/细胞悬液样本参考第3.1.3部分,推荐直接上门服务。
3.3 植物单细胞核转录组
3.3.1 新鲜植物组织样品
1)活体植株(优先推荐)
A.幼嫩植株:种子培育的低龄幼苗(7-14 天)、组培苗——叶片、幼嫩茎、茎尖、根尖;
B.成熟植株:茎尖组织及靠近茎尖的第 1-2片幼嫩叶片、发育中的花或者花序;
C.取样量:保证每一个单细胞核转录组文库的理论用量 0.5-2g;
D.其它:特殊贵重活体样品需要客户提供样品的种植、保存条件(温度、光照、营养液、浇水条件、PH 等等),以保证样品的正常生长;
E.每一个根部保留少量土壤,利用锡箔纸或者塑料薄膜将植株根部包裹起来, 植株部分需要利用小铁环或者丝带缠绕,保证枝条茎叶不分散,但不需要捆绑非常紧实,防止机械对茎枝叶的损伤。
F.外面用纸箱或者泡沫包裹,防止植株碰撞,并用塑料薄膜缠绕固定。
G.一般活体植株常温运输培养,如果有特殊培养条件(需要做相应的处理,例如,低温用冰袋运输,冰袋与密封袋之间放置泡沫板)。
2)离体枝条
A.枝条选择:枝条顶端有待萌发叶芽,且叶芽周边有几片幼叶;枝条中下端保留部分成熟叶片;
B.枝条预处理:剪断枝条,自底端往上约5cm 用浸透水的吸水纸包裹好,放入自封袋,袋中喷水,填充部分空气,密封袋口;
C.枝条运输:自封袋放入泡沫箱,箱体内侧壁放部分冰袋(保证低温运输),冰袋与自封袋间放置泡沫板,防止冰袋积压样品或因冰袋与样品直接接触导致样品被冻伤;
D.运输时间:保证24 h内到样,最多不得超过48 h;
E.取样量:保证每一个单细胞核转录组文库的理论用量 0.5-2g;
F.其它:取“离体枝条”仅限比较难以获得幼嫩活体植株的项目,如野外采样、植株过大等导致的取样或运输比较困难的项目;离体枝条到样后如有损伤等将不再用于实验;离体枝条如果保存、运输不善会存在部分潜在风险:即得到的实验效果可能会比活体植株检测结果稍差(理论上的潜在风险)。
3)注意事项
A.建议一次送样量≥2g;
B.所有待取的幼嫩组织长势必须正常(无病虫害、无营养缺失);
C.对于需要保留茎尖的特殊情况,取样时不取茎尖组织,只取紧靠近茎尖的第 1-2 片嫩叶;
D.部分植物单细胞核项目(物种及组织类型在我司白名单之外)在正式启动前会进行预实验以判断能否顺利开展正式实验,故活体样本送样时应保证至少3天的启动延时(即活体样本到样后需等待3天至预实验合格后方能正式启动样本,如对时期要求严格的样本需格外注意),送样前可与我司沟通确认具体情况。

白菜植株

打包后的白菜植株
3.3.2 冷冻组织样品
1)样本采集与寄送:
A.新鲜组织从活体取下,要求组织量至少为700 mg;
B.去除周围的非目标组织,用预冷的无菌PBS或者生理盐水清洗2遍,清洗掉杂质;
C.将清洗干净的目标组织样本切割成0.5cm-1cm左右的组织块,尽量不超过1cm,剪切成约0.5 cm,不足0.5 cm的从中间切开即可;
D.将组织分成两份,一份600mg,一份100mg并做区分标记,其中600 mg用来提取细胞核,100 mg用来提取 RNA(要求 RIN≥7.0);
E.立即液氮速冻30min以上,再转移到-80℃保存或干冰寄送,确保组织寄送到实验室后为冷冻状态。
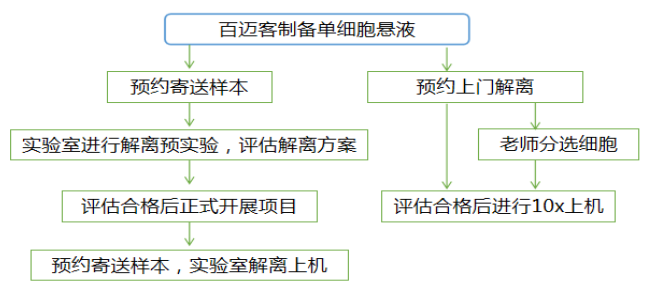
图1 百迈客单细胞测序服务流程
4.1 悬液制备方案评估
由于不同物种和组织类型的解离条件差异较大,百迈客提供单细胞悬液制备预实验服务,会对目标组织类型的单细胞悬液制备方案进行评估。提前预约好样本寄送时间,保证到样后尽快开展单细胞悬液制备实验,组织冻存液寄送样本最好在48h内完成解离;确定好细胞悬液制备方案后,即可正式开展项目。
4.2 正式实验
目前百迈客提供两种类型的正式实验服务模式:
4.2.1 上门服务
老师只需提供组织样本,预约上门后实验工程师上门,按照预实验评估的解离方案进行解离、单细胞分选上机、反转录成cDNA后低温暂存,后续在百迈客实验室完成建库测序。
或者老师完成单细胞悬液制备实验,实验工程师进行单细胞悬液质量评估,评估合格后进行后续实验操作,单细胞质量要求见第2.2部分。
备注:单细胞悬液制备好后,建议在30分钟内质检上机,建议老师提前安排好时间;仪器设备要求详情见第4.3.3部分。
4.2.2 组织寄送
百迈客单细胞组织保存液寄送方式(推荐),采用组织保存液储存组织样本,既可以保持样本最原始组织活性状态,又可以解决样本难以获取以及批次性效应等问题,老师寄送组织到百迈客实验室,实验工程师进行解离、单细胞分选上机、反转录、建库、测序。
注意事项
- 根据组织类型选择服务模式:适用于组织保存液寄送的组织推荐组织,寄送,其他不适用寄送的组织类型、细胞、血液样本推荐上门服务;
- 一些特殊样本由于组织结构、细胞大小等限制,在不适用单细胞转录组测序的情况下,可以进行单细胞核转录组测序。
| 细胞类型 | 说明 |
| 神经元细胞 | 4~120µm,常见星形、锥体形、梨形和圆球形状,长突起细胞 |
| 巨噬细胞 | ~50µm, 多突起的星形细胞 |
| 皮下脂肪细胞 | 60~120µm,粒径过大 |
| 心肌细胞 | 3~100µm,类型复杂非规则球形,移行细胞细长型,特别心肌肿大时细胞粒径会达100µm |
| 肾脏细胞 | 系膜细胞、内皮细胞、上皮细胞(足细胞)、肾小管上皮细胞,类型复杂,足细胞丰度低 |
| 骨骼肌纤维 | 长柱形的多核细胞,长1~40mm,直径10~100μm |
| 卵细胞 | >0.1mm,成熟卵泡直径18-25mm |
4.2.3 仪器耗材清单
| 设备及描述 | 仪器要求 | 用途 |
| 冰箱 | -80℃、-20℃ | 暂存试剂 |
| 4℃水平离心机* | 支持1.5ml/15ml离心管 | 解离液分离;细胞收集 |
| 制冰机和冰盒 | — | 解离中提供低温环境 |
| PCR仪* | 支持100 µL反应体系;热盖温度可调节 | 用于反转录反应 |
| 漩涡振荡器* | — | 混匀试剂 |
| 微型离心机* | 兼容0.2mL、八连排和1.5mL 离心管 | 瞬时离心 |
| 震荡水浴锅* | 37℃恒温 | 酶解离组织 |
| 生物安全柜 | 无菌环境 | 组织解离 |
| 光学显微镜 | 至少200x | 观察形态 |
| 75%乙醇 | 如果是无水乙醇,同时准备去离子水 | 消毒 |
| 无尘纸 | — | — |
| 手术剪刀 | ~10cm | 剪碎组织 |
| 手术镊子 | ~15cm | 夹取/转移组织 |
| 无酶吸头 | 1mL/200uL/10uL多种规格无酶吸头 | — |
| 离心管架 | 可放置15ml、50ml离心管 | 放置离心管 |
| 离心管 | 0.2/1.5/ 2.0/15/ 50 mL灭菌离心管 | — |
注意事项:
1)标记*的设备需放置在同一房间;
2)实验台大小要求能满足两名实验员操作;
3)三孔仪器电源插座大于3 个;
4)生物安全柜可用常规实验台代替。
4.3 风险提示与评估
1)组织保存液寄送样本尽量保证48h内寄送到实验室开展实验,时间过长会影响细胞活率及细胞表达状态;
2)单细胞核转录组组织样本一定要备份进行质检(RIN值≥6.0),RNA完整性会影响数据结果;
3)细胞活率低于85%,可能引起mRNA部分降解导致基因检出减少,细胞内线粒体基因比例偏高,占用有效数据量;
4)细胞直径<40 μm(10x)或<60 μm(DG)细胞过大容易堵塞芯片,无法形成油包水,过大的细胞利用细胞筛过滤;
5)细胞结团<15%,组织解离不充分,会看到细胞悬液中2个或多个细胞粘连在一起的情况,可能会导致最终数据中双细胞占比偏多,占用有效数据量,结团过高还可能会堵塞芯片,无法形成油包水;
6)解离过程中可能由于解离条件过于剧烈而产生大量碎片,可能会导致背景噪音高,占用有效数据量,也会引起有效细胞数偏离预期。







 京公网安备 11011302003368号
京公网安备 11011302003368号