2021年5月,百迈客和暨南大学第一附属医院合作的文章“The SNAG Domain of Insm1 Regulates Pancreatic Endocrine Cell Differentiation and Represses β- to δ-Cell Transdifferentiation”见刊啦!发表在《Diabetes》(IF=9.464)。今天小编带大家一起解读一下该文章,看看具体做了些什么研究!
本文转录组测序由百迈客协助完成。百迈客转录调控产品不仅有本文所用的二代转录组测序产品,还有Nanopore三代转录组测序哦!在对基因和转录组开展定量研究的同时,可以关注基因结构的分析,包括可变剪切、APA、融合基因等等。同时还承接Direct RNA测序,在以上结果的基础上,看看RNA修饰也是真真好的呢!感兴趣的老师,可以留言或者直接联系当地销售咨询。

英文题目:The SNAG Domain of Insm1 Regulates Pancreatic Endocrine Cell Differentiation and Represses β- to δ-Cell Transdifferentiation
中文题目:Insm1 的 SNAG 域调节胰腺内分泌细胞分化并抑制β细胞转分化为δ细胞
发表杂志:Diabetes
影响因子:9.464
发表时间:2021年5月
合作单位:暨南大学第一附属医院
胰腺内分泌系统受转录因子的严格调控,系统失调引起各种代谢疾病的发生,包括糖尿病。胰岛素瘤相关蛋白 1 ( Insm1)编码一种包含有一个 SNAG 结构域和五个锌指结构的蛋白质,并在胰腺内分泌细胞分化和成熟 β 细胞功能中起重要作用。
在本研究中,比较了 Insm1 null 和 Insm1 SNAG 域突变体 (Insm1delSNAG) 之间胰腺内分泌细胞的分化,以研究Insm1 SNAG 域的特定功能。结果表明与对照小鼠相比,Insm1delSNAG 中δ细胞数量增加,而Insm1 null突变体中却没有增加;同时Insm1delSNAG 中β细胞数量的减少不像在Insm1 null突变体中那样严重。此外,在 Insm1delSNAG 和 Insm1 null突变体的α-、PP(胰多肽)和ε细胞中观察到类似的细胞数减少现象。本研究进一步明确δ细胞数量的增加是因为β细胞转分化为δ细胞。从机制上来说,Insm1 的 SNAG 结构域与 Lsd1(H3K4me1/2 的去甲基化酶)相互作用。Insm1 的 SNAG域中的突变导致 Lsd1 的募集受损,并增加了与 Insm1 结合的造血表达同源盒(Hhex)位点中H3K4me1/2的水平,从而提升δ细胞特异性基因Hhex的转录活性。本研究已经确定了Insm1的SNAG域在调节胰腺内分泌细胞分化中的新功能,特别是在抑制β细胞转分化为δ细胞。
实验设计
材料:Insm1delSNAG突变小鼠(Insm1delSNAG/lacZ)),Insm1非突变小鼠(Insm1lacZ/lacZ);杂合对照小鼠(Insm1+/lacZ)。β细胞敲除小鼠(InsCre;Insm1f/delSNAG; CKO),Cre杂合对照小鼠(InsCre;Insm1f/+);Cre对照小鼠(InsCre;Insm1+/+)
RNA-seq样本:取E18.5时胰腺,每种基因型4个重复:Insm1+/lacZ (control),Insm1lacZ/lacZ (Insm1 null), 和Insm1delSNAG/lacZ (Insm1del-SNAG)。
实验技术: 免疫荧光分析,RNA-seq(转录组测序由百迈客协助完成),免疫沉淀、WB和ChIP-PCR验证。
测序平台: Illumina NovaSeq 6000
文章结果
1、Insm1 SNAG域改变了突变小鼠胰腺内分泌系统的分化
本研究的目的是确定Insm1的SNAG域在胰腺内分泌细胞的发育中的特异功能。特别是分析了Insm1delSNAG/lacZ(Insm1delSNA突变体),Insm1lacZ/lacZ (Insm1 null突变体)和Insm1+/lacZ(对照) 同窝出生小鼠胚胎的免疫荧光。
通过β-gal(lacZ等位基因的表达)染色,观察到Insm1delSNAG突变体的胰腺在E18.5时胰岛素阳性β细胞数量减少,但是没有像Insm1 null突变小鼠中那么严重(图1A–A”’)。与对照相比,在Insm1delSNAG或Insm1中没有观察到α细胞数有变化(图1B)。同时发现和对照相比,在Insm1delSNAG和Insm1-null突变体中观察到PP数量的增加和δ细胞的减少(图1D和E)。然而与对照小鼠相比,Insm1delSNAG突变体中生长抑素阳性的δ细胞数量显著增加,且在Insm1-null突变体中细胞数减少了(图1C–C”)。
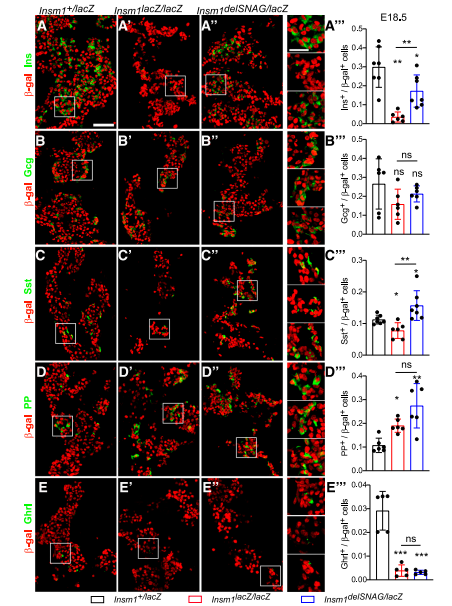
图1.Insm1delSANG突变小鼠在E18.5时胰腺内分泌细胞分化受损
为了确认这些减少现象是否发生在早期发育阶段(即E15.5),检测了胰腺E15.5的内分泌系统。结果与对照相比,Insm1delSNAG和Insm1-null突变体中在观察到一个类似的减少现象,包括胰岛素,胰高血糖素,PP-和饥饿素阳性细胞(图2)。然而,生长抑素阳性细胞的数量在Insm1delSNAG或Insm1-null突变体中都没有发生改变(图2C–C”)。因此,Insm1delSNAG突变体中δ细胞数量的增加发生在E18.5,而不在E15.5。
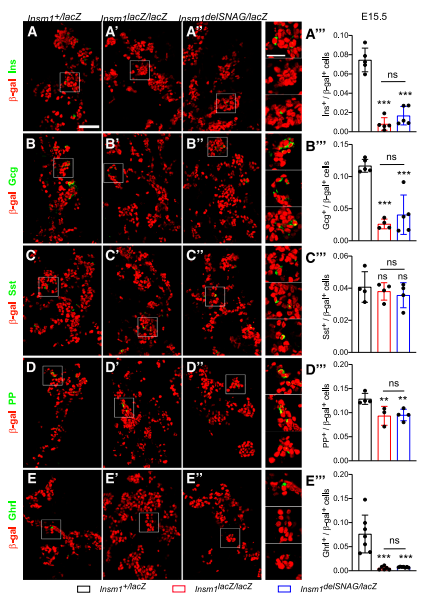
图2.Insm1delSANG突变小鼠在E15.5时胰腺内分泌细胞分化受损
接下来研究了Insm1delSNAG突变体中的胰岛特异性转录因子的表达。将野生型和杂合子作为对照,检测与Insm1结合的转录因子SMAFA、MafB、Pdx1、Pax6、Ngn3和Isl1/2(图3和4)。在E18.5(图3A–C)和E15.5(图4A–C)时,与野生型或者杂合对照相比,Insm1delSNAG突变体的胰岛中MafA和MafB表达显著降低,Pdx1表达轻度下降。Pax6的表达在E18.5时降低,但是在E15.5时只有轻微变化(图3D和图4D)。Isl1/2和内分泌细胞前体细胞标记物Ngn3在两个阶段均无变化(图3E、F和4E、F)。因此,Insm1delSNAG突变导致α-和β-特异性转录因子表达降低,而不是前体细胞或泛胰岛因子。
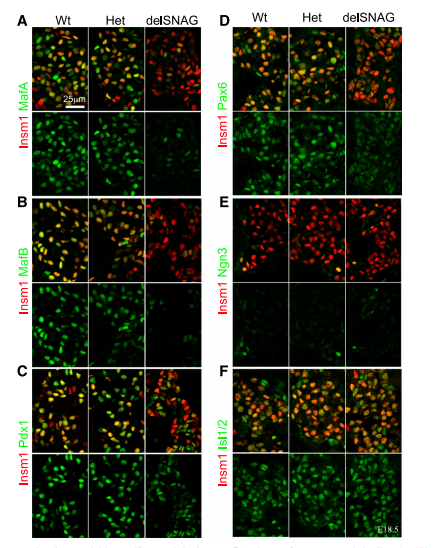
图3. E18.5时胰岛特异性转录因子的表达

图4. E15.5时胰岛特异性转录因子的表达
2、Insm1delSNAG突变体的胰腺中的基因表达
选用E18.5时Insm1delSNAG,Insm1 null和对照组小鼠的胰腺,利用RNA-seq研究Insm1delSNAG突变体胰脏内的特异性基因表达。分析发现在Insm1delSNAG突变体胰腺中,共有231个基因显著失调,这些基因涉及发育和激素分泌方面。同时发现Insm1delSNAG和null 突变有显著的差异基因交集,尤其是编码激素的基因和与葡萄糖代谢和分泌调节相关的基因(图5A、B)。Insm1delSNAG突变体中大约72.7%的差异基因也在Insm1 null突变体中被检测到。然而与Insm1delSNAG突变体相比,Insm1 null突变体中有着更多的基因表达和数量上的变化。这些结果与在Insm1delSNAG突变体中发现比Insm1null突变体中β细胞更少这一现象一致。
对比对照组或Insm1 null突变小鼠,在Insm1delSNAG突变小鼠中δ细胞特异性基因生长抑素(Sst)、Hhex和视黄醇结合蛋白4 (Rbp4)基因在胰腺中上调(图5C)。这与免疫染色观察到δ细胞数量的增加这一发现一致。大多数失调基因已通过实时RT-PCR被验证(图5D)。
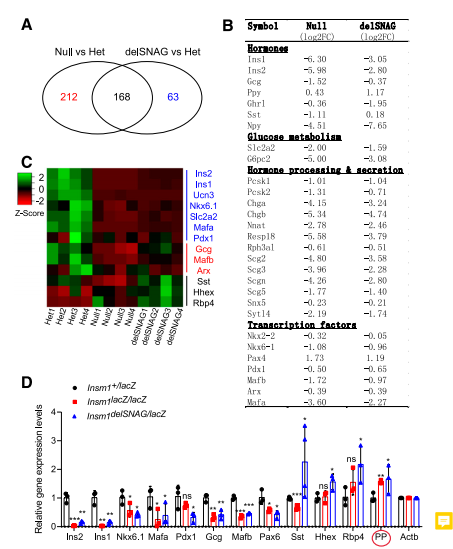
图5.InsmdelSNAG突变小鼠胰腺的基因表达
3、β细胞向δ细胞的转分化
前面数据分析发现Insm1delSNAG突变体在E15.5之后δ细胞数量增加(图1C和2C),为了验证细胞数的增加是否是δ细胞增殖促成的,该研究在E15.5和E18.5时的Insm1delSNAG突变小鼠中进行了Ki67和生长抑素的共染色。在δ细胞中观察到类似的增殖率,增殖率通过对照和Insm1 null或Insm1delSNAG突变体中Ki67+Sst+/Sst+的比值来表示。同时也检测了Insm1delSNAG突变体中δ细胞低凋亡率的可能性,是否是导致细胞数量差异的原因。然而Insm1delSNAG、Insm1 null突变体和对照小鼠中生长抑素阳性细胞率极低,并无差异。
生长抑素和胰岛素或胰高血糖素的复合染色很少被观察到,且在Insm1delSNAG突变体和对照小鼠之间没有发现差异。但是在E15.5和E18.5时Insm1delSNAG突变体中,检测到Sst和β细胞特异性转录因子Nkx6.1的复合染色信号增强(图6A、B)。Sst与Nkx6.1的共表达表明Insm1delSNAG中δ细胞有可能会从β细胞转化而来。
因此,使用了InsCre;Insm1delSNAG/flox (CKO)小鼠研究动物模型中δ细胞的数量是否增加,并带有β细胞特异性SNAG突变。在新生CKO小鼠的胰腺中观察到δ细胞数量显著增加(图7A)。说明具有β细胞特异性的Insm1delSNAG突变导致δ细胞数增加。进一步使用具有β细胞特异性小鼠模型mTmG;InsCre;Insm1delSNAG/flox (tracing-CKO)验证β细胞向δ细胞的转分化。利用GFP追踪Insm1delSNAG突变的β细胞,在具有β细胞特异性的insm1delsnag突变体胰腺中发现与Sst共染色的GFP信号增强,但在对照组mTmG;InsCre;Insm1+/flox小鼠中显著减轻(图7 B)。结果说明β细胞向δ细胞转分化发生于Insm1delSNAG突变的胰腺β细胞。
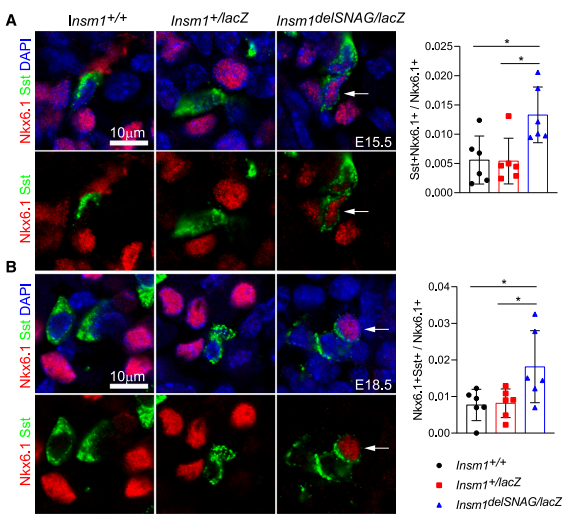
图6.β细胞中Nkx6.1+Sst+细胞数增多
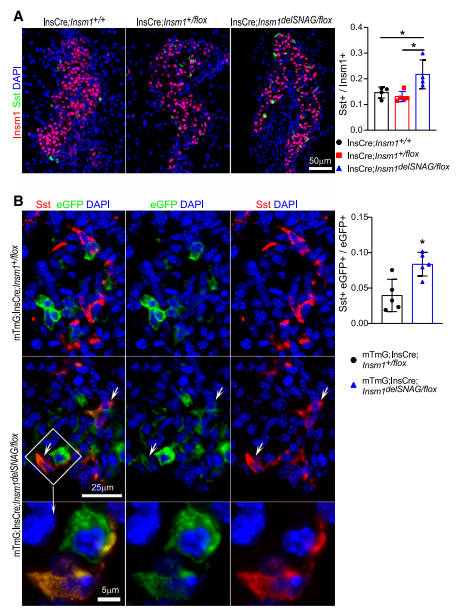
图7.Insm1delSNAG突变小鼠中β细胞向δ细胞转分化
4、Insm1delSNAG突变改变了Insm1和Lsd1之间的交互作用
为了进一步阐明Insm1的SNAG结构域的分子功能,本研究通过免疫共沉淀法检测与Insm1delSNAG相互作用的蛋白。本文检测到Lsd1无法在转染Insm1del-SNAG-Flag的SJb b细胞中被Flag抗体拉下来(图8A)。这一结果与先前对垂体细胞的观察结果一致。Insm1可以在胰腺β细胞中与NeuroD1和FoxA2互相作用。因此使用NeuroD1和FoxA2抗体在含有Insm1delSNAG-Flag或Insm1-Flag蛋白同一细胞裂解液中进行免疫共沉淀,观察到Insm1的SNAG域突变并没有阻止Insm1与NeuroD1或FoxA2之间的相互作用(图8A)。因此,Insm1delSNAG突变破坏了Insm1与Lsd1之间的相互作用,但不破坏Insm1与NeuroD1或FoxA2之间的相互作用。
在胰腺β细胞系中进行的ChIP-seq数据分析显示,Insm1可以结合在基因内含子和下游18kb的Hhex位点(图8B),在这些结合位点周围有一个H3K4me1富集区(图8B,上图)。这些特征在胰外分泌细胞特异性基因Amy1的位点上并没有观察到(图8B,下图)。利用Insm1和Lsd1的抗体通过ChIP-PCR验证Insm1招募的Lsd1的特异性DNA结合位点,结果观察到与Amy1位点相比,Lsd1在Insm1结合位点,Hhex1的内含子和下游18kb区域富集,同时Insm1突变体SJb细胞中Lsd1的这两个结合位点富集减少(图8C和D)。Lsd1特别表现出组蛋白修饰H3K4me2和H3K4me1的去甲基化酶活性。
利用H3K4me1和H3K4me2的抗体在对照和Insm1delSNAG突变体的胰岛中进行ChIP-PCR,研究Insm1SNAG-Lsd1是否调控H3K4me1和H3K4me2两种组蛋白修饰。结果检测到相比野生型胰岛,在Insm1delSNAG突变体的胰岛中,H3K4me2在Hhex基因的内含子和18 kb下游位点,以及H3K4me1在Hhex的18 kb下游位点有着显著富集(图8E和F)。SNAG突变扰乱了Insm1募集Lsd1的结合位点,导致H3K4me1/H3K4me2水平增加,特别是δ细胞特异性基因Hhex。
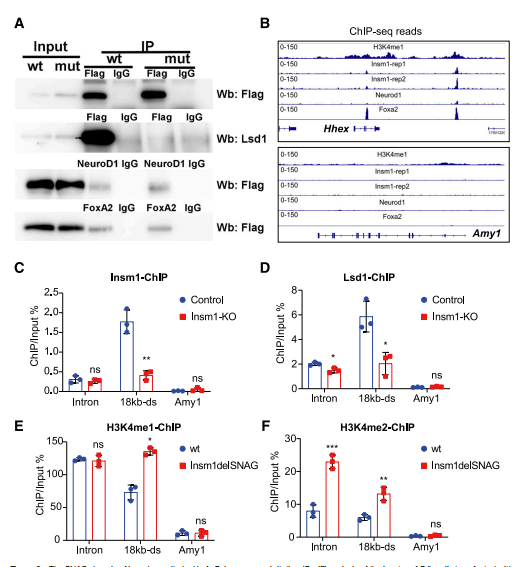
图8. Insm1的SNAG结构域招募Lsd1
总结
在目前的研究中发现与Insm1null突变相比,Insm1的SNAG结构域在α、PP和ε细胞中导致发育缺陷,但在β细胞中没有那么严重。Insm1的SNAG突变破坏Insm1和Lsd1之间的相互作用。然而,Insm1-NeuroD1或Insm1-FoxA2的互相作用得以保留。NeuroD1和FoxA2在胰腺β细胞发育中起重要作用;Insm1delSNAG与这些因子之间相互作用的维持部分解释了Insm1delSNAG突变小鼠β细胞发育缺陷相对于Insm1null突变小鼠不那么严重的原因。研究证明了Insm1的SNAG域的突变导致β转分化为δ细胞。同时发现Insm1的SNAG结构域与Lsd1相互作用并将其吸附到DNA上。突变的SNAG结构域阻断Lsd1的募集,导致δ细胞特异性基因Hhex位点的H3K4me1和H3K4me2水平升高。
本文结论:在胰腺β细胞发育过程中,Insm1部分通过招募β细胞来抑制δ细胞命运Lsd1通过它的SNAG域。然而,考虑到Lsd1可以以时间和细胞依赖性的方式进一步招募各种组蛋白修饰复合物,我们所确定的分子机制可能只揭示了部分调控场景。综上所述,研究证明了Insm1对于所有胰腺内分泌细胞的分化至关重要,特别是对抑制β转分化为δ细胞。








 京公网安备 11011302003368号
京公网安备 11011302003368号