今天小编给大家分享一篇宏基因组和代谢组联合分析在糖尿病研究中的应用,本研究通过宏基因组和代谢组技术比较了健康人群和2型糖尿病患者中的瘦人和腹部肥胖参与者的肠道微生物群,研究结果表明艾克曼氏菌干预可能成为改善胰岛素分泌和维持糖稳态的潜在途径,为2型糖尿病的治疗提供了新方向。百迈客微生物产品部具有多年宏基因组研究经验,针对不同类型的样本均具有丰富的实验经验,对于提取困难样本还研发了微量建库技术(“无偏差”宏基因组微量建库:难提取样本的福音),此外宏基因组APP还提供40余项免费个性化分析内容,同时与代谢组多组学联合分析全新升级,包含普氏分析、相关性分析、随机森林等多项内容,为您提供全面的肠道菌群研究方案,欢迎各位老师前来咨询!
前言
肥胖是2型糖尿病的重要危险因素,流行病学研究表明约70-80%的糖尿病患者肥胖,然而,尚有一部分的2型糖尿病患者体型偏瘦。与肥胖的2型糖尿病患者相比,体型偏瘦的2型糖尿病患者的胰岛功能往往更差。既往研究发现,相比健康人群,2型糖尿病或肥胖人群的肠道菌群及代谢物具有组成和功能上的改变。然而,体型偏瘦的2型糖尿病患者相比合并肥胖的2型糖尿病患者,其肠道菌群和代谢物的改变有何不同?其肠道菌群和代谢物如何影响临床表型尚不清楚。本研究通过宏基因组和代谢组技术比较了健康人群和2型糖尿病患者中的瘦人和腹部肥胖参与者的肠道微生物群,以确定肠道微生物群的差异是否可以解释有2型糖尿病的瘦人的特定临床特征。
英文标题:Decreased Abundance of Akkermansia muciniphila Leads to the Impairment of Insulin Secretion and Glucose Homeostasis in Lean Type 2 Diabetes
中文标题:阿克曼菌的丰度减少导致瘦型2型糖尿病患者的胰岛素分泌和葡萄糖稳态受损
发表时间:2021年6月
发表期刊:Advanced Science
影响因子:16.806
材料与方法
研究结果
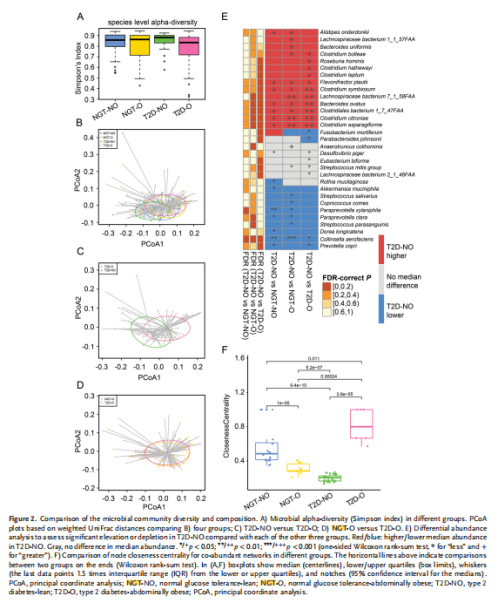
图注:微生物群落多样性及组成比较
2、A. muciniphila 丰度在T2D-NO中减少并且与胰岛素分泌呈正相关
肠道微生物种类与体重相关指标和葡萄糖代谢之间的密切关系。细菌 A. muciniphila是一种可以缓解肥胖的益生菌。在 T2D-NO 中显着低于 NGT-NO 组(图 3B,p < 0.05,Wilcoxon 秩和检验),但在 T2D-O 和 NGT-O 组之间没有显着差异。此外,A. muciniphila 与此处测量的所有胰岛素分泌相关指标呈正相关(HOMA-%B,第 1 个 PH,第 2 个 PH)(图 3C-E))。此外,存在 A. muciniphila 的样本中的三种胰岛素分泌量显着高于不存在 A. muciniphila 的样本(图 3F),进一步支持肠道中 A. muciniphila 与胰岛素分泌之间的潜在关联。在其他组的相关分析中未观察到 A. muciniphila 和胰岛素分泌之间的这种正相关。未发现 A. muciniphila 与胰岛素敏感性(胰岛素抵抗的稳态模型评估 (HOMA-IR) 和 Cederholm 指数 (ISICederholm))之间存在显着关联(图 3A)。
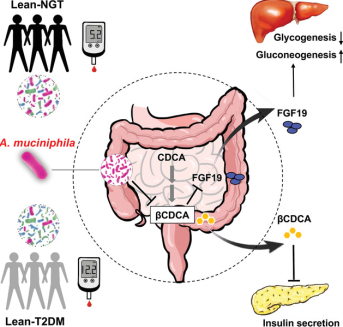
通过对βCDCA对胰岛素分泌的可能作用的研究发现,A. muciniphila 可能通过降低肠道中βCDCA 的水平来刺激胰岛素分泌。
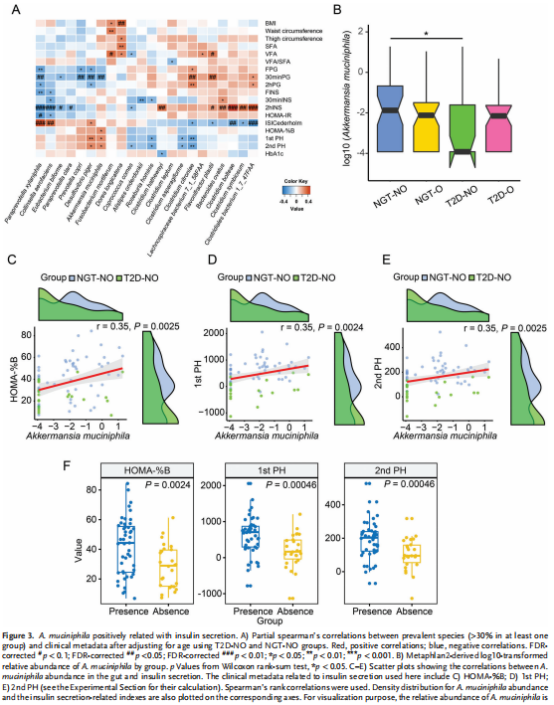
图注:A. muciniphila与胰岛素分泌呈正相关
3、A. muciniphila 治疗可降低βCDCA水平并增强FGF15/19
实验结果表明, A. muciniphila 治疗显着降低了 βCDCA 水平, 然而使用热灭活的A. muciniphila并未导致βCDCA 水平显着降低。这些结果与我们研究中观察到的A. muciniphila丰度和βCDCA 水平之间的负相关一致。FGF19已被证明通过胰岛素独立途径刺激糖原合成并抑制糖异生。临床分析显示,与NGT-NO组相比,T2D-NO组的血清FGF19水平显著降低。FGF19水平与A. muciniphila在肠道菌群中的丰度呈正相关,与βCDCA水平呈负相关。为了进一步研究βCDCA是否能抑制FGF15/19的表达,在CDCA存在的情况下,用不同浓度的βCDCA培养人结肠上皮细胞LS174T。我们发现,CDCA联合βCDCA处理LS174T细胞可导致FGF19 mRNA表达水平呈剂量依赖性下降,提示βCDCA对肠道FGF15/19表达有抑制作用。以上结果表明,A. muciniphila可能通过限制βCDCA的可用性,增强FGF15/19的表达,进而刺激糖原合成,抑制糖异生,至少部分抑制糖原合成。
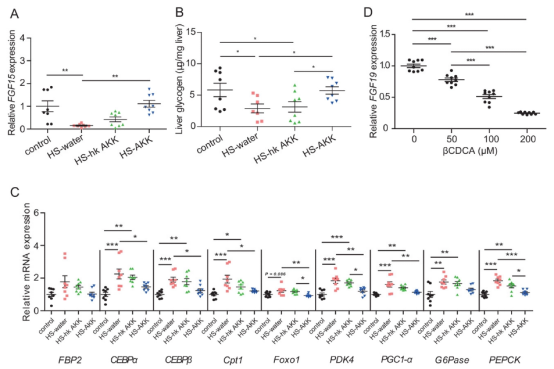
图注:A. muciniphila对FGF15/19表达的影响
结论
该研究比较了患有和不患有T2D的瘦人和腹部肥胖者的肠道微生物组,以确定肠道微生物组的差异是否能解释患有T2D的瘦人的具体临床特征。通过宏基因组学和代谢组学分析,发现在体型偏瘦的2型糖尿病患者中,肠道中A. muciniphila的丰度显著下降,其丰度与胆汁酸βCDCA水平成负相关,与该人群的胰岛素分泌受损以及FGF19水平的下降密切相关。进而发现,βCDCA能抑制胰岛素分泌和FGF15/19表达。在高糖饮食诱导的胰岛功能受损小鼠肠道中,A. muciniphila丰度显著降低,而在补充A. muciniphila后,小鼠的胰岛功能显著改善,进一步研究发现A. muciniphila干预后βCDCA水平降低,肠道FGF15/19的表达上调,肝糖原合成增加而糖异生减少。本研究提示A. muciniphila干预可能成为改善胰岛素分泌和维持糖稳态的潜在途径,为2型糖尿病的治疗提供了新方向。







 京公网安备 11011302003368号
京公网安备 11011302003368号