作者的目的是确定儿童T细胞白血病细胞受阻的发育阶段,并根据ATAC-Seq确定白血病发生机制。人健康T细胞的7个发育阶段的染色质可及性图谱显示,在T细胞成熟过程中染色质逐渐凝聚。2823个特征性染色质区域区分发育阶段的准确性为95%。SAE1周围的开放染色质被鉴定为最能区分胸腺发育阶段,表明SUMOylation在T细胞发育中的潜在作用。利用特征性区域反褶积显示,包括那些具有成熟免疫表型的T-ALL,与大多数未成熟群体相似,这一点被TF结合motif图谱所证实。作者整合了ATAC-Seq和RNA-Seq,发现一个与白血病无关的基因DAB1在T-ALLs中过表达、异常剪接和高度可及性。DAB1阴性的患者形成了一个独特的亚群,具有特别不成熟的染色质谱和SPI1(PU.1)的高度可及性结合位点,SPI1是一种对正常T细胞成熟至关重要的TF。总之,我们对染色质可及性和TF结合位点分析表明,儿童T-ALLs细胞与未成熟胸腺前体细胞最相似,表明早期发育停滞。
英文名称:Chromatin accessibility landscape of pediatric T-lymphoblastic leukemia and human T-cell precursors
中文名称:儿童T淋巴细胞白血病和人类T细胞前体的染色质可及性概况
期刊:EMBO Molecular Medicine
IF:8.821
作者:Andreas E Kulozik
单位:德国海德堡大学
时间:2020.8.5
材料与方法
研究结果
1、全基因组染色质可及性在T细胞发育过程中逐渐发生变化
使用ATAC-Seq,作者从6名接受心脏手术的健康儿童胸腺中获得了7个健康T细胞前体(DN2、DN3、ISP、DPCD3–、DPCD3+、SPCD4+和SPCD8+)染色质可及性图谱(图1A)。染色质可及性随着成熟而逐渐减少,并在DP和SP阶段达到最小(图1B)。此外,作者根据可及性模式的变化将68,415个OCRs分为四种模式(递增、递减、波动和稳定),并发现在胸腺细胞成熟过程中,大多数OCRs(59%)保持稳定(图1C)。作者发现29%的OCRs可及性变少,只有0.3%可及性增加,这表明发育中的胸腺细胞的染色质组织特征是关闭/浓缩的,那些区域在不成熟的前体细胞可及性更高(图1C)。PCA分析显示可以根据发育阶段进行聚类,并显现出重叠的轮廓,因此表明T细胞成熟过程中染色质的重塑是连续的过程(图1D)。
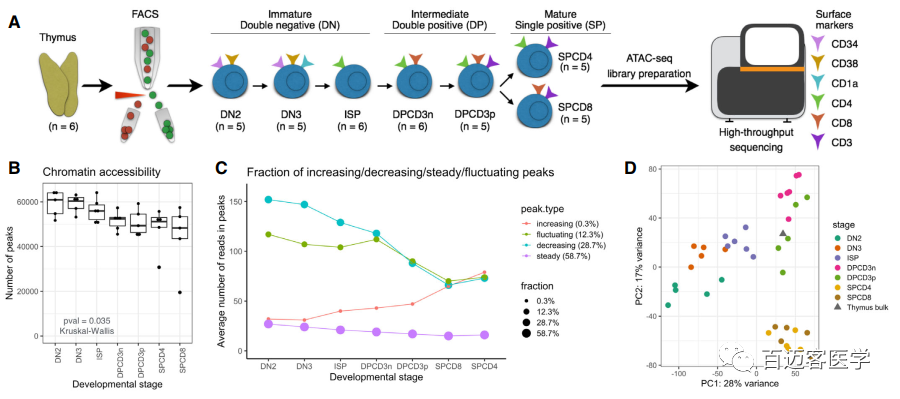
图1通过ATAC-Seq染色质可及性区分健康T细胞前体的成熟阶段
2、染色质的发育阶段特异性构象揭示了T细胞发育的关键调控区域
所有特征区域聚类热图将7个T细胞类群按其成熟的顺序聚集在一起,突出了T细胞成熟过程中染色质可及性的持续变化(图2A)。连续发育阶段的逐渐变化导致了DN3和ISP之间的轻度分离,双阳性阶段CD3–和CD3+(图2A)导致在使用CIBERSORT反褶积算法预测细胞类型预测精度不理想。利用主成分1和2的转换,量化了特征OCRs的重要性并发现SUMO1激活酶亚基1上有一个峰(图2B)。此外,OCRs差异可及性附近有阶段性特征已知基因如CD8A和RAG1/2(图2B)。双阳性组OCRs在与造血和白细胞分化相关的terms富集,单阳性组在免疫系统调节相关的terms富集(图2C)。然而,双阴性特征峰只富集在一个GO-term即白细胞迁移正调节(图2C)。
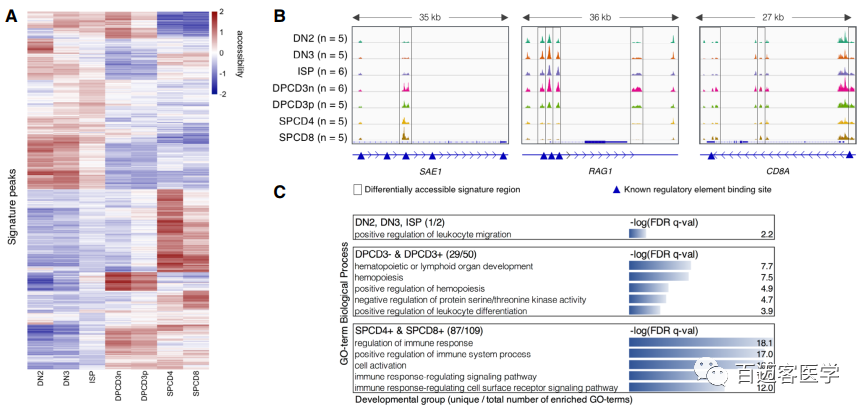
图2染色质开放区域区分T细胞的发育阶段
3、差异motif富集分析揭示调控T细胞发育的关键转录因子
为了增强motif预测的特异性,作者进一步从HINT-ATAC预测候选的转录因子结合位点(图3A)。图3B中绿色为SPI1、Bach2、IRF1和IRF2。EV5数据库中TFs包括MAF::NFE2、Bach1::Mafk和ETS相关家族TFs(ELF1/4、ELK1/3和ETV3 )(图3B)。最后。作者确定了7个目前与T细胞发育无关的TFs(图3B)。
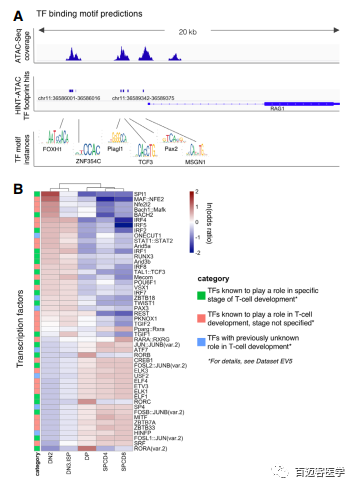
图3 开放的染色质区域包含成熟的特定的转录因子结合motif
4、未成熟的胸腺T细胞前体与T-ALLs共享开放的染色质区域
29个PDX模型中有7个对应19个T-ALLs患者中的4个(图4A),之前被证明可以再现原发性白细胞样本的染色质可及性,与原始患者相比,ATAC文库富集在TSS区域。白血病样品2,823个细胞特征OCRs PCA分析显示与健康T细胞分离,将其定位在早期DN2和DN3&ISP发育阶段附近(图4B)。19例白血病患者中16例早期发育组DN2和DN3&ISP至少占40%(图4C)。值得注意的是,即使是被免疫表型分类为成熟的T-ALLs也表现出早期DN2染色质可及性概况的实质性贡献,表明即使是以成熟免疫表型为特征的T-ALL亚型也类似于未成熟的胸腺前体(图4C)。通过ATAC-Seq peaks数量衡量,染色质可及性随着T细胞的成熟而降低(图4D)。虽然T-ALLs与早期DN2群体最相似,但是T-ALLs的peaks数明显高于分类后的T细胞群(图4D)。132个早期特异性TF结合位点如Bach1/2、Maf和Nfe212,109个在白血病中显著富集,然而115个中间和成熟特异性TFs中只有12个在T-ALLs中富集(图4E)。在T细胞白血病中,以正常DP和SP阶段为特征的TFs结合位点motifs趋向减少(图4E)。
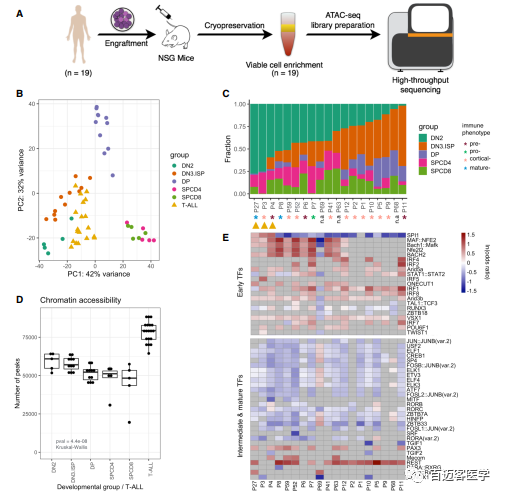
图4 T-ALL染色质可及性概况与正常人T细胞发育的不成熟阶段最相似
5、与正常人未成熟T细胞相比,T-ALLs染色质可及性更强
T-ALLs中有46,188 OCRs可及性,健康T细胞前体有11,243 OCRs可及性(图5A)。此外,基于所有OCRs的无监督学习PCA分析显示T-ALLs和健康T细胞明显分离,表明T-ALLs染色质可及性图谱与胸腺中健康T细胞完全不同(图5B)。
6、T-ALLs两个亚群DAB1和SPI1过表达
由于患者异质性较高(图5B),作者对每个患者进行了DESeq2差异分析鉴定复发事件。与健康T细胞前体相比,作者在至少5个T-ALLs中鉴定出292个差异基因和差异可及性OCRs(图5C)。102个峰/基因可及性强并过表达,191个峰/基因可及性弱并低表达(图5C)。4例未表达DAB1的患者(P3、P4、P27和P69)形成了一个不同的亚群其特征是SPI1过表达,发育早期DN2贡献率特别高(图4C),3例患者TF SPI1(PU.1)结合位点可及性更高(图4E)。基因表达和染色质可及性差异分析显示,表达SPI1的患者以基因过表达/超可及性为特征,并决定了T细胞发育的早期第一阶段。这些基因包括MEF2C、MEIS1和HOXA9 ,基因特征为B细胞前体如LYN、BTK、cyclin D2、CD79A、CD79B和CD72(图5D)。DAB1过表达和超可及性T-ALLs趋向于T细胞发育后期2和3阶段过表达基因如TCF7、LEF1和RUNX1(图5D)。综上所述,这些数据涉及到DAB1和SPI1一个未知的相互排斥的生物学意义,并将T细胞发育阶段,即儿童T- ALLs可能起源于成熟T细胞发育途径的不同层次,尽管早期水平始终一致。
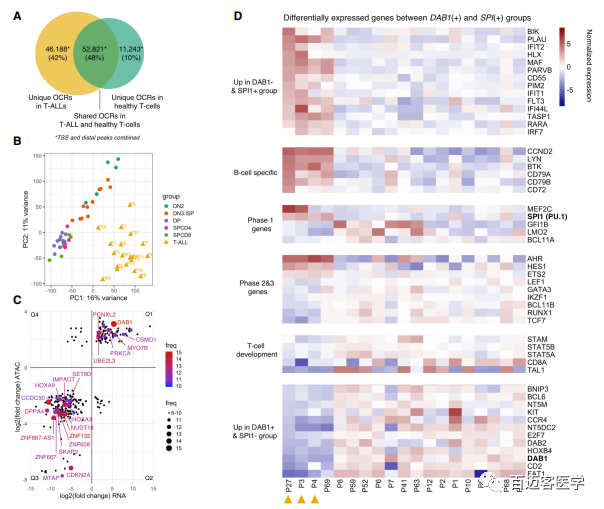
图5不同染色质可及性和表达整合分析揭示循环的特异性表达的基因







 京公网安备 11011302003368号
京公网安备 11011302003368号