中文名:阐明种子传播的E.gansuensis内生真菌增加醉马草对NaCl胁迫的耐受性分子机制
英文名:Elucidating the Molecular Mechanisms by which Seed-Borne Endophytic Fungi, Epichloë gansuensis, Increases the Tolerance of Achnatherum inebrians to NaCl Stress
杂志:IntJMolSci
影响因子:4.556
研究背景
A.inebrians与种子传播的内生真菌Epichloëgansuensis形成共生关系,这是其对生物和非生物胁迫的适应性和生产力的重要因素。这种共生为A.inebrians提供了几个优势,包括抗盐和抗旱性,提高水和氮的利用效率并增加生物量。此外,它还提高了氮代谢的酶活性,耐镉,清除活性氧和抗病虫害的能力。植物与Epichloë内生菌的共生可能调节生长之间的权衡和寄主草对非生物胁迫的抗性。这可能是两者相互作用的结果,Epichloë增强寄主草对非生物胁迫的耐受性并促进植物生长。与非共生植物相比,共生植物通常表现出更多的分蘖和生物量。Epichloëgansuensis与Achnatheruminebrians形成稳定的关联,是研究本地草和真菌内生菌相互作用的理想宿主。
研究目的
高通量测序是一种有效的方法用转录本来探索原生草对非生物胁迫的反应,即使没有参考基因组序列。以前的研究表明,许多差异表达寄主草的基因受Epichloë内生菌的影响。在目前的研究中,我们探索了A.inebrians的全长转录本信息,评估了其作用在200mMNaCl胁迫下E.gansuensis感染对A.inebrians生长的影响并通过Illumina测序在A.inebrians的叶子中确定参与转录本对醉马草产生反应的基因。研究旨在探索内生真菌E.gansuensis感染后NaCl胁迫下宿主草的转录组,并提供E.gansuensis增加NaCl的寄主草耐受性的分子机制见解。
材料方法
12Epichloëgansuensi感染(E+植物)和未感染的种子(E-植物)A.inebrians播种在16个盆中,种子发芽一周后,每个花盆每周浇150mL1/2Hoagland,同时每个花盆每周浇200毫升蒸馏水。6周后,4个E+苗盆和4个E-苗盆用150mL的1/2Hoagland和0mMNaCl浇灌,4个E+幼苗花盆和4个E-苗盆用150mL的1/2Hoagland与200毫升氯化钠处理4周;同时对4个E+苗盆和4个E-苗盆每周200mL蒸馏水处理,4个E+苗盆和4个E-苗盆每周用200mL蒸馏水和200mMNaCl。4周后取0mM和200mMNaCl浓度下的E-植物(叶和根混合)的总RNA根据制造商的方案,通过植物RNA提取试剂盒并用DNaseI消化以去除基因组DNA,用PacBio测序全长转录组。此外,共有12个RNA样本来自在0mMNaCl和提取200mMNaCl以通过Illumina测序。提取的RNA检测和定量使用安捷伦生物分析仪2100和Nanodrop2000。
研究结果
1、基于SMRT的RNA测序
采用PacBio测序平台进行单分子实时(SMRT)测序,获得芨芨草全长转录组信息。从单个E-植物中收集叶子和根,彻底混合并用于mRNA提取。构建了全长cDNA文库,随后用SMRT测序(补充图S1A)。我们获得了940,319个ROI(总碱基:1,789,709,871),其中包括6.41%的全长嵌合序列和78.55%全长非嵌合序列(补充图S1B和表S1)。此外,738,588个全长非嵌合序列、60,317个全长嵌合序列和68,878个转录本,转录本的平均读取长度为1832bp。
2、ORF和SSR的预测
E−A.inebrians总共预测了34,764个开放阅读框(ORF)和27,202个完整的ORF。长度分布表明长度为800~1200的ORF为5,926个(补充图S2)。在大多数生物体中,简单序列重复(SSR)是一个重要的分子标记,我们的结果表明E−A.inebrians检测到15,945个的SSR,其中大多数具有单核苷酸重复、二核苷酸重复、三核苷酸重复和四核苷酸重复(补充表S2)。由于SMRT测序序列的高组装质量,SSR的信息可用于E−A.inebrians未来的遗传分析和标记辅助育种。
3、转录本的功能注释和转录因子的分类
总体而言,94.16%的A.inebrians转录本在选定的数据库中进行了注释,并且单个数据库的成功率在41.54%到93.83%之间。GO,KEGG,COG,KOG、Pfam、Swiss-Prot、eggNOG和NR注释率分别为82.05%、41.54%、42.07%、57.65%、79.78%、68.45%、92.44%和93.83%(补充表S3)。这些结果表明,大多数基因是真正转录的序列,而且很可能A.inebrians中的功能基因。此外,我们获得了63个转录基因家族因子(TF)并确定了1536个A.inebrians的推定TF成员(补充表S4)。此外,MYB相关TF、bHLHTF、NACTF和bZIPTF占大比例(补充图S3)。
4、E.Gansuensis在各种NaCl浓度下改变了A.Inebrians的转录本
进一步阐明E.gansuensis在NaCl胁迫下对寄主植物生长的分子机制,E+和E-A.inebrians叶片(28天龄)的转录组通过Illumina测序进行分析。E+A.inebrians和E-A.inebrians用含0mMNaCl和200mMNaCl浓度处理。阈值FDR≤0.01和FC≥2用于确定DEG(差异表达基因)。结果显示响应E.gansuensis的转录本发生显着变化,在0mMNaCl和200mMNaCl浓度下的分别发生2464和1817DEGs(图1)。此外,在NaCl胁迫下,转录本发生了显着变化,E+叶子的4919个DEG。然而,一个小的转录组变化发生在对NaCl胁迫的响应,E-叶为502DEG(图1)。
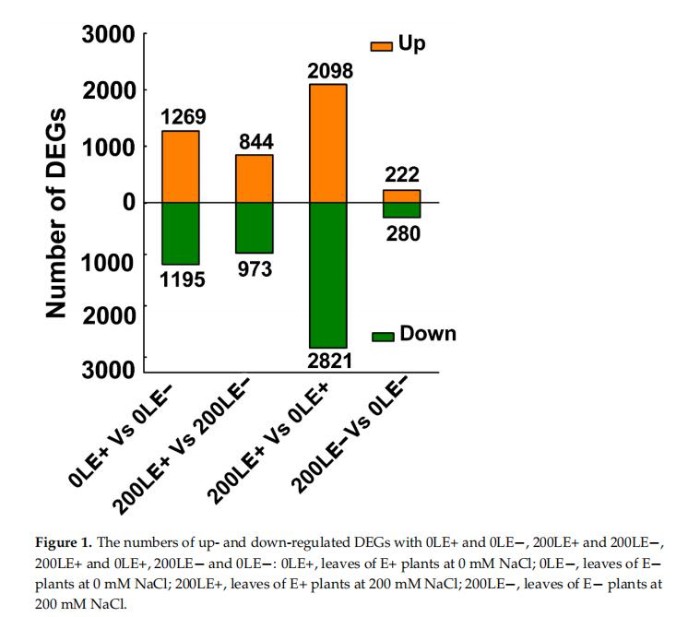
5、E.Gansuensis调节A.Inebrians的不同生物过程以维持生长与抗NaCl胁迫之间的平衡
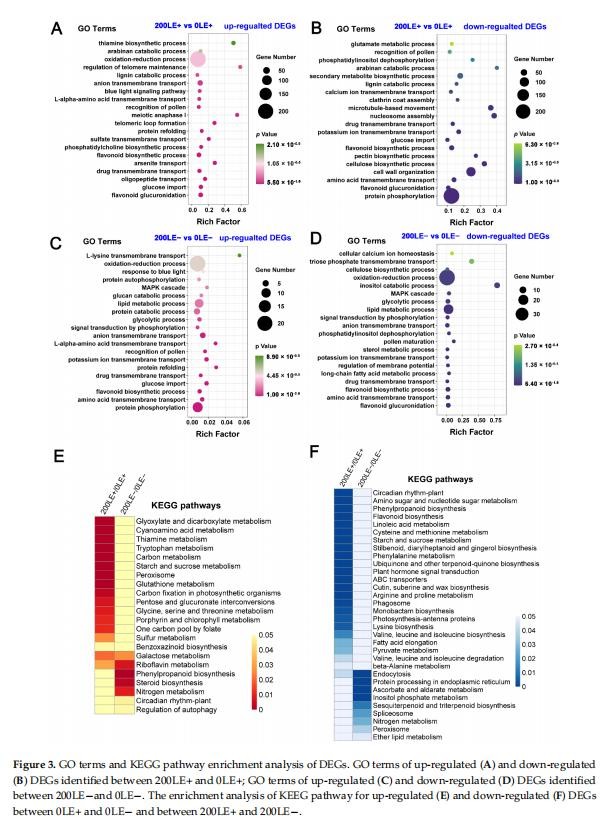
E.gansuensis上调1269个基因,下调1195个0LE+基因(叶E+植物在0mMNaCl下)与0LE-(E-植物在0mMNaCl下的叶子)相比。类似地,E.gansuensis诱导844个基因并抑制200LE+(E+植物的叶子)的973个基因在200mMNaCl下)与200LE-(E-植物的叶子在200mMNaCl下)相比(图1)。目前的结果表明在NaCl胁迫下E.gansuensis对基因的调控有巨大的影响与200mMNaCl相比。对0LE+和0LE-之间的DEGs进行GO富集分析发现,E.gansuensis主要诱导“钠离子跨膜转运”、“胚胎后发育的正调控”、“蛋白质磷酸化”、“光系统化学计量调整”和“谷氨酸代谢过程”(图2A)。此外,GO富集分析表明,类别“类黄酮葡萄糖醛酸化”、“类黄酮生物合成过程”、“氧化-还原”过程”和“阴离子跨膜转运”在下调中富集E.gansuensis在0mMNaCl浓度下的DEGs(图2B)。这些结果暗示E.gansuensis重新编排了植物生理学和重要生物学的许多方面提高寄主植物的竞争力。GO富集分析在200LE+和200LE−之间的DEGs表明,E.gansuensis主要诱导“蛋白质磷酸化”、“氧化还原过程”、“油菜素类固醇生物合成过程”、“细胞钙离子稳态”和“L-谷氨酸转运”(图2C);此外,GO富集分析发现“蛋白质磷酸化”的类别,“果糖6-磷酸代谢过程”、“类黄酮生物合成过程”和“MAPK”在200mMNaCl浓度下,E.gansuensis在下调的DEG中富集级联”(图2D)。我们的研究结果表明,E.gansuensis通过激活细胞信号转导促进宿主在胁迫环境下的生长,维持平衡。促进ROS、Ca2+信号和油菜素类固醇(BR)的生物合成,它们在抗压过程中起作用。

6、E.Gansuensis在A.Inebrians两种氯化钠浓度中转录本重排中起的独特作用
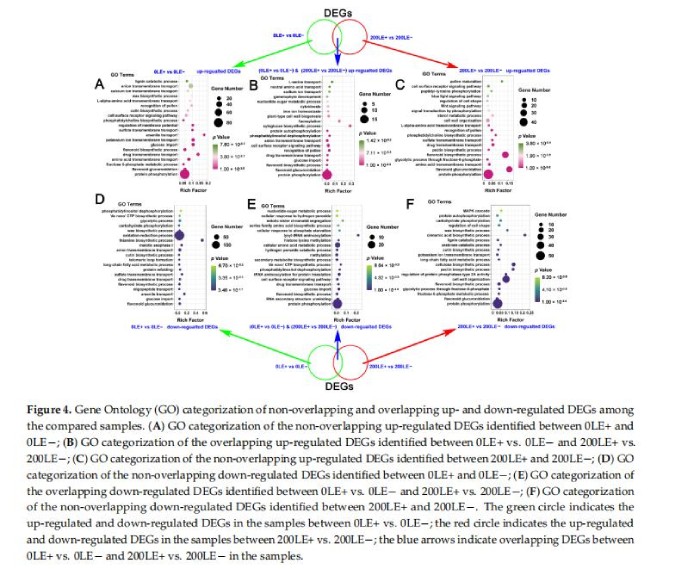
Venn结果显示E.gansuensis仅上调1135DEG在0mMNaCl浓度下的LE+和LE-之间,E.gansuensis在200mMNaCl胁迫下仅上调LE+和LE-之间的710DEG;此外,134DEG的LE+与LE-在E.gansuensis在0mMNaCl和200mMNaCl(补充图S4A)。同样,E.gansuensis在0mMNaCl和E.gansuensis仅下调LE+和LE-之间的928DEG仅在A.inebrians中下调LE+和LE-之间的706DEG作为响应至200mMNaCl(补充图S4B)。分析结果表明这些特殊的上调或下调的LE+与LE-的DEG的GO富集0mMNaCl和200mMNaCl分别显示磷酸化信号,次生代谢物的合成和转运,以及离子跨膜转运A.inebrians主要富集于E.gansuensis独特的上调DEGs在0mMNaCl浓度下(图4A)。GO富集分析结果表明A.inebrians的“蛋白质磷酸化”、“类黄酮葡萄糖醛酸化”、“氨基酸跨膜转运”、“果糖6-磷酸代谢过程”、“类黄酮生物合成过程”和“磷酸化信号转导”主要在200mM甘肃E.gansuensis独特的上调DEG中富集NaCl浓度(图4C)。细胞信号转导通路(“蛋白磷酸化”和“细胞表面受体信号通路”)、“类黄酮生物合成A.inebrians的“过程”、“细胞表面受体信号通路”、“葡萄糖输入”、“阴离子跨膜转运”和“细胞分裂”主要富集于E.gansuensis在0mMNaCl和200mMNaCl浓度下共享上调的DEG(图4B)。E.gansuensis主要仅抑制“黄酮类葡萄糖醛酸化”、“葡萄糖输入”、“长链脂肪酸代谢过程”、“黄酮类生物合成过程”、“阴离子跨膜转运”和“氧化还原过程”的A.inebrians,主要在独特的下调DEG中富集由E.gansuensis在0mMNaCl浓度下(图4D)。“蛋白质磷酸化”、“果糖6-磷酸代谢过程”、“黄酮类葡萄糖醛酸化”、“通过果糖-6-磷酸进行糖酵解过程”,“类黄酮生物合成过程”,“调节蛋白磷酸酶2A型活性”,“钾离子跨膜”A.inebrians的运输”和“MAPK级联”主要富集于独特的甘肃大肠杆菌在200mMNaCl浓度下下调DEG(图4F)。细胞信号转导(“蛋白质磷酸化”和“细胞表面受体信号通路”)、次生代谢产物(“类黄酮”生物合成过程”、“丝氨酸家族氨基酸生物合成过程”和“细胞氨基酸代谢过程”)和“过氧化氢分解代谢过程”A.inebrians主要在0mMNaCl和200mMNaCl的E.gansuensis共享的下调DEG中富集(图4E)。
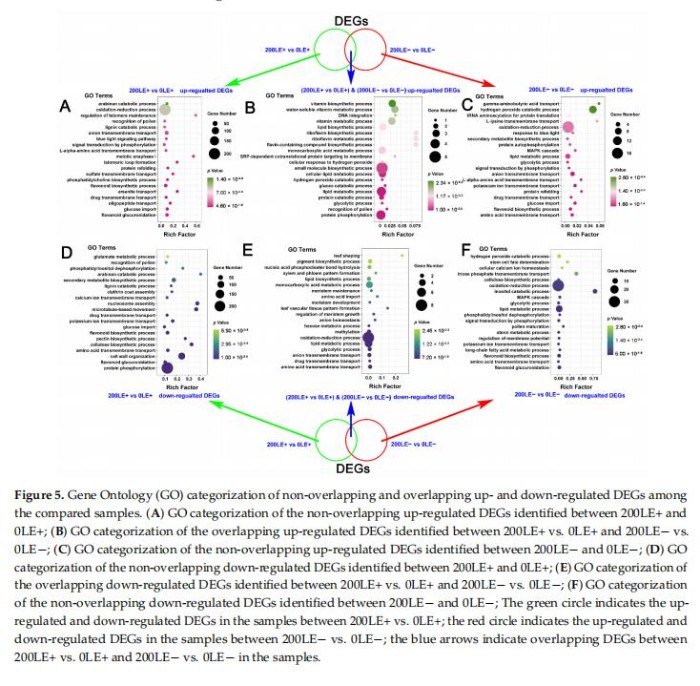
7、NaCl胁迫对A.InebriansE+和E—植物中转录本重排的独特影响
NaCl胁迫仅上调LE+和LE+之间的2015DEG,且仅NaCl胁迫在LE-和LE-之间上调139DEG(补充图S4C)。氯化钠胁迫仅在LE+和LE+之间下调4707DEG,NaCl胁迫仅下调LE-和LE-之间的290DEG(补充图S4D)。分析结果这些特殊上调的DEG在0mMNaCl与200mMNaCl下的GO富集度LE+和LE-分别表明NaCl胁迫主要调节氧化还原过程、次生代谢物的生物合成、小分子转运和细胞信号转导,主要富集在LE+和LE-中独特的上调DEGs(图5A,C)。例如“氨基酸跨膜转运”、“类黄酮生物合成过程”、“钾离子跨膜转运”、“葡萄糖输入”、“L-α-氨基酸跨膜转运”、“阴离子跨膜转运”、“信号转导”A.inebrians的磷酸化”、“MAPK级联”、“氧化还原过程”和“过氧化氢分解代谢过程”主要富集于独特的上调氯化钠胁迫下LE-中的DEGs(图5C)。次生物质的代谢和运输代谢物(“一元10羧酸代谢过程”、“蛋白质分解代谢过程”和“脂质代谢过程”),ROS信号(“过氧化氢分解代谢过程”和“细胞对过氧化氢的反应”)和A.inbrians的“蛋白质磷酸化”主要富集分别在LE+和LE-之间的NaCl胁迫下共享上调的DEG(图5B)。类似地,“蛋白质磷酸化”、“类黄酮葡萄糖醛酸化”、“类黄酮生物合成过程”、“氨基酸跨膜转运”、“钾离子跨膜”转运”、“钙离子跨膜转运”和“谷氨酸代谢过程”A.inebrians主要富集在NaCl下LE+中独特的下调DEGs压力(图5D)。次生代谢物的合成和转运(“黄酮类葡萄糖醛酸化”、“氨基酸跨膜转运”、“类黄酮生物合成过程”和“长链脂肪酸代谢过程”)、“钾离子跨膜转运”、“氧化-还原过程”和信号转导途径(“磷酸化信号转导”A.inebrians的“MAPKcascade”)主要富集于独特的下调氯化钠胁迫下LE-中的DEGs(图5F)。次生物质的代谢和运输代谢物(“氨基酸跨膜转运”、“脂质代谢过程”、“氨基酸进口”、“糖酵解过程”和“一元羧酸代谢过程”)、“阴离子跨膜转运”、“氧化还原过程”和“阴离子稳态”。主要富集于LE+和NaCl胁迫下共享的下调DEGsLE-(图5E)
8、E.gansuensis在NaCl胁迫下对A.Inebrians转录因子表达模式的影响
E.gansuensis在0mMNaCl下调节A.inebrians的16个转录因子(TFs)浓度,有10个上调的TF和10个下调的TF;上调的TF包括MYB相关、bHLH、CAMTA、B3-ARF、C2H2、GARP-G2样、MADS-M型和1个TrihelixTF(补充图S5A),其中MYB相关的TF最多与0mMNaCl的其他TF相比,对内生真菌敏感。下调的TF包括GRAS、CPP、HSF、AP2/ERF-ERF、C2C2-LSD、NAC、C3H、bHLH、bZIP和MYB相关的TF(补充图S5A)。E.gansuensis影响了A.inebrians的14个TFs200mMNaCl浓度,有5个1112上调的TF和12个下调的TF;这上调的TF,包括HB-HD-ZIP、MYB、NAC、AP2/ERF-ERF、bHLH、bZIP、C2H2、C3H、GARP-G2-like、GRAS、HSF、WRKYTFs和NACTFs受到显着影响通过200mMNaCl胁迫下的内生菌(补充图S5B);下调TF包括3个B3-ARF、1个HB-BELL、1个HB-HD-ZIP、2个MYB和1个NACTF(补充图S5B)。此外,NaCl胁迫调节了LE+中A.inebrians的30个TF,具有23个上调的TF和17个下调的TF;上调的TF包括AP2/ERFAP2、C2C2-CO-like、C2C2-Dof、C2C2-LSD、CPP、FAR1、GARP-G2-like、GRAS、HB-BELL、NF-YC、RWP-RK、WRKY、zf-HD、AP2/ERF-ERF、bHLH、bZIP、C2C2-GATA、C2H2、C3H、HSF、LOB、MYB相关和NACTF(补充图S5C)。下调的TF包括AP2/ERF-ERF、bHLH、bZIP、C2C2-GATA、C2H2、C3H、2HSF、LOB、MYB相关,NAC、B3、B3-ARF、BES1、HB-HD-ZIP、MYB、Tify和Trihelix,与MYB相关,NAC和WRYKTFs在LE+中受到NaCl胁迫的显着影响(补充图S5C)。NaCl胁迫调节LE+中A.inebrians的7个TF,其中2个上调TFs和5个下调的TFs;上调的TF包括两个WRKY和一个NF-YCTFs,而下调的TFs包括bZIP、GARP-G2-like、HSF、三种MYB相关和一个NF-YATF(补充图S5D)。
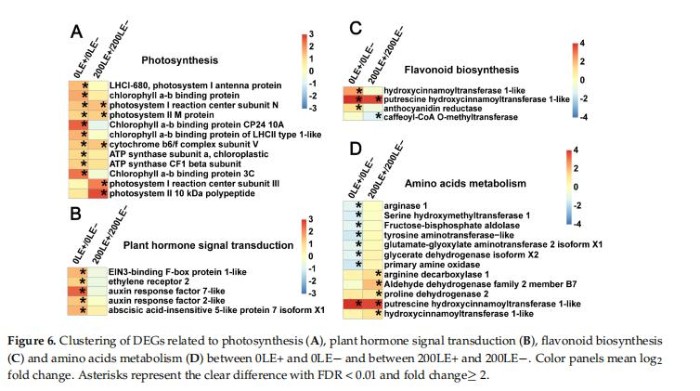
9、E.Gansuensis改变与类黄酮生物合成相关的关键基因的表达、光合作用、植物激素信号转导和氨基酸代谢在氯化钠压力下
E.gansuensis显著激活10个基因和5个光合作用基因分别为0mM和200mMNaCl浓度下。E.gansuensis的作用寄主植物的光合作用基因更明显在0mMNaCl下比200mM氯化钠(图6A)。此外,E.gansuensis显著激活植物的五个信号传导基因在0mMNaCl浓度下;这些基因包括乙烯信号通路的两个基因、生长素信号通路的两个基因和脱落酸信号通路的一种基因。然而,E.gansuensis没有显著激活植物激素信号转导基因在200mMNaCl浓度13下(图6B),这意味着NaCl的影响大于E.gansuensis在植物激素基因表达方面的研究。E.gansuensis显著下激活植物激素信号转导基因在0mMNaCl浓度下,但E.gansuensis在200mMNaCl浓度下显着调控两个类黄酮生物合成基因(图6C)。E.gansuensis显着抑制氨基的八个基因在0mMNaCl浓度和E.gansuensis的酸代谢显着激活下激活植物激素信号转导基因在200mMNaCl浓度下的(图6D)。更远,E.gansuensis显着下调甘氨酸、丝氨酸和苏氨酸代谢,以及作为色氨酸代谢在0mMNaCl浓度下。E.gansuensis显着下调赖氨酸降解,上调精氨酸和脯氨酸代谢在200mMNaCl下。因此,很可能,E.gansuensis通过调节宿主氨基酸代谢来提高A.inebrians的耐盐性。
文章亮点
本文通过全长转录组结合二代转录组分析,研究了在NaCl胁迫下,E.gansuensis对宿主A.inebrians的重排生物学过程产生重大影响以适应各种NaCl浓度。结果表明内生真菌重塑宿主的基因表达以适应高盐环境,探索了E.gansuensis提高寄主草对NaCl胁迫的耐受性的分子机制,PacBio测序获得的转录本数据主要促进了A.inebrians基因注释,进一步推动了基因研究功能。研究证明了内生真菌增加宿主对盐胁迫的耐受性分子机制,为内生菌制造耐盐草料分子育种提供理论依据。14








 京公网安备 11011302003368号
京公网安备 11011302003368号