英文标题:
Hepatic smallextracellular vesicles promote microvascular endothelial hyperpermeabilityduring NAFLD via novel-miRNA-7.
期刊:Journal of Nanobiotechnology
影响因子:10.435
合作单位:广州中医药大学中药学院 血管药理研究团队陈扬教授
DOI:10.1186/s12951-021-01137-3
背景介绍
非酒精性脂肪肝(Non-alcoholic fatty liver disease, NAFLD)是最常见的慢性肝病。近期研究发现,在非酒精性脂肪肝患者中,冠脉微循环障碍(Coronary microvascular dysfunction, CMD)较为常见,并且能够独立于非酒精性脂肪肝因素而预测主要心脏不良事件的发生,但鲜有报道用于预测CMD的疾病标志物以及治疗靶点。因此,开展NAFLD诱导冠状动脉并发症的机制研究具有重要意义。
材料方法
小鼠模型:C57BL/6N小鼠通过蛋氨酸胆碱缺陷饮食(MCD)和高脂肪饮食(HFD)构建NAFLD模型
测序技术:miRNA高通量测序技术
主要结果
一、NAFLD小鼠冠状动脉微血管的内皮细胞通透性增强
为建立小鼠NAFLD模型,作者分别给雄性C57BL/6 N小鼠喂食MCD 4周或HFD 16周。结果显示,MCD饮食和HFD喂食均诱导了NAFLD拌严重肝脏脂肪变性的预期特征(图1A)。肝内甘油三酯积累(图1A、B)、肝-肾比的升高(图1A、C)、转氨酶活性升高(图1D、E)。值得注意的是,小鼠喂食高脂膳食增加了体重和肝脏重量以及发展的血脂异常。相反,喂食MCD的小鼠不会出现与人类NAFLD相关的代谢综合征。随后,作者通过测量伊文思蓝渗漏来估计MCD和HFD诱导的NAFLD小鼠冠状动脉微血管的通透性变化。如图1F所示,深蓝色表示NAFLD小鼠的冠状动脉微血管比对照组小鼠更具渗透性。此外,ZO-1/2与血管内皮标志物血友病因子(vWF)的相对荧光强度比显示,MCD组和HFD组冠状动脉微血管内皮细胞中ZO-1/2的完整性均明显降低。综上所述,这些结果表明,在NAFLD期间,冠状动脉微血管发生了内皮屏障功能障碍,而这并不依赖于其代谢特征。
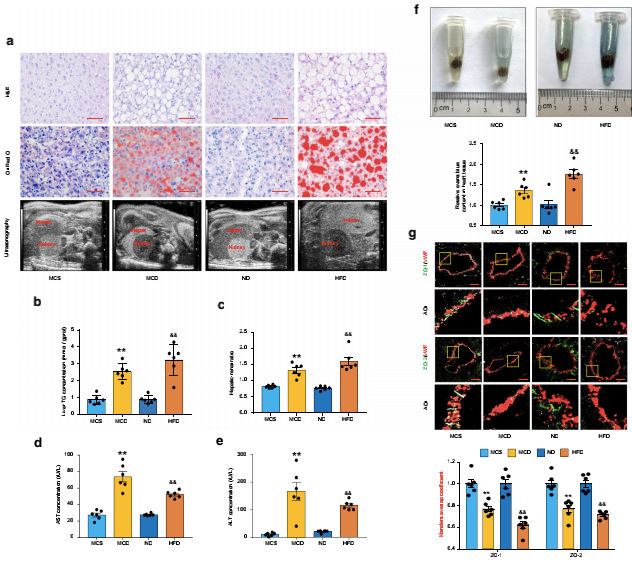
图1:NAFLD小鼠冠状动脉微血管内皮通透性增强
二、NLRP3炎症小体介导NAFLD小鼠冠状动脉微血管内皮高通透性
为了探讨NAFLD过程中微血管通透性变化的上游机制,作者利用GeneCards数据库中的人类微血管高通透性靶点进行GO和KEGG富集分析。GO富集的结果表明,细胞因子活性和细胞因子受体结合在微血管高通透性的发展中起重要作用。为了确定关键的介质,作者从这两个途径中筛选出了共同的基因(图2B)。KEGG通路富集结果表明,目的基因主要富集于Toll样受体(TLR)信号通路、非酒精性脂肪肝和Nod样受体(NLR)信号通路NLRP3是NLR家族中最重要的成员,需要TLR和NLR通路参与形成免疫酶体并介导IL-1β、IL-18和HMGB1的释放。说明NLRP3免疫酶体参与微血管高通透性的形成。作者给NLRP3+/+和NLRP3-/-小鼠喂食MCD饮食或HFD。NAFLD小鼠冠状动脉微血管内皮中裂解半胱天冬酶-1和IL-1β的表达水平明显升高,而NLRP3基因则明显地改善了这些影响(图2C、D)。此外,NLRP3-/-小鼠的心脏组织中IL-1β和HMGB1的含量也降低了。相应地,通过NLRP3基因敲除,NAFLD小鼠的冠状动脉微血管中ZO-1/2完整性和内皮细胞高通透性的破坏在冠状动脉微血管中显著恢复(图2E-H)。这些结果表明,NAFLD冠状动脉的微血管内皮屏障完整性的破坏是由NLRP3免疫酶体的激活介导的。
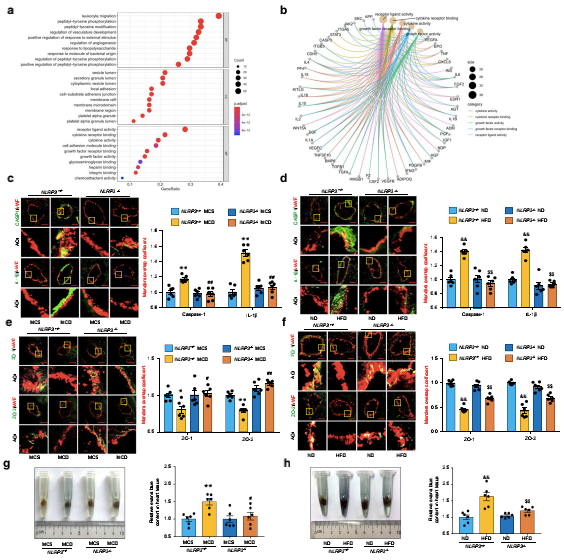
图2:NLRP3炎症小体介导NAFLD小鼠冠状动脉微血管内皮高通透性
三、循环NAFLD肝源性外泌体诱导冠状动脉微血管中NLRP3免疫酶体依赖性的内皮细胞高通透性
为了探讨肝脏外泌体在促进微血管内皮高通透性中的作用,作者对收集的外泌体通过WB分析检测了HSP70、CD63和TSG101等典型标志物的表达(图3A-C)。两种模型的肝脏外泌体的浓度和平均大小均无变化。然后,作者通过尾静脉将DiR标记的肝脏外泌体注射到小鼠体内。12 小时后用活体光学成像系统观察心脏、肺、肝、脾组织的荧光信号,发现肝脏外泌体通过循环到达心脏、肺、肝、脾。随后,将从NAFLD小鼠或对照组小鼠的肝组织衍生的外泌体注射到NLRP3+/+和NLRP3-/-小鼠中。结果显示,MCD和HFD中肝源性外泌体均能诱导冠状动脉微血管内皮中caspase-1裂解和IL-1β的表达,而NLRP3基因的表达明显逆转了这些影响(图3E、F)。此外,NAFLD肝源性外泌体增强了NLRP3+/+小鼠心脏HMGB1和IL-1β的含量,但对NLRP3-/-小鼠没有增强。相应地,NLRP3基因敲除恢复了循环NAFLD肝源性外泌体诱导的ZO-1/2损伤和微血管高通透性。这些体内实验结果显示,肝源性外泌体在NAFLD冠状动脉微血管中的 NLRP3 炎症小体依赖性内皮高通透性中具有刺激作用。此外,循环NAFLD肝源性外泌体显著诱导肺微血管高通透性,但是没有改变肝组织和脾脏组织的通透性。
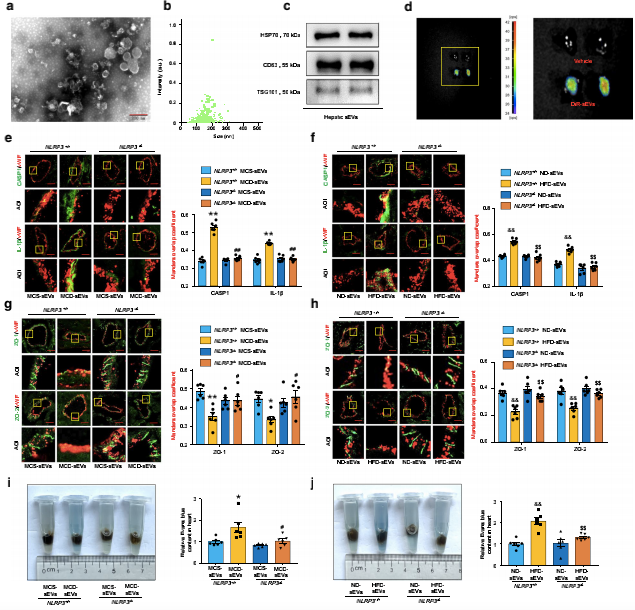
图3:循环NAFLD肝源性外泌体诱导冠状动脉微血管中NLRP3免疫酶体依赖性的内皮细胞高通透性
四、NAFLD肝源性外泌体通过激活组织蛋白酶B/NLRP3免疫激酶体轴诱导微血管内皮细胞高通透性
作者进一步通过微血管内皮细胞通过体外实验分析了肝脏外泌体的作用。作者将MVECs与DiI标记的肝脏外泌体孵育8小时。结果表明,肝脏外泌体可被MVECs内化,而这种缺陷被一种内吞抑制剂明显阻断(图4A)。Z-stack构建的三维细胞模型显示NAFLD肝源性外泌体的孵育促进了caspase-1的裂解、IL-1β的成熟和HMGB1的释放,但不影响NLRP3蛋白的表达(图4B)。使用一种选择性NLRP3免疫酶体抑制剂进行流式细胞术分析,进一步证实NLRP3免疫酶体的激活(图4C).此外,NAFLD肝源性外泌体显著降低了ZO-1/2的表达(图4D),增加了内皮单层中FITC-葡聚糖分子的数量。作者通过转染NLRP3 siRNA(siNLRP3),进一步验证了NLRP3基因沉默的效果。与预期的一样,siNLRP3显著降低了caspase-1的活性,改善了微血管内膜整体完整性。溶酶体膜通透性升高(LMP)诱导的溶酶体组织蛋白酶B逃逸和激活是NLRP3免疫酶体激活的一个重要机制。因此,作者用吖啶橙(AO)染色法检测肝脏外泌体对LMP的影响,用魔红(MR)染色法检测组织蛋白酶B活性。结果表明,NAFLD肝脏外泌体可显著促进溶酶体通透性,诱导组织蛋白酶B渗漏。此外,特异性组织蛋白酶B抑制剂CA-074的存在显著抑制了NLRP3免疫激酶体的激活(图4G),并改善了微血管内皮细胞的高通透性(图4H)。综上所述,这些结果表明NAFLD肝源性外泌体显著激活组织蛋白酶B/NLRP3免疫酶体轴,进而促进HMGB1的释放,诱导微血管内皮高渗能力。
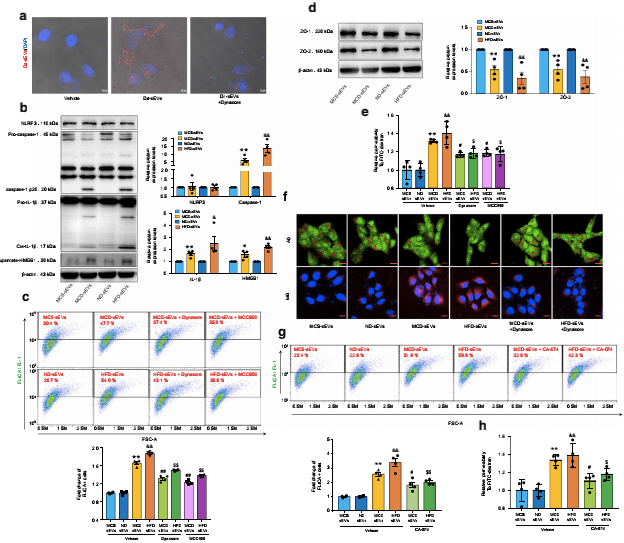
图4:NAFLD肝源性外泌体通过激活组织蛋白酶B/NLRP3免疫激酶体轴诱导微血管内皮细胞高通透性
五、NAFLD含有novel-miR-7肝源性外泌体触发NLRP3免疫酶体相关的内皮细胞高通透性
为了研究NAFLD肝源性外泌体如何诱导NLRP3免疫酶体相关的内皮细胞高通透性,作者对来自MCS和MCDg的肝源性外泌体进行了miRNA测序。10个具有最显著的miRNAs,其中novel-miR-7的差异最显著(图5A)。novel-miR-7在NAFLD肝脏和血浆外泌体中显著升高(图5B、C)。此外,NAFLD肝脏外泌体的孵育导致MVECs中novel-miR-7的显著表达。随后,作者通过转染novel-miR-7类似物来研究novel-miR-7对MVECs的影响。结果表示过表达novel-miR-7显著促进溶酶体通透性,增加组织蛋白酶B活性(图5E、F)。在过表达novel-miR-7的细胞中,caspase-1的裂解、IL-1β的成熟和HMGB1的释放的水平增加,而NLRP3的表达没有变化(图5G、H)。因此,novel-miR-7类似物显著降低了ZO-1/2的表达(图5G),并诱导了微血管内皮细胞的高通透性(图5I)。这些数据表明,novel-miR-7可以作为一个重要的肝脏外泌体标志物。作者进行了miRNA靶基因预测,发现LAMP1是noivel-miR-7的靶基因。LAMP1被称为溶酶体膜糖蛋白,是调节LMP的关键。双荧光素酶报告基因检测的结果显示,与pGL3-LAMP1-3’UTR质粒共转染后,荧光强度显著降低(图5J)。此外,noivel-miR-7类似物显著降低了LAMP1蛋白的表达(图5K)。总之,作者的研究结果表明,noivel-miR-7直接靶向LAMP1的3’-UTR并诱导溶酶体通透性,进而触发组织蛋白酶B/NLRP3免疫激酶体轴,促进微血管内皮细胞的高通透性。
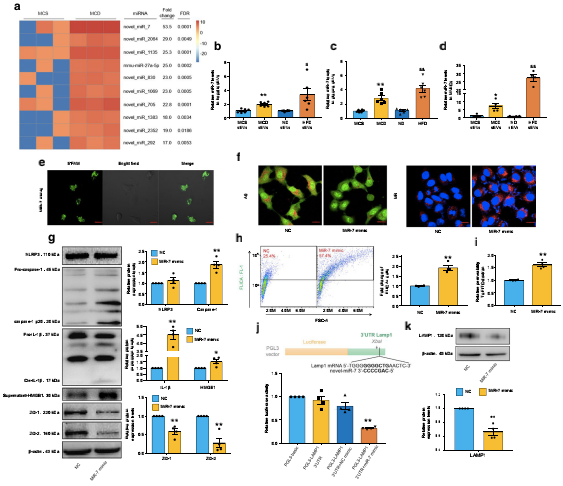
图5:NAFLD含有novel-miR-7肝源性外泌体触发NLRP3免疫酶体相关的内皮细胞高通透性
六、novel-miR-7的基因抑制可改善NAFLD肝源性外泌体诱导的微血管内皮高通透性
为了证实novel-miR-7在NAFLD过程中调节肝脏外泌体诱导的微血管内皮通透性中的重要作用,作者用一种特殊的novel-miR-7抑制剂转染MVECs,发现novel-miR-7基因抑制剂恢复了溶酶体渗透性并改善NAFLD肝脏外泌体诱导的组织蛋白酶B渗漏(图6A、B)。与这些结果一致的是,novel-miR-7抑制剂显著抑制了caspase-1的裂解、IL-1β的成熟和HMGB1的释放(图6C-G)。此外,抑制novel-miR-7显著恢复了ZO-1/2的表达(图6C、E),并改善了微血管内皮细胞的高通透性(图6H)。综上所述,这些数据表明,novel-miR-7基因诱导能够通过调节蛋白中和NAFLD肝诱导的微血管内皮高通透性。作者还在体内初步验证了novel-miR-7抑制剂的治疗效果。结果表明,novel-miR-7抑制剂不能改善代谢不良MCD饮食或HFD引起的代谢性紊乱和肝损伤,然而,novel-miR-7显著降低心脏组织中IL-1β和HMGB1的含量,提示抑制NLRP3免疫酶活性和促炎症细胞因子的释放。此外,novel-miR-7显著降低了心脏和肺的微血管高通透性,这表明novel-miR-7可能作为NAFLD微血管并发症的潜在治疗靶点。
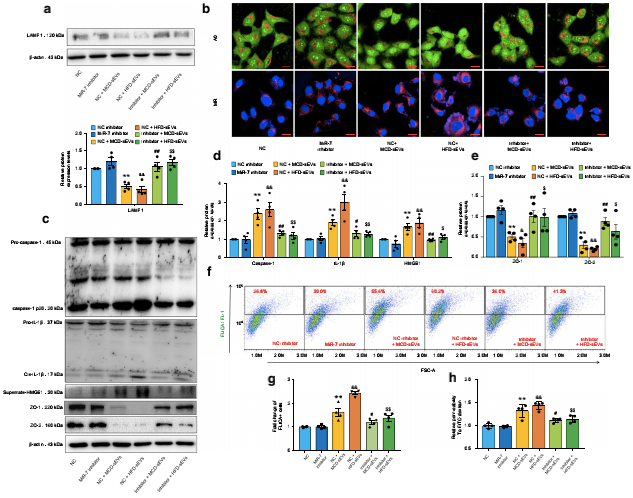
图6:novel-miR-7的基因抑制可改善NAFLD肝源性外泌体诱导的微血管内皮高通透性
七、脂肪变性肝细胞是novel-miR-7的重要来源
为了探索含有novel-miR-7的肝外泌体的来源,作者用100μmol/L棕榈酸(PA)处理人肝细胞细胞系HepG2、Huh7和L0218h,诱导了细胞内脂质的积累,但没有导致细胞死亡。结果显示,novel-miR-7在脂肪变性肝细胞来源的外泌体中显著丰富(图7A)。然后作者用novel-miR-7抑制剂或NC抑制剂转染了人的微血管内皮细胞系1(HMEC-1),并用HepG2衍生的外泌体处理24小时。结果显示,PA-sev导致的LAMP1/组织蛋白酶B/NLRP3免疫轴被novel-miR-7抑制剂明显消除(图7B-D)。此外,novel-miR-7抑制剂恢复了PA-sev诱导的紧密连接破坏和微血管内皮高通透性(图7B,E)。这些结果表明,脂肪变性肝细胞是含有novel-miR-7的肝外泌体的重要来源,脂肪变性肝细胞来源的外泌体能够通过novel-miR-7促进NLRP3免疫酶体依赖的微血管内皮高通透性。
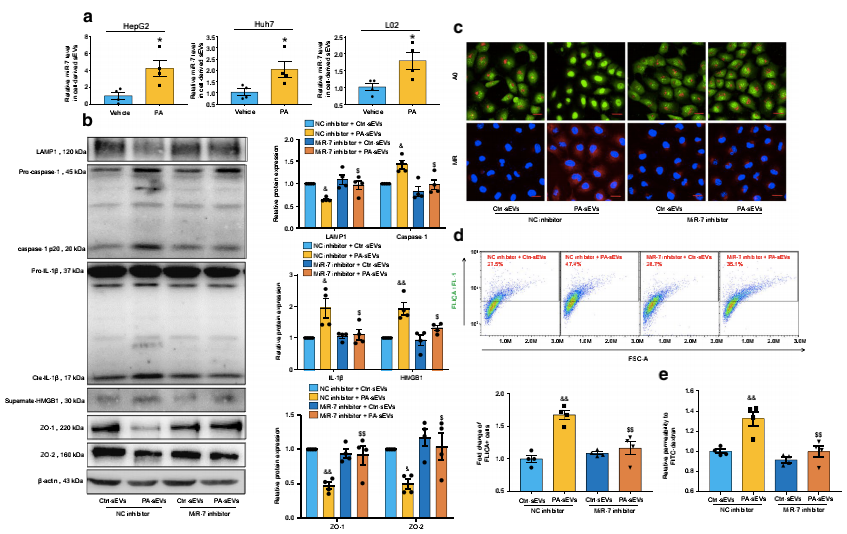
图6:novel-miR-7的基因抑制可改善NAFLD肝源性外泌体诱导的微血管内皮高通透性
总结
在本研究中,作者通过大量结论表明在NAFLD期间,冠状动脉微血管发生内皮细胞的高通透性。肝内脂质水平的增强可诱导富含novel-miR-7的肝脏外泌体的分泌,通过调节LAMP1/组织蛋白酶B/NLRP3炎症小体信号通路,促进微血管内皮细胞的高通透性。此外,脂肪变性肝细胞是含有novel-miR-7外泌体的一个重要来源,而对novel-miR-7的基因抑制可以改善微血管内皮屏障的完整性。本研究为肝脏-心脏间器官交流的具体机制带来了新的见解,并证实novel-miR-7有潜力成为冠脉微血管损伤的疾病标志物和治疗靶点。
如果您对该篇文章思路感兴趣,欢迎点击下方按钮联系我们,我们将免费为您设计文章思路方案。









 京公网安备 11011302003368号
京公网安备 11011302003368号