近日,岳麓山实验室畜禽品种创制中心印遇龙院士团队在Science Bulletin(IF 21.1)发表研究成果,题为“Methanobrevibacter smithii induces postnatal growth retardation through blunting hepatic ketone body metabolism”。

该研究发现生长迟缓(postnatal growth retardation, PGR)仔猪后肠中富集的史氏甲烷短杆菌(Methanobrevibacter smithii)和低丰度的短酸生成菌通过抑制肝脏酮体代谢功能,促使枯否细胞向促炎型极化,加剧肝脏损伤,进而导致机体生长受限。百迈客生物为该研究提供了转录组测序服务。
研究背景
仔猪出生后生长迟缓是养猪业中普遍存在的棘手问题,其发生率高,主要表现为体重增长缓慢、生产性能低下,不仅显著增加了饲养周期与成本,更严重制约了养殖业的规模化发展与经济效益提升。
近年来,大量研究证实肠道微生物群落是调控动物早期生长发育的关键因素,其通过参与营养物质代谢、调节免疫功能等多种途径影响宿主健康。然而,在众多肠道微生物中,哪些特定菌群与仔猪生长迟缓直接相关,以及这些菌群调控生长发育的具体分子机制仍不明确,这一研究空白严重阻碍了针对性防控技术的研发。因此,系统解析肠道微生物与仔猪生长迟缓的关联及作用通路,成为当前畜禽养殖领域的研究热点与迫切需求。
研究内容
研究团队通过大规模仔猪跟踪试验,建立PGR仔猪模型,并系统分析了其肠道微生物组成与功能变化。发现PGR仔猪的后肠呈现出明显的甲烷生成通路富集,而短链脂肪酸合成相关功能则明显减弱。同时,肝脏酮体代谢水平显著降低,肝脏损伤标志物升高,且肠道M. smithii丰度与宿主酮体含量呈显著负相关,提示M. smithii丰度和宿主酮体代谢水平可能与机体生长发育密切相关。
研究人员进一步开展粪菌移植和M. smithii单菌定植实验,均发现M. smithii可以显著降低肝脏酮体代谢水平,表现为抑制生酮通路关键酶HMGCS2表达和β-羟基丁酸产生,造成宿主生长阻滞。此外,M. smithii还能促进肝脏枯否细胞M1型极化,引发炎症反应,可能源于M. smithii增加了肠道通透性,脂多糖通过肠肝循环影响肝脏功能。当抑制M. smithii在肠道中的定植可以逆转上述不良表型。
为了验证酮体代谢对肝脏免疫功能的影响,该研究在肝脏特异性敲除Hmgcs2基因后,发现宿主酮体生成显著减少,肝脏M1型枯否细胞数量增加,T细胞数量无显著影响,说明酮体可能特异性地调控枯否细胞的极化状态。通过外源补充β-羟基丁酸,显著缓解生长迟缓仔猪的肝脏损伤,有效改善其生长性能。
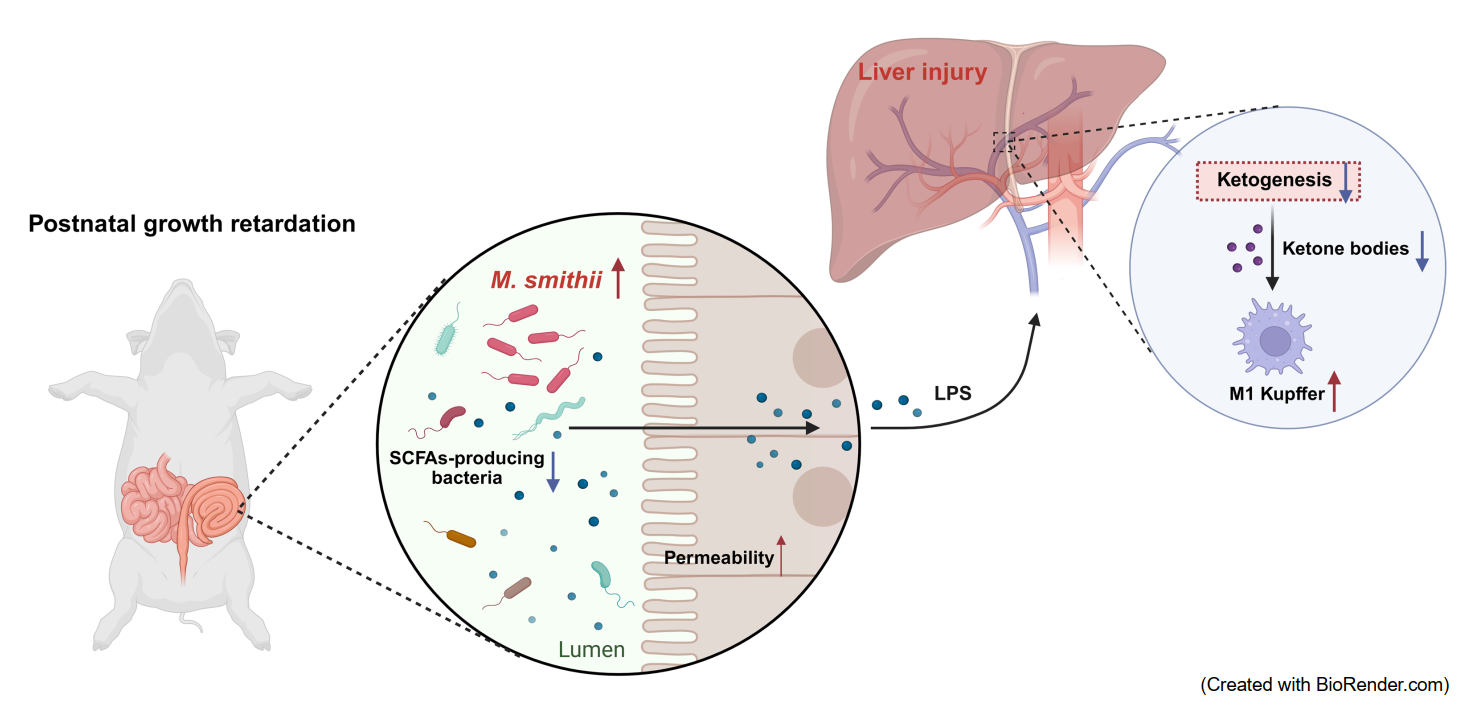
图-史氏甲烷短杆菌引起仔猪发育迟缓的潜在机制
研究总结
该研究通过系统深入的实验,最终揭示了“M. smithii—肝脏酮体代谢—肝脏免疫”的调控轴在仔猪生长迟缓中的核心作用:PGR仔猪后肠富集的M. smithii与低丰度的短酸生成菌共同作用,一方面抑制肝脏酮体代谢功能,减少β-羟基丁酸生成;另一方面增加肠道通透性,通过肠肝循环引发肝脏枯否细胞M1型极化与炎症反应,加剧肝脏损伤,最终导致仔猪生长受限。而抑制M. smithii定植或外源补充β-羟基丁酸,均可有效逆转生长迟缓表型。
该研究首次阐明了肠道微生物调控仔猪生长发育的全新分子机制,丰富了“肠-肝轴”在畜禽领域的研究内涵;为仔猪生长迟缓的防控提供了精准靶点,未来可通过靶向抑制M. smithii定植、调节肠道菌群结构或外源补充酮体代谢产物等方式,开发新型防控技术,降低养殖业损失。同时,该研究也为其他畜禽生长障碍的机制研究与技术研发提供了重要的参考范式。
以上内容来源于岳麓山实验室,侵删







 京公网安备 11011302003368号
京公网安备 11011302003368号