近期百迈客微生物合作文章频出,成都中医药大学2021年8月11日在Frontiers in Pharmacology 杂志上发表了题为“Phillygenin Attenuates Carbon Tetrachloride-Induced Liver Fibrosis via Modulating Inflammation and Gut Microbiota”文章,肠道微生物作为人类的第二基因组,越来越多的研究表明肠道微生物与疾病的发病及治疗密切相关。三代微生物多样性以其注释更准确、注释种水平等优势更有利于微生物的研究,据不完全统计,百迈客累计发表SCI论文500余篇,累计影响因子1900+,促进了微生物研究领域的发展。
英文题目:Phillygenin Attenuates Carbon Tetrachloride-Induced Liver Fibrosis via Modulating Inflammation and Gut Microbiota
中文题目:PHI通过调节炎症和肠道菌群来减轻CCl4诱导肝纤维化
期刊:Frontiers in Pharmacology
IF:5.81
合作单位:成都中医药大学
文献链接:https://doi.org/10.3389/fphar.2021.756924
研究背景
肝纤维化是多种病原体引起的慢性肝损伤过程中肝内结缔组织发生发育不良的动态病理生理过程。常见的致病因素包括病毒性肝炎、化学药物或毒物、自身免疫性疾病、遗传和代谢性疾病。近年来,大量文献表明肠道菌群紊乱在抗肝纤维化药物的发生和发展中起着至关重要的作用,改变肠道菌群结构可以缓解肝纤维化的进展。
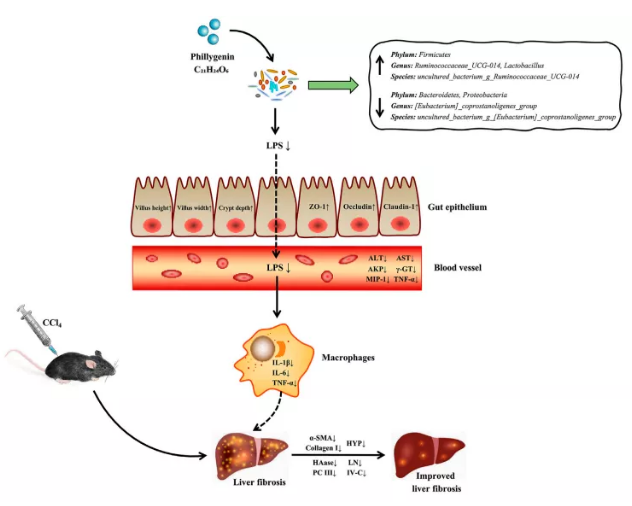
连翘素(PHI)具有良好的保肝作用,通过TLR4/MyD88/NF-κB信号通路抑制脂多糖诱导的促炎反应和LX2细胞的激活,从而缓解肝纤维化。此外,鉴于肠道菌群在肝纤维化发展过程中的重要作用,PHI的抗纤维化作用是否部分依赖于肠道菌群失调的调节尚不清楚。
材料方法
试验材料:36只8周龄雄性C57BL/6J小鼠,每组6只
试验方法:HE染色、血清生化指标检测、免疫组化、16S rRNA测序、q-PCR等
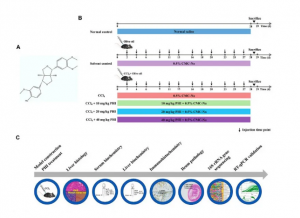
图1试验大纲:PHI化学结构、各组小鼠治疗流程图和试验设计说明
研究结果
1、HE染色及血清生化指标结果
如图2A所示,HE染色显示正常对照组和溶剂对照组肝细胞排列紧密,未见明显肝实质细胞病变和炎症细胞浸润。在CCl4处理的小鼠中,观察到显著的肝细胞脂肪变性、嗜酸性胞浆增强和胶原纤维增殖。
血清生化指标结果见图2B所示,正常对照组与溶剂对照组无显著差异。与溶剂对照组相比,CCl4组ALT、AST、ALP和γ-GT水平显著升高。与CCl4组相比,PHI组显著降低了ALT、AST、ALP和γ-GT水平。
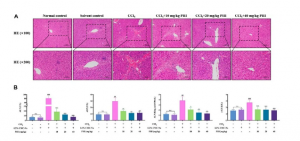
图2 PHI对小鼠肝纤维化病理及血清生化指标的影响
2、胶原沉积及肝脏生化指标结果
观察纤维组织分布、Masson染色及Sirius red染色。如图3A和B所示,Masson染色时胶原纤维呈蓝色,Sirius red染色时呈红色。结果表明,正常对照组和溶剂对照组几乎不产生胶原纤维,而CCl4可诱导产生大量的胶原纤维。有趣的是,PHI处理显著减少了肝脏中胶原的积累。
肝脏生化指标结果如图3C-G所示,正常对照组与溶剂对照组无明显差异。与溶剂对照组相比,CCl4组的HYP、HAase、LN、IV-C和PC III水平更高。与CCl4组相比,PHI组HYP、HAase、LN、IV-C和PC III水平显著降低。
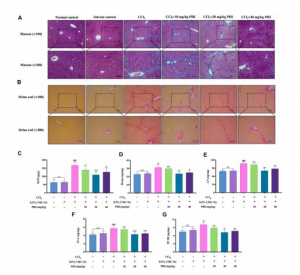
图3 PHI对小鼠肝纤维化胶原沉积及肝脏生化指标的影响
3、PHI能抑制肝星状细胞的活化
肝纤维化通常伴有造血干细胞活化,而α-SMA是造血干细胞活化的标志,而I型胶原是ECM的主要成分之一。为了研究PHI对肝纤维化造血干细胞激活的影响,作者通过检测α-SMA和I型胶原的表达水平来确定PHI是否能抑制肝纤维化造血干细胞的激活。如图4所示,α-SMA和I型胶原蛋白被染成黄色。结果表明,正常对照组和溶剂对照组很少观察到α-SMA和I型胶原,而CCl4处理显著增加了肝脏α-SMA和I型胶原阳性细胞。而PHI处理后α-SMA和I型胶原免疫反应细胞明显减少。
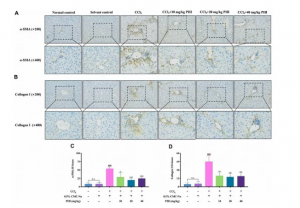
图4 PHI对α-SMA及胶原蛋白I表达的影响
4、PHI可以抑制炎症
为了评价PHI的抗炎作用,作者检测了血清中LPS、MIP-1和TNF-α的水平。如图5所示,正常对照组与溶剂对照组LPS、MIP-1和TNF-α水平差异不显著。与溶剂对照组相比,CCl4组LPS、MIP-1和TNF-α水平显著升高。20和40mg/kg PHI可显著降低LPS、MIP-1和TNF-α水平。

图5 PHI可以抑制炎症
5、PHI对CCl4诱导的肠上皮屏障破坏具有保护作用
如图6A所示,HE染色显示正常对照组和溶剂对照组回肠内绒毛和肠腺排列整齐,分布均匀。CCl4处理组回肠出现大量的肠腺上皮细胞变性、细胞肿胀、绒毛紊乱和破裂。相比CCl4组,PHI处理组小鼠肠腺上皮细胞变性、肿胀及回肠炎症细胞浸润均不同程度缓解,肠绒毛更加有序、规则。
此外,作者测量了各组小鼠回肠绒毛高度、宽度和隐窝深度,结果如图6B-D所示。正常对照组与溶剂对照组无明显差异。与溶剂对照组相比,CCl4组回肠绒毛高度、宽度和隐窝深度显著减少。PHI(20和40mg/kg)处理后上述指标减少均可逆转。综上所述PHI可以显著改善肠道损伤。
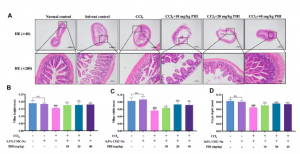
图6 PHI对CCl4诱导的肠上皮屏障破坏具有保护作用
6、PHI改变肠道菌群结构
对36个样品进行测序,每个样品平均产生7507条CCS。97%相似性聚类得到982个OTUs。使用Chao1指数、Shannon指数和Simpson指数评估肠道菌群的丰富度、多样性和均匀度(图7A)。CCl4组Chao1指数和Shannon指数显著高于溶剂对照组。PHI(20和40 mg/kg)处理组显著回复上述指标。PCoA图显示溶剂对照组、CCl4组和不同浓度PHI组之间肠道菌群发生变化(图7B)。这些结果证实了在肝纤维化的过程中微生物菌群发生明显变化,PHI起到纠正的作用。
门水平,CCl4组厚壁菌门(Firmicutes)显著减少,变形菌门(Proteobacteria)显著增加(图7C)。PHI处理组显著逆转了上述菌门的相对丰度(图7D)。拟杆菌门/厚壁菌门在CCl4组显著增加,而PHI(20和40mg/kg)组显著降低(图7E)。

图7 PHI调节肠道菌群组成
7、PHI在属和种水平上改善CCl4诱导的肠道菌群紊乱
作者研究了CCl4和PHI处理后肠道菌群在属水平的具体变化(图8A)。属水平CCl4组(Eubacterium)_coprostanoligenes_group相对丰度增加(图8B)。PHI逆转了这种菌的丰度。PHI组Ruminococcaceae_UCG-014 and Lactobacillus相对丰度增加(图8B)。种水平CCl4和PHI组一些细菌丰度发生变化(图8C)。CCl4增加了uncultured_bacterium_g_(Eubacterium)_coprostanoligenes_group相对丰度(图8D)。PHI逆转了该菌的丰度。PHI处理增加了uncultured_bacterium_g_Ruminococcaceae_UCG-014相对丰度(图8D)。
LEfSe分析与上述结果相似(图8E)。结果表明正常对照、溶剂对照组、CCl4、CCl4+10mg/kg PHI、CCl4+20mg/kg PHI和CCl4+40mg/kg PHI组富集的差异菌为12、3、3、9、2和12个(图8F)。
综上所述,这些结果进一步说明PHI通过肠道菌群来减弱CCl4诱导的肝纤维化。
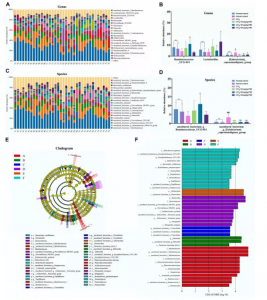
图8 PHI调节肠道菌群组成
8、功能预测和相关性分析
作者通过KEGG和COG数据库预测了微生物的功能(图9A和B)。CCl4处理组富集的通路为energy production and conversion、membrane transport和signal transduction mechanisms。肝纤维化小鼠PHI处理后,微生物富集的通路为carbohydrate transport and metabolism、lipid transport and
metabolism、metabolism of cofactors and vitamins、defense mechanisms、transcription和coenzyme transport and metabolism。
随后分析血清生化指标与肠道菌群相关性。如图9C所示,Phascolarctobacterium与ALP、ALT、MIP-1、LPS、AST、TNF-α显著负相关。Roseburia与ALT显著负相关。Rodentibacter与ALP、AST和TNF-α显著正相关。此外还分析了肝脏生化指标与肠道菌群相关性。如图9D所示,Phascolarctobacterium与HYP、α-SMA、Collagen Ⅰ、HAase、LN 和IV-C显著负相关。Roseburia与HYP、HAase和LN显著负相关。Escherichia与HYP、α-SMA、Collagen Ⅰ和HAase显著正相关。Rodentibacter与HYP、α-SMA、Collagen Ⅰ、LN 和IV-C显著正相关。
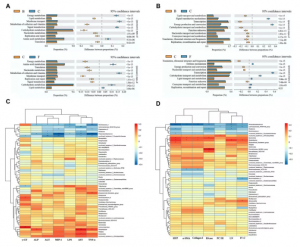
图9 肠道菌群功能预测及相关性分析
9、RT-qPCR
首先,作者分析了α-SMA和Collagen I的mRNA表达情况。如图10A所示,与溶剂对照组相比CCl4组α-SMA和Collagen I表达显著升高。随后研究了IL-1β、IL-6和TNF-α 三种炎症因子mRNA表达情况。如图10B所示,与溶剂对照组相比CCl4组肝脏IL-1β、IL-6和TNF-α mRNA表达水平升高。
肠道屏障的破坏是肝纤维化的一种重要的肠道改变。因此采用RT-qPCR检测和量化肠道屏障重要的标志物ZO-1、 Occludin和Claudin-1。如图10C所示,相比于溶剂对照组,CCl4组ZO-1、 Occludin和Claudin-1基因表达显著降低。
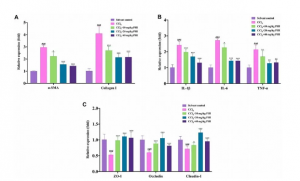
图10 溶剂对照组、CCl4、CCl4、CCl4+10mg/kg PHI、CCl4+20mg/kg PHI和CCl4+40mg/kg PHI组mRNA相对表达量
总结
给药PHI可通过调节炎症和肠道微生物减少CCl4诱导的肝纤维化。综上所述,作者研究清楚并证明了PHI可以改善CCl4引起的肝脏组织病理损伤、肝功能异常、胶原沉积、内毒素血症和纤维化。通过16S rRNA测序和分子生物学分析探讨了分子机制,PHI的肝脏保护作用涉及调节炎症和肠道菌群。本研究可能为PHI在CCl4诱导的肝纤维化中的治疗策略提供一种潜在的新思路。








 京公网安备 11011302003368号
京公网安备 11011302003368号