在瘤胃中的短链脂肪酸(SCFAs)对反刍动物的生长和健康起着关键的作用,微生物G蛋白偶联受体(GPR)和微生物脱乙酰化酶(HDAC)可能是这些影响的主要调节通路。该研究主要是选用不同比例非纤维碳水化合物摄入(15-30%)的山羊模型,通过转录组测序和16srRNA测序联合研究瘤胃上皮细胞和瘤胃微生物协同的响应机制。通过研究发现,瘤胃中微生物来源的SCFAs对上皮细胞的生长和代谢受到GPR和HDAC调节网络的影响,通过对这些调控机制和饮食组成的相互关系的理解,可更深入的了解瘤胃的新陈代谢机制,更好的促进牧业的发展。
样品取材:共6只雄性山羊,随机分为两组,第一组饲养为65%的干草+35%的饲料(MC组),另一组为90%的干草+10%的饲料(LC组);喂养28d后进行取样。
微生物多样性样品:饲养第28天,在清晨喂养0h、2h、5h以及8h进行取样,瘤胃内容物用4层纱布取样 ,收集瘤胃液15ml,-20℃保存用于提取。
转录调控测序取样:取10cm2瘤胃组织,用冷却的PBS进行清洗,去除肌肉层,取上皮组织切块于TRIzol保存液保存。液氮速冻5min后,-80保存用于RNA提取。
短链脂肪酸(SCFAs)浓度测定:上述样品加入5%HgCl2用于浓度测定。
测序分析:
瘤胃内容物微生物多样性测序:细菌V3+V4区、Illumina Miseq 平台测序
瘤胃上皮细胞转录组测序测序: PE125 测序、Illumina Hiseq2500 平台测序
1、短链脂肪酸(SCFA)浓度变化分析:
饲养不同处理组(MC和LC)、喂养取样不同时间点间瘤胃内总短链脂肪酸(SCFA)、PH以及短链脂肪酸(SCFA)主要成分的变化情况进行分析,如下图。
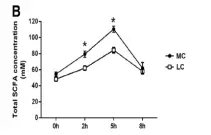
图1.1 总SCFA变化情况
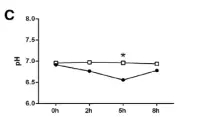
图1.2 PH变化情况
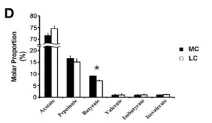
图1.3 SCFA主成分变化情况
2、瘤胃微生物多样性分析:
2.1细菌群落结构分析
在细菌门水平,一共有14个原核的门被鉴定,主要是厚壁菌门(35.7-30.1%),拟杆菌门(26.6-43.6%)、互养菌门(11-7%),且通过门水平维恩图分析发现,在两组(MC和LC)间门水平组成相同,比较分析两组间微生物变化情况发现(如图:FIG2),MC组相比于LC组,互养菌门增长了57%,无壁菌门增长了330%。而黏胶球形菌门降低了63%,纤维杆菌门降低了65%;

图2.1 两组间门水平Venn图分析
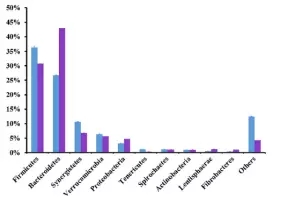
图2.2 两组间门水平OTU分析
在细菌属水平。共鉴定出75个属水平细菌,在两组间共有70个属,在MC组有三个特有的属,在LC水平有2个特有的属,普氏菌属(10.4-17.9%)在两组间都为主要属水平的菌。
图3.1 两组间属水平Venn图分析
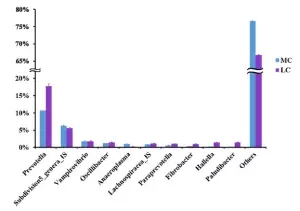
图3.2 两组间属水平OTU分析
2.2 微生物群落的多样性和丰富性
在门水平,MC组的拟杆菌门和厚壁菌门显著性高于Lc组(P<0.05),互养菌门显著性低于Lc组(如下图4),通过最大似然法(ML)计算27个丰度大于1% 的OTU进行分析显示,在MC组显著增加的OTU属于子单胞菌科,疣微菌科、韦荣球菌科、疣微菌门,相反的,58%(7/12)显著降低的OTU属于普雷沃氏菌科(如下图5);
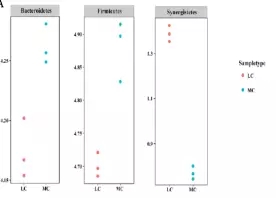
图4
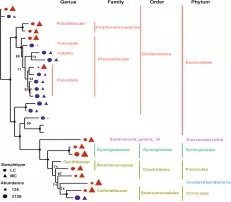
图5
3.瘤胃表达谱分析:
3.1 瘤胃上皮细胞GPRs和HDACs的表达谱分析
RNA-Seq测序方法用于研究山羊瘤胃微生物G蛋白偶联受体(GPRs)和微生物脱乙酰化酶(HDACs)表达情况以及调控网络,过滤得到127M clean data,平均有83%数据比对到NCBI山羊参考基因组,得到73个GPR家族成员和11个HDAC家族成员比对到山羊基因组,转录组数据分析发现有20个GPR家族成员和7个HDAC家族成员在瘤胃上皮细胞中表达。通过比较LC组中基因的表达发现GPR1,87,89A,155显著上调(P<0.05),在MC组中GPR107,游离脂肪酸受体4(FFAR4, also known as GPR120),羟基烃酸受体2(HCAR2, also known as GPR109A)显著上调(P<0.05),通过组内基因表达分析,在两组内都发现GPR家族中GPR87表达*高,HDAC家族中HDCA1的表达*高
3.2 GPRs和HDACs保守序列分析
为了研究GPR和HDAC在进化过程中差异表达的保守序列,通过用所有基因进行ML进化树分析,所有的 GPRS和HDACS在脊椎动物门都是高度保守的。研究GPR家族内成员的保守序列发现,在GPR家族成员没有超过30%的相似性,在HDAC家族成员之间也发现了同样的结果。
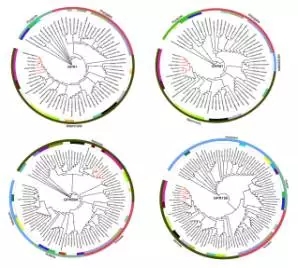
图6
3.3 差异表达的GPRS和HDACs基因相关KEGG通路分析
为了研究GPR和HDAC共表达网络的生物学意义,改研究注释了相关的信号通路和KEGG功能,发现显著差异的邻近基因被分类到瘤胃上皮细胞的生理调节过程,因此发现了两类和上皮细胞生长调节有关系的功能网络,其中一类是上皮细胞生长网络(包括细胞凋亡,增殖和分化,见下图7),另外一类是上皮细胞的代谢网络(包括辅酶因子和维生素代谢,能量代谢、氨基酸代谢等,见下图8);
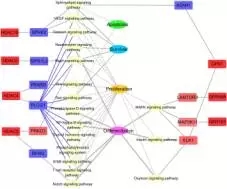
图7:上皮细胞生长网络图
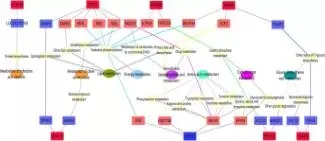
图8:上皮细胞代谢网络图
在上皮细胞生长网络中,基因GPR1,89和155的表达上调导致LAMTOR3蛋白,蛋白激酶和ELK1表达上调,这三种蛋白都存在于MAPK信号通路上,和细胞的增殖分化有关。此外,GPR1的 表达增加和酸性酰胺酶(ASAH1)的下调相关,ASAH1存在于调节细胞凋亡、生存和增殖的信号通路上。对于HDACs家族基因HDAC4,5,6和10基因的上调和五个调节细胞凋亡,生存和增殖基因的下调有关。
在上皮细胞代谢网络中,GPR1、87和89A基因的上调表达与辅酶2、4以及4L(ND2,4,4L),ATP5H,NDUFA4有关,HDAC1的下调表达ND6的上调表达有关。以上所有相关的酶都和能量代谢的氧化磷酸化有关。
4.转录调控和16s rRNA数据联合分析
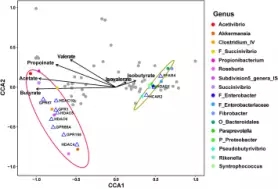
GPR和HDAC的表达、SCFAS主成分浓度比例以及属水平细菌相对丰度关系分析
通过CCA相关性分析发现,显著上调的GPRs和HDACs与8个显著增加的微生物属(56个 OTUS)是呈正相关,显著下调的GPRs和HDACs和9个显著减少的细菌属呈正相关(63个OTU),然而HDAC1与丁酸盐的比例呈负相关。
该研究得到的结果揭示,SCFA调节的GPR和HDAC共调控网络存在于瘤胃的上皮细胞,该共调节网络作用可作用于动物敏感√确地接受微生物区的信号调节,这些调控网络调节上皮细胞各种生理学过程,尤其是细胞的生长和新陈代谢,在促进动物的生长和维持上皮细胞的完整性起到关键的作用。此外,这些调控网络重要的调控机制对于共生的细菌来说,主要通过调节上皮细胞生理过程提高细菌在宿主中的共生条件。通过了解宿主动物和微生物区之间互相的调节机制,加上相应饮食中的外界干预调节因素,可以可持续性的更好的提高动物的健康和生长。
Hong Shen, Zhongyan Lu, Zhihui Xu, Zhan Chen,nd Zanming Shen Associations among dietary non-fiber carbohydrate, ruminal microbiota and epithelium G-protein-coupled receptor, and histone deacetylase regulations in goats.Microbiome.2017;5:123







 京公网安备 11011302003368号
京公网安备 11011302003368号