文章题目:Gut microbial metabolism of 5-ASA diminishes its clinical efficacy in inflammatory bowel disease
中文题目:5-ASA的肠道微生物代谢降低了其在炎症性肠病中的临床疗效
发表期刊:nature medicine
发表时间:2023
影响因子:82.9
研究背景
炎性肠病 (IBD)是一种慢性、使人虚弱的胃肠疾病,治疗失败率较高。目前尚无系统的方法预测对IBD疗法的反应。抗炎药物美沙拉嗪,也被称为5-氨基水杨酸 (5-ASA),是IBD最常用的处方疗法之一,通常在结肠内发挥作用;然而,随着时间的推移,超过一半的IBD患者对5-ASA没有反应或最终失去反应。因此,有必要确定并消除此类治疗失败的原因。
研究思路
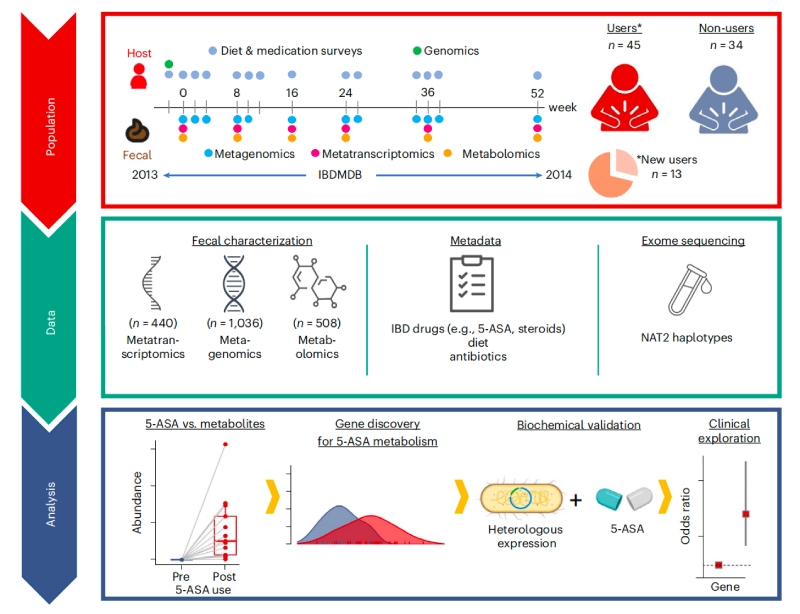
研究重点
1、来自IBD患者的多组学研究确定了5-ASA的使用
利用人类微生物组项目炎症性肠病多组学数据库(IBDMDB,http://ibdmdb.org),对79名克罗恩病(CD)或溃疡性结肠炎(UC)患者的粪便样本进行多组学分析,共鉴定了1036个宏基因组(MGX)、440个元转录本(MTX)和508个非靶向代谢组(MBX),以及283个MBX-MGX对和213个MGX-MTX对。随后针对13名新使用5-ASA的患者来确定5-ASA在体内直接调节的特定粪便代谢物,结果发现5-ASA使用前后中的5-ASA和N-乙酰5-ASA水平呈显著差异,且经5-ASA治疗后,赖氨酸合成途径中的细菌代谢产物—2-氨基己二酸的含量减少,烟酸代谢也发生了显著变化。
进一步评估微生物、宿主和其他因素对这些差异显著的代谢物的相对贡献,最终发现5-ASA的药物水平在确定5-ASA调节代谢物水平方面具有最大的预测能力(35%),其次是微生物组特征(15%)和其他宿主因素(7%)。随后,通过另一个独立的IBD患者队列中鉴定并验证了两种可能的5-ASA衍生物—N-丙酰基5-ASA和N-丁酰基5-ASA,它们的变化可以部分地由肠道微生物组来解释。
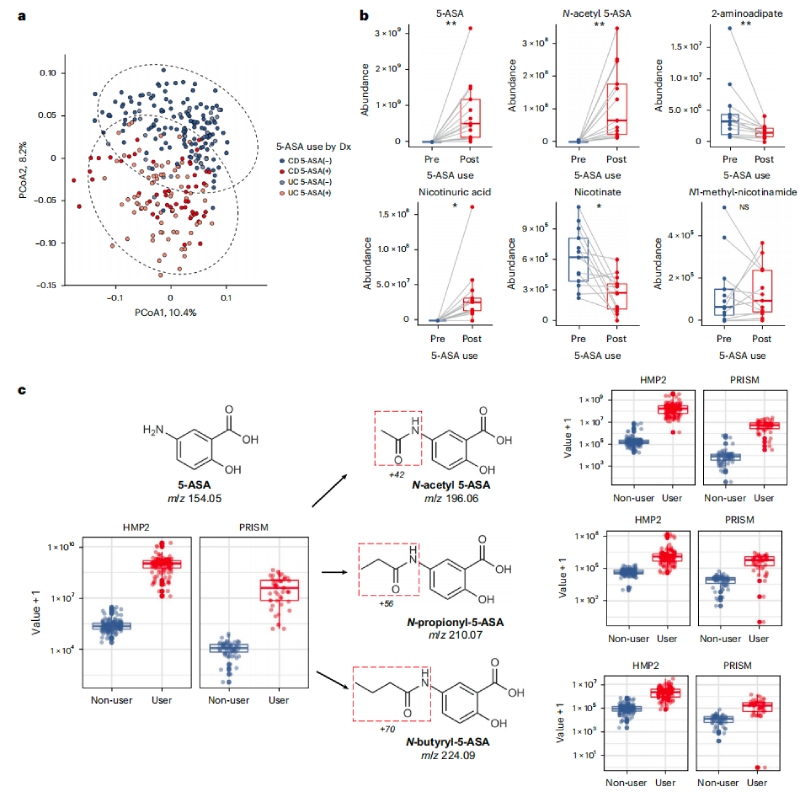
图1 5-ASA可直接影响粪便代谢组,并通过微生物组进行生物转化
2、5-ASA代谢肠道微生物酶的鉴定
接下来确定参与5-ASA生物转化的肠道微生物酶。首先对服用及未服用5-ASA的患者微生物进行转录组分析,最终鉴定了两个显著过表达的具有推定乙酰转移酶功能的UniRef90基因簇:GNAT家族NAT(UniRef90 ID: C7H1G6)和乙酰辅酶a乙酰转移酶(UniRef90 ID: R6TIX3),以及四个具有乙酰辅酶a乙酰转移酶结构域的候选基因(IDs: R6CZ24, R5CY66, T5S060和A0A1C6JPG6)。随后将粪便样本分为N-乙酰5-ASA高水平和N-乙酰5-ASA低/阴性水平两组,计算与N-乙酰5-ASA相关的每个元转录组基因簇的敏感性和特异性,结果发现了另外7个假定的乙酰转移酶基因簇与使用者的N-乙酰5-ASA水平呈正相关。最终得到的12个之前未被表征的候选乙酰转移酶可分为硫解酶和酰基辅酶A N-酰基转移酶两组,其中酰基辅酶A NAT家族比硫解酶家族表现出更大的序列异质性,且酰基辅酶A NAT酶几乎都来自拟杆菌门,而硫解酶来自厚壁菌门。通过研究菌株水平的基因组,同样发现了一部分普氏镰孢菌株编码相关的乙酰转移酶。
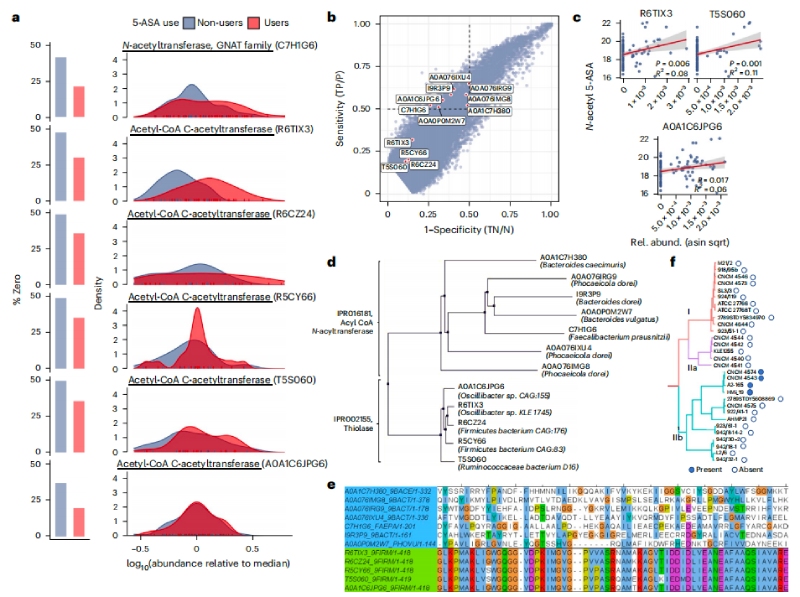
图2N-乙酰5-ASA微生物酶包括硫代酶和酰基辅酶A N-乙酰转移酶
3、5-ASA失活酶生化特性的推定
为了推测硫解酶和酰基辅酶A NAT超家族具有潜在的5-ASA灭活能力,选用来自厚壁菌门的候选硫解酶CAG:176(UniRef90 ID: R6CZ24)和来自福氏假单胞菌的酰基辅酶A NAT(UniRef90 ID:C7H1G6)用于进一步的生化表征。用已知的肠道链球菌酶作为阳性对照,对乙酰化5-ASA采用体外质谱分析,最终证实了厚壁菌CAG:176硫解酶和F. prausnitzii酰基辅酶A NAT具有使用乙酰辅酶A乙酰化5-ASA的能力。
随后测试了硫解酶对其他含胺基异生素(包括5-ASA异构体4-ASA、异烟肼、普鲁卡因胺和肼屈嗪)的乙酰化活性,结果并未发现这些化合物的任何乙酰化,这表明了硫解酶的底物选择性。此外,编码第二个预测的硫解酶基因(R6TIX3)的Oscillibacter sp菌株KLE 1745的活培养物也能够将5-ASA乙酰化为N-乙酰基5-ASA。
为了深入了解厚壁菌CAG:176硫解酶(FcTHL)如何乙酰化5-ASA,将FcTHL的乙酰化未配体晶体结构叠加在乙酰化硫解酶晶体结构上,与来自充分表征的革兰氏阴性分枝菌(ZrTHL)的乙酰辅酶A复合。随后将FcTHL与NAT (PDB ID: 2PFR)的晶体结构进行比对,进一步探究厚壁菌CAG:176硫解酶的推定活性位点是否类似于肠道链球菌NAT的活性位点,最终揭示了活性位点区域中的半胱氨酸和组氨酸三联体。
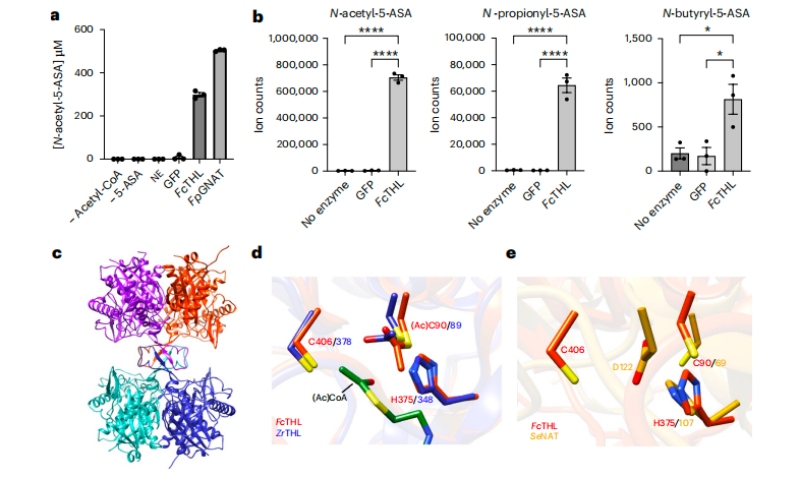
图3 5-ASA在体外的乙酰化活性的证实
4、IBD治疗失败与5-ASA代谢酶的宏基因组携带有关
基于临床服用5-ASA的个体差异性,接下来检查12种乙酰转移酶的存在是否与5-ASA治疗失败有关。收集39名在任何时间点接受5-ASA治疗及使用类固醇患者的609份粪便样本,使用多变量逻辑回归模型,调整与疾病风险相关了因素-年龄、性别、吸烟状况和IBD亚型,纳入每个参与者的NAT2表型来解释宿主遗传,最终发现粪便样本中存在4种乙酰转移酶基因与类固醇起始风险增加显著相关。4种乙酰转移酶基因有三种来自硫解酶超家族,一种来自酰基辅酶A超家族。且较早的发病年龄和CD与UC状态相比,同样与开始使用类固醇的更高风险显著相关。但未发现类固醇使用风险和大肠杆菌NAT的宏基因组存在联系。
在敏感性分析中,微生物乙酰转移酶基因数量的增加与类固醇起始风险的增加显著相关;从未使用过5-ASA治疗的患者基因家族与类固醇的使用没有正相关。随后使用混合效应模型对参与者进行调整,发现存在三个或更多乙酰转移酶基因也与类固醇使用风险增加相关,这在随后在未使用类固醇的208名5-ASA使用者队列中得到了验证。
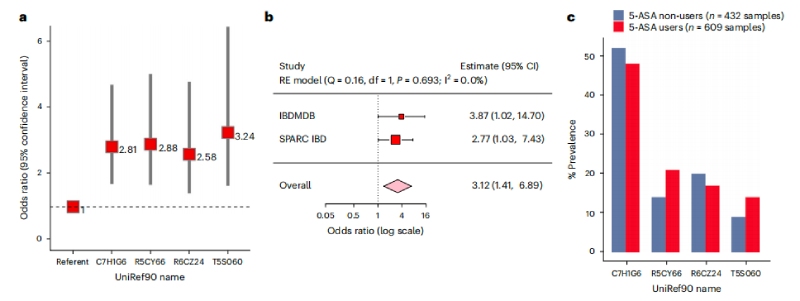
图4肠道微生物5-ASA灭活乙酰转移酶与5-ASA使用者治疗失败的更大风险相关
研究总结
本研究结果首次提供了特异性肠道代谢酶与IBD 5-ASA治疗失败之间的直接联系,从而产生了直接的临床潜力。5-ASA是UC最常用的处方药。为了保持有效,它必须以未修饰的形式存在于结肠腔中,因此,与其他药物不同,它在小肠中的吸收很差。5-ASA治疗失败的个体通常进展为风险更高的免疫抑制治疗,而只有在必要时 (即肠道微生物组中存在修饰5-ASA的硫解酶序列)才有能力这样做,这将为精准医学提供有价值的生物标志物。此外,阐明微生物失活5-ASA的酶学机制可能有助于未来研发微生物特异性酶抑制剂,以增强5-ASA的疗效。在本研究中,我们的数据是观察性的;需要更多的介入研究来加强我们的发现,无论是通过在IBD患者中的临床试验还是通过单定植小鼠。目前,这些发现为IBD的个性化微生物医学打开了一扇概念之窗。







 京公网安备 11011302003368号
京公网安备 11011302003368号