文章题目:干旱胁迫下玫瑰根和叶的生理特性变化及全长转录组
发表期刊:Plant and Cell Physiology
发表时间:2020年10月
影响因子:4.799
研究背景
干旱或缺水引起的脱水是世界上许多地区植物面临的一种严重的非生物胁迫,严重制约着植物的生产力和生存。许多生物化学、生理和遗传性状已在不同的植物组织中进化出来,特别是根和叶,以应对干旱胁迫。根是感知水分缺乏最敏感的器官,并相应的调节水分和养分的吸收。在有限的水分条件下,它们可以通过表型和结构上的改变来增加枝条和叶片对水分的吸收,以维持正常的水分利用。叶片是光合作用和蒸腾作用的主要器官,调节水分的吸收和流失。叶片对干旱的反应是萎蔫、气孔关闭、角质层蜡沉积和减少光合作用,以减少水分的过度流失。因此,根系和叶片是调节水分在土壤和水分之间流动的最重要器官,但其对干旱胁迫响应的分子机制尚不清楚。
玫瑰是园艺作物之一,无论是盆栽植物和切花在招待、娱乐和保健行业都有相当大的经济价值。由于玫瑰生长在亚热带气候,对干旱和水分亏缺非常敏感,严重限制了其生长和开花。此前对玫瑰花瓣的转录组分析已经确定了对疾病响应、盐度和热胁迫以及与花色相关的基因。然而,玫瑰植株对干旱胁迫的分子响应仍有待进一步研究。
高通量RNA测序(RNA-seq)已经在杨树和玉米中鉴定了许多干旱响应基因。然而,传统的RNA-seq产生的短读序列并不包含完整的转录本,因此在预测新基因方面准确性较低。PacBio和Oxford Nanopore Technology (ONT)是一种新颖的RNA-seq方法,可以通过高通量产生长读来读取全长转录本,从而重构编码基因组。此外,ONT可以直接对RNA进行测序,并识别碱基修饰、可变剪接、聚腺苷酸化、和融合基因。因此,ONT RNA-seq在探索粮食作物和园艺作物抗旱性的分子机制方面很有前景。
在这项研究中,通过对正常、轻度和重度干旱条件下生长的玫瑰幼苗的光合速率和植物激素水平进行监测,并采用ONT法对其全长转录本进行测序。通过对转录组数据的分析,既丰富了已注释的玫瑰基因组,又为激素在干旱胁迫中的潜在作用提供了新的认识,同时也识别出了在应对干旱胁迫时激活的新的调控网络。这项研究提供的数据可以为开发新的转基因耐旱玫瑰品种铺平道路。
材料和方法
样品做了三组处理:干旱处理0天(ND stress)、5天(MD stress)和10天(SD stress),并对光合作用进行了检测,同时检测了脱落酸(ABA)和生长素(auxin)的含量。
结果分析
1.干旱胁迫对玫瑰幼苗生长发育和形态的影响
以2月龄玫瑰幼苗为材料,在不干旱(ND)、轻度干旱(MD)和SD胁迫条件下,对其相对含水量(RWC)和光合特性进行了分析。与ND对照相比,MD和SD植株的RWC分别下降到41%和15%(图1A)。此外,定期浇水的植株看起来健康,叶子呈绿色/深绿色,而暴露在MD胁迫下的幼苗变黄,一些叶子弯曲并枯萎(图1A)。另一方面,SD条件导致叶片大面积枯萎和卷曲(图1A)。与此相一致的是,SD胁迫下幼苗的鲜重和干重均显著低于ND和MD组(图1B),说明过度脱水会降低养分吸收和植物生长。
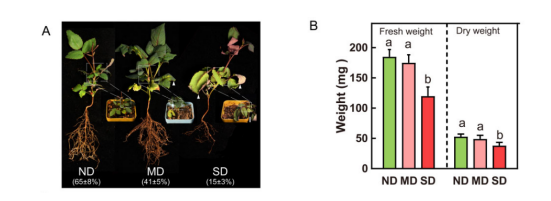
图1 干旱胁迫下玫瑰幼苗的形态变化
2.全长RNA-Seq及功能注释
为了阐明干旱响应的分子机制,对不同处理植株的叶(L)和根(R)进行了转录组测序。6个样本(每个样本3个生物重复)共18个cDNA文库,包括ND-L、MD-L、SD-L、ND-R、MD-R和SD-R。从最初的116,192,367 raw reads中,提取了115,374,531 (99.29%) clean reads,组成玫瑰全长非嵌合转录组。通过与Rosa chinensis 基因组比对,在转录组中鉴定出了48,549个基因,占基因组长度的21.46%。此外,共鉴定出59,404个开放阅读框(ORF),如图2A所示,只有19个编码序列(CDSs)编码>800个氨基酸的多肽,而58%的CDSs编码长度在100 – 400个氨基酸的小肽(图2A)。最后,89,044个非冗余转录本中的58,753个可以被注释到不同的数据库中(图2B)。
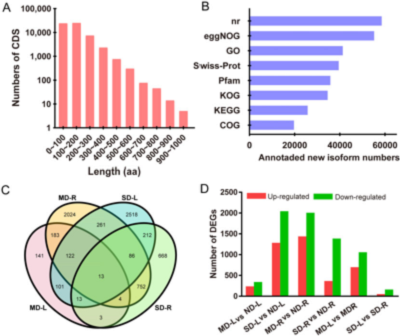
图2 干旱胁迫下玫瑰叶片和根中的DEGs
3.DEGs的比较分析
为了进一步阐明干旱诱导的玫瑰叶片和根的转录组变异,相对于ND,筛选出了MD和SD样品的DEGs。从18个cDNA文库中检测到48,549个基因的表达量,根据错误发现率(FDR) (≤0.01)和log2值(≥2或≤0.05)鉴定出7,101个DEGs,其中669个(~9.4%)为新基因。此外,这些DEGs大部分在同一组的叶片和根中表现出不同的表达模式。MD和SD组叶片分别鉴定出580和3,326个DEGs,而与其对应的根部样品分别鉴定出3,445和1,751个DEGs,这表明干旱响应的转录机制在根中占主导地位(图 2C)。此外,在MD叶片和根中分别有237个和1438个基因表达上调,343个和2007个基因表达下调。意料之中的是,SD条件下导致了总体上更大的转录组变化,在叶片中有1284个上调基因和2042个下调基因,在根中有365个上调基因和1386个下调基因(图2D)。与SD-L、MD-R和SD-R相比,在MD-L中分别鉴定出331、258和547个特异基因,与SD-L相比,MD-R中有2963个特异基因。此外,有855个基因在MD-R和SD-R中均存在,而所有组中共有的基因只有13个(图2C)。编码脂质转运蛋白、早期光诱导蛋白、线粒体磷酸载体蛋白、锌指蛋白和谷胱甘肽s转移酶的DEGs主要集中在SD组,而细胞分裂控制蛋白在MD条件下诱导发生。
4.GO和KEGG富集分析DEGs
通过GO富集分析,将玫瑰叶片和根系干旱诱导基因分为生物过程(BP)、细胞成分(CC)和分子功能(MF)注释。在MD-L中特异的干旱应答基因富集在生物过程(天冬酰胺生物合成过程、钙离子跨膜运输)、分子功能(天冬酰胺合成酶(谷氨酰胺水解)活性、β-amyrin合成酶活性)以及细胞成分( COPII囊泡外壳)中。这些GO基因也在SD-L、MD-R和SD-R组中富集,表明这些基因可能参与信号转导通路或其他响应干旱胁迫的调控网络。随后的KEGG富集分析显示,在MD胁迫下的玫瑰幼苗叶片在碳代谢(ko01200)、核糖体(ko03010)和aa的生物合成(ko01230)等方面的DEGs与其他样品有显著差异。受SD胁迫影响的基因主要涉及淀粉和蔗糖代谢(ko00500)、植物激素和信号转导(ko04075)、核糖体(ko03010)、光合作用(ko00195)、碳代谢(ko01200)等。玫瑰幼苗根系中MD的响应基因影响内质网中的碳代谢和蛋白质加工。受MD和SD影响显著的基因在苯丙素合成、植物激素和信号转导、内质网蛋白加工等方面具有重要作用。综上所述,调控碳代谢、植物激素合成和信号转导的基因受到干旱胁迫的影响,可能在叶片和根的适应反应中发挥关键作用。
5.干旱胁迫降低了玫瑰的光合性能
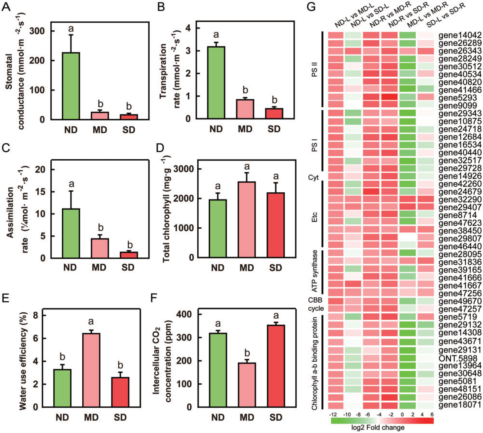
图3 干旱胁迫下玫瑰叶片光合作用的变化
鉴于玫瑰叶片在干旱胁迫下显著枯萎(图1A),因此对ND、MD和SD生长条件下叶片的光合参数进行了研究。虽然所有组的总叶绿素含量没有显著差异(图3 D),但干旱胁迫显著降低了Pn、Gs和Tr指数,在SD胁迫下降低的幅度比 MD更严重(图3 B、C、F)。叶片中的Ci水平对MD和SD胁迫有不同的相应。MD处理下的平均Ci降低了111 μmol/mol,长期干旱后Ci值增加了62.33μmol/mol,恢复正常。由此可见,干旱胁迫不利于玫瑰植株的光合性能,限制了叶片的生长。MD条件下的水分利用效率(WUE)高于ND和SD(图3E),说明轻度水分亏缺增加了叶片有效利用水分的能力。为了进一步阐明其分子机制,对与光合作用途径相对应的转录组数据进行了分析。干旱胁迫下与光合作用相关的DEGs包含编码PS II、PS I、叶绿体三磷酸腺苷(ATP)合酶亚基(ATP合酶)和叶绿素a/b结合蛋白。如图3G所示,几个PSII(gene 14042,gene 26289等)、PS I (gene 29343,gene 10875等)和ATP合酶(gene 28095, gene 31836等)基因在SD胁迫下表达下调至少0.5倍(图3 G)。综上所述,干旱胁迫诱导了玫瑰叶片的光合动态在转录水平上的变化。
6.干旱胁迫使脱落酸和生长素浓度增加
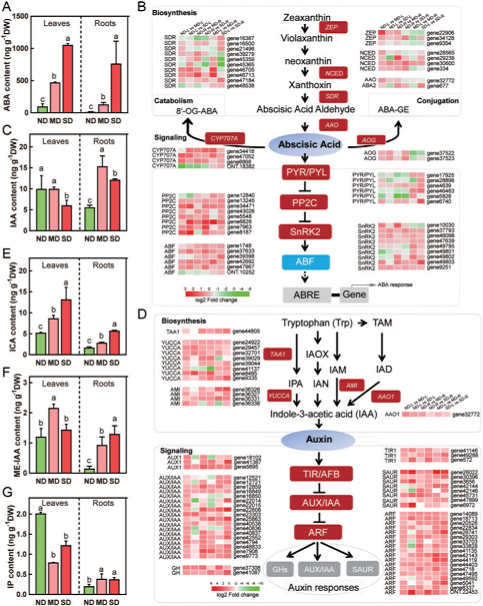
图4 干旱响应DEGs调控ABA和生长素的生物合成及信号通路
KEGG分析显示,干旱胁迫下植物激素和信号转导通路(ko04075)显著富集。ABA和生长素是干旱胁迫下调节植物生长发育的主要激素,因此对干旱胁迫下玫瑰叶片和根中的这两种激素的水平进行了检测。ABA含量在干旱条件下急剧增加,并在长期(SD)胁迫下达到峰值(图4A)。与对照相比,MD和SD环境下叶片中吲哚-3-甲醛(ICA)的含量分别上升3.44和7.96 ng/g,根中分别上升1.15和4.02 ng/g(图4 E)。长期干旱胁迫下叶片中吲哚乙酸(IAA)含量显著下降,根系中IAA含量在MD中增加,而在SD中下降(图4 G)。相比之下,干旱胁迫下的玫瑰幼苗叶片和根中ME-IAA含量均显著增加,且与SD相比,MD胁迫下叶片中ME-IAA含量更高(图4 F)。最后,在干旱胁迫下,叶片中的IP浓度显著降低,而根系中的IP浓度显著升高(图4 G)。在任何条件下都不能检测到IBA水平。综上所述,干旱胁迫触发了玫瑰叶片和根部的激素变化,以维持生理过程。
7.DEGs参与ABA和生长素的生物合成及信号通路
与上述结果一致的是,干旱响应的DEGs在类胡萝卜素生物合成(次生代谢产物)、ABA生物合成和ABA信号通路中显著富集。转录组数据中监测到的ABA和生长素合成以及信号转导相关基因的表达模式(图4B, D),4个NCEDs,ABA合成的步骤,在MD-L和MD-R中诱导上调。转录本(gene 4639)编码PYR/PYL,是ABA信号通路的关键因子,在所有组中表达上调。9个ABA诱导的PP2Cs,包括4个抑制ABA信号、促进GA信号的HAI同源物和5个激活ABA和Snf1相关激酶OST1的HAB同源物在MD和SD胁迫下均显著上调。另外,SnRK2基因有2个在MD-L中上调(gene 10030, 2.45倍,gene 49803, 2.17倍),有3个在MD-R中上调(gene 10030, 4.81倍,gene 49802, 2.48倍,gene 49803, 2.91倍),有2个SnRK2基因在MD-L中下调(gene 49801, 0.17倍,gene 49802, 0.49倍)。最后,有3个ABF转录因子(gene 37633, gene 42692, gene 47967)在SD-L和SD-R 中上调,进而激活ABA响应基因。
丝兰黄素单加氧酶是生长素合成的核心酶,在MD-L、SD-L、MD-R和SD-R样品中均有高度诱导。TAA1控制阴暗条件下生长素的产生,并且在任何转录组中表达都没有差异。在生长素响应基因中,有6个SAUR基因在MD-L和SD-L下显著上调,2个基因下调(图4D)。一个生长素受体F-box 蛋白TIR1(gene 49288)在SD-L中诱导上调3.22倍,2个AUX基因(gene 18102和gene 55695)在MD-L中诱导上调2倍。2个与生长素信号传递相关的IAA-酰基酸-酰胺合成酶(gene 37308, gene 41087)也在干旱胁迫下被诱导。18个调控生长素反应的基因ARF差异表达:6个在SD-L和MD-R中上调,7个在MD-L和SD-L中下调。这些发现与干旱引起的生长素含量变化在前一节中的描述一致。
8.TFs 和IncRNA的鉴定
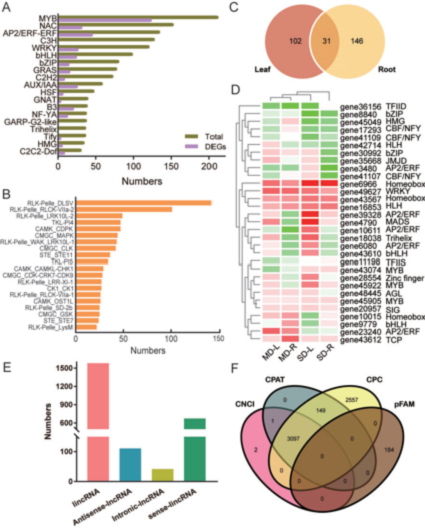
图5 TFs和IncRNA的鉴定
干旱胁迫显著改变了玫瑰叶片和根中与DEGs相关的279个转录因子的表达。MD和SD条件下,MYB、bHLH、b-ZIP、NF-Y、WRKY和AP2家族的TFs显著富集,其中MYB、AP2和WRKY占主导,差异表达的TFs分别为124、46和27个(图5A)。bHLH和WRKY家族对干旱胁迫的响应非常相似。在MD-L处理中,有少量的DEGs、上调基因,但有大量的下调基因。相比之下,SD-L处理在这些基因家族中导致了更多的上调基因,并且适应干旱后的叶片和根的干旱响应的倍数变化通常低于SD处理。如图5C所示,在干旱胁迫下,叶片和根中分别有133和177个TF基因差异表达(图5 C),其中31个基因是两个器官共有的且表达模式相似。例如,gene 6966和49627在MD和SD条件下,在叶片和根中都是表达上调。一些蛋白激酶家族,包括RLK/Pelle_DLSV(142个成员,玫瑰转录组中较大的家族)和RLK/Pelle_ RLCK -VIIa -2(101个成员)(图5 B),在玫瑰转录组中负责蛋白激酶的大小。
lncRNAs是非编码转录本,可调节顺式和反式基因的转录,从而控制组织发育的各个方面和对外部刺激的反应(Kim和Sung 2012)。我们利用Pfam、编码潜力计算器(CPC)、编码潜力评估工具(CPAT)和编码非编码索引(CNCI)数据库筛选了转录组数据,分别鉴定出184、5,803、3,247和3,100个注释转录本(图5 F),其中2,410个新的lncRNAs注释到了所有数据库(图5 E)。此外,这些常见lncRNAs中,65.64%(1582)为lincRNAs,4.61%(111)为反义lncRNAs,1.74%(42)为内含子lncRNAs,28%(675)为正义lncRNAs(图5 E)。我们还预测了2,403个lncRNAs的20,240个靶基因,其中537个和19,703个靶基因分别受反式和顺式lncRNA的调控。因此,这些lncRNAs可能在应对干旱胁迫时通过调控关键基因发挥重要作用。
9.干旱胁迫下玫瑰叶和根中DEGs聚类
接下来,根据RNA-seq数据鉴定了7101个DEGs,占本研究鉴定的所有基因的14.63% (7,101/48,549)。这些DEGs的热图表现出两个保守组,如在干旱胁迫下诱导和抑制根和叶的表达模式(图6 A)。然后使用K-means算法进行富集分析,得到16个聚类(K1-K16)(图6 B)。在SD条件下,K12、K13和K16基因主要在叶片和根中表达,表明它们可能参与干旱胁迫。而在MD和SD处理下,K4、K5、K7、K9和K11基因在根和叶中均受到抑制。
我们还通过加权相关网络分析来确定与干旱胁迫响应相关的基因簇或模块。所有基因聚类为33个模块(图6 C、E),其中tomato modules与SD-R、fire-brick与SD-L、light steel blue与MD-L、medium purple与ND-L和ND-R显著相关(图6 D)。各模块KEGG富集分析显示,干旱胁迫下大部分样品富集苯丙素生物合成(ko00940)和核糖体(ko03010),SD-R样品富集最显著的通路是内质网蛋白加工(ko04141)(图6 F)。综上所述,上述途径调节了玫瑰叶片和根系对干旱胁迫的响应。
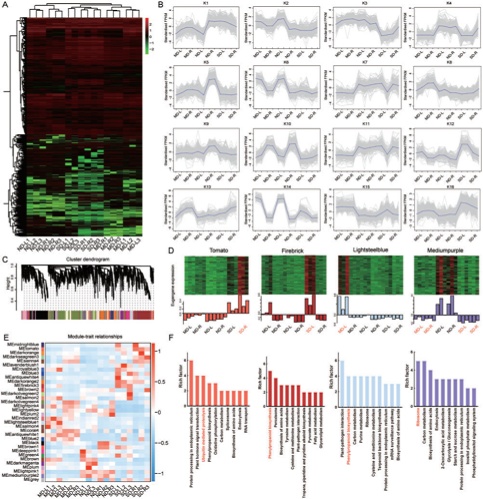
图6 干旱胁迫下DEGs的整体表达模式
10.可变剪接异构体及可变剪接的变化
RNA-Seq检测到的转录本与R.chinensis ‘Old Blush’基因组进行比对,鉴定剪接异构体。如图7 A所示,我们从非冗余转录本中检测到42,544个可变剪接(As),包括12,096个内含子保留(IRs)、12,914个选择性3’剪接位点(alt 3’)、7,433个选择性5’剪接位点(alt 5’)、9,406个外显子跳过(ES)和695个互斥外显子(ME)(图7 A)。IR在玫瑰叶片中最为常见,在ND-L、MD-L、SD-L和ND-R样品中的比例分别占34.77%、30.83%、30.1%和29.56%。而在SD胁迫下,ES是主要的AS模式(占所有AS事件的32.16%)。在MD-R中最常见的AS事件是alt 3’ (32.38%), ME(1.75%)是最罕见的(图7 B)。为了进一步验证新发现的转录组剪接异构体,我们随机选择了三个至少注释到两个异构体上的基因(ONT.25325、gene 3669和gene 4728)进行RT- PCR验证。在这些基因的第一个外显子和最后一个外显子或适当区域设计引物。如图7 C所示,片段的条带大小与转录组数据中发现的剪接亚型的条带大小一致。对推测的剪接异构体进行克隆、测序和比对,以验证剪接连接。例如,ONT. 25325编码了一个putative protein,呈现出4个剪接亚型(图7C),并随后得到证实。此外,gene 3669和gene 4728显示出相同的剪接变异。此外,一些剪接异构体,如gene 3669,在对照和干旱胁迫下表现出差异。新的可变剪接体的鉴定进一步注释了R.chinensis ‘Old Blush’基因组。
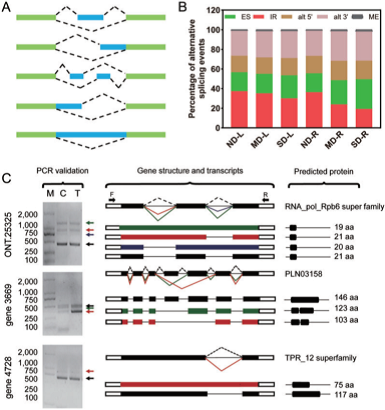
图7 干旱胁迫下AS表达谱
总结
作者分析了干旱引起的玫瑰幼苗叶片和根部光合作用和激素水平的变化,首次在MD和SD条件下建立了全长玫瑰转录组,并鉴定了组织特异性的干旱响应基因、TFs 、lncRNA和AS。鉴定出特定组织在不同干旱条件下参与光合作用,ABA和生长素生物合成和信号传导的基因模块,本研究中提供的信息补充了R. chinensis的现有注释,并为未来玫瑰植物抗旱性的机理和功能研究奠定了基础。
参考文献:Wei Li, Lufeng Fu, Ziwen Geng, Xiaojuan Zhao, Qinghua Liu, Xinqiang Jiang, Physiological Characteristic Changes and Full-Length Transcriptome of Rose (Rosa chinensis) Roots and Leaves in Response to Drought Stress[J], Plant and Cell Physiology, 2020.








 京公网安备 11011302003368号
京公网安备 11011302003368号