铁死亡(Ferroptosis)是近几年发现的一种新的细胞死亡方式,是指在小分子物质诱导下发生的氧化性细胞死亡,具有铁离子依赖性。近年来,铁死亡已成为当前生命科学与基础医学研究的一大热点,在近几年国家自然科学基金的资助项目中,铁死亡相关项目的比例呈指数增长。
2022年8月,百迈客合作客户中南大学湘雅医院眼科中心/湖南省眼科重点实验室夏晓波教授团队在《Nature》子刊《Cell Death & Differentiation》(IF:12.067,中科院一区)发表了研究成果“Pathologically high intraocular pressure disturbs normal iron homeostasis and leads to retinal ganglion cell ferroptosis in glaucoma”(病理性高眼压干扰正常铁稳态并诱导青光眼视网膜神经节细胞铁死亡),首次报道了铁死亡与青光眼发病机制的研究。百迈客为该研究提供了ONT全长转录组建库测序分析服务。
 研究背景
研究背景
病理性高眼压:青光眼是全球首位不可逆的致盲性眼病,可累及各年龄阶段人群,临床表现为进行性的视野缺损和视神经损害,视网膜神经节细胞(RGC,视网膜唯一的中枢传入神经元)的选择性和不可逆性丢失是青光眼病理损害的基础。病理性高眼压(pathological high intraocular pressure,ph-IOP)是青光眼发病的重要特征,也是导致青光眼RGC丢失的主要因素。通过药物或手术途径降低青光眼患者的ph-IOP是目前临床中治疗青光眼的唯一有效方法,但单纯控制ph-IOP并不能完全阻止青光眼RGCs的丢失,临床中很多青光眼患者在Ph-IOP控制至正常水平后,RGC丢失和视野损害仍在继续,其具体的原因尚不完全清楚并存有争议。
铁死亡:是近几年发现的一种新的细胞死亡方式,是在小分子物质诱导下发生的氧化性细胞死亡,具有铁离子依赖性,其发生是细胞内脂质活性氧(reactive oxygen species,ROS)生成与降解的平衡失调所致。铁死亡诱导剂通过不同的通路直接或间接作用于谷胱甘肽过氧化物酶(glutathione peroxidase,GPXs),导致细胞抗氧化能力降低、ROS堆积、最终引起细胞氧化性死亡。铁死亡不仅与众多疾病的发生发展有关,其相关信号通路上的关键蛋白也可成为药物的作用靶点,多种铁离子螯合剂以及亲脂性自由基捕获型抗氧化剂可以抑制这种细胞死亡
材料方法
1)Ph-IOP损伤模型构建:体内模型–利用盐水灌注系统,增加小鼠眼球前房压力,诱导Ph-IOP损伤;体外模型–R28细胞的氧糖剥夺/复氧(OGD/R)损伤模型;
2)ONT全长转录组测序:在ph-IOP损伤或假手术组(sham)诱导后24 h,收集小鼠视网膜,将4个单独的视网膜合并为一个样本,每组包含三个样本,分别进行ONT全长转录组测序。
3)指标检测:视网膜氧化应激–丙二醛(MDA)、烟酰胺腺嘌呤二核苷酸磷酸酯还原形式(NADPH)和谷胱甘肽(GSH);高效液相色谱HLPC–检测小鼠血清和视网膜的去铁酮(DFP,脂溶性铁螯合剂)给药后的浓度;视网膜形态分析–H&E染色测量小鼠视网膜切片的形态;铁离子检测–Perl’s染色法检测视网膜各层中铁的分布、使用Iron Assay Kit盒(MAK025;Sigma)测量血清和视网膜的铁水平(总铁、二价铁和三价铁);扫描透射电子显微镜TEM–测定RGCs具有铁浓缩特征的线粒体。
研究结论
1. 通过分析急性原发性闭角型青光眼(APACG,Ph-IOP损伤最典型的一类青光眼)患者外周血清铁离子含量发现,青光眼患者血清中三价铁离子含量较正常人群升高,推测铁代谢可能参与调控了ph-IOP条件下RGC的损伤过程;
2. 体外和体内实验证实了,ph-IOP可以在损伤早期导致细胞和视网膜内二价铁离子异常积累,损伤后8h血清中三价铁离子水平升高;
3. 进一步研究发现,核受体共激活剂4(NCOA4)介导的铁蛋白重多肽1(FTH1)的降解是导致ph-IOP损伤后视网膜内铁代谢紊乱的重要原因,体内敲低Ncoa4的表达可抑制FTH1的降解,并降低视网膜中二价铁的水平;
4. ph-IOP导致的铁代谢紊乱可以通过增加视网膜促铁死亡因子的表达,减少抑铁死亡因子的表达诱导RGC发生铁死亡,加重青光眼损伤;去铁酮口服后可有效通过血-视网膜屏障,ph-IOP损伤后螯合视网膜内异常升高的二价铁,抑制RGCs铁死亡,保护视觉功能。
总之,该研究首次揭示了NCOA4-FTH1介导的铁代谢紊乱及铁死亡在青光眼RGCs损伤中的作用,证明了去铁酮靶向抑制RGC铁死亡对青光眼的治疗作用,为从铁稳态及铁死亡途径理解和治疗青光眼提供了新的研究方向。
主要研究结果
1、Ph-IOP 损伤扰乱铁稳态
检测 APACG 患者和健康对照者的血清铁含量发现,APACG 患者血清的总铁和三价铁水平高于健康对照组(图1b),但二价铁含量的变化并不显著;与对照组相比,ph-IOP损伤体外模型组的细胞质中二价铁显著积累。
在ph-IOP损伤或假手术组(sham)诱导后24 h的小鼠视网膜进行ONT全长转录组测序分析,结果显示,在 ph-IOP 损伤后,29个铁代谢相关基因的转录水平显著改变(图1d);此外,与正常小鼠相比,ph-IOP 损伤后1h和8h,视网膜和血清总铁水平均升高(图1e, f)。这些结果显示ph-IOP 干扰了正常的铁稳态,导致体内和体外铁离子的显著积累,这主要发生在 ph-IOP 损伤后的早期。
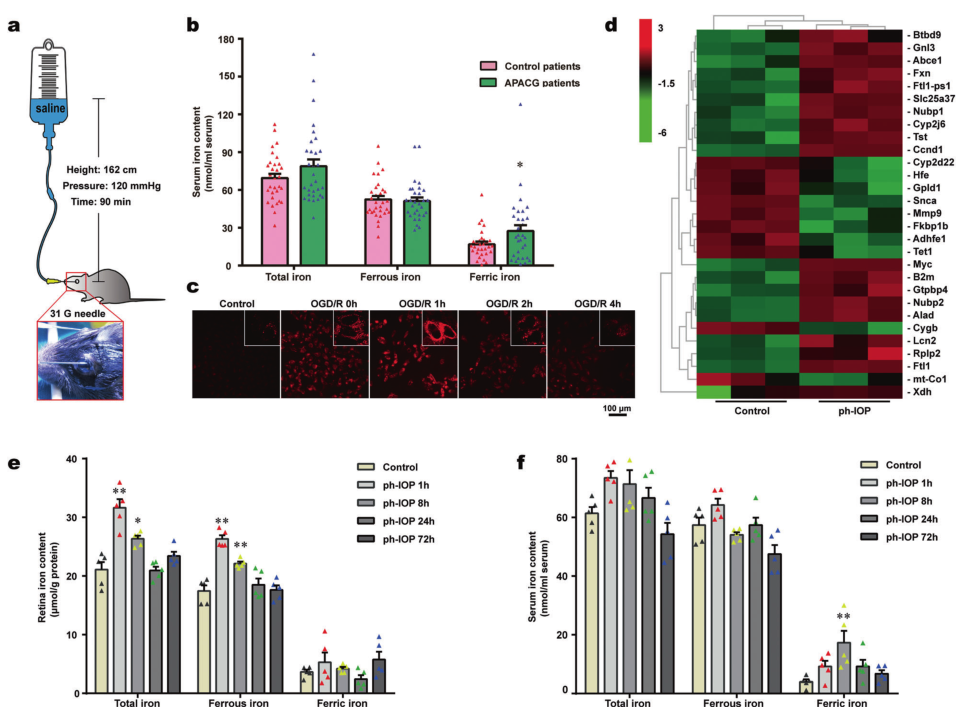
图1 ph-IOP损伤小鼠视网膜铁稳态分析
2、NCOA4介导的FTH1降解导致 ph-IOP 诱导铁离子积累
铁蛋白(Ferritin)是一种广泛存在的储铁蛋白,在 ph-IOP 损伤后1小时,FTH1(Ferritin亚基)的水平急剧下降(图2h),这与 ph-IOP 损伤后早期的铁积累一致;铁自噬(ferritinophagy)是一种调节细胞内铁代谢的选择性自噬,检测视网膜内源性NCOA4(铁自噬关键调节蛋白)蛋白水平发现,pH-IOP 损伤后NCOA4与 FTH1之间的内源性相互作用增强(图2i, j);敲降Ncoa4后增加了视网膜 FTH1水平(图2m-o),并伴随着 ph-IOP 损伤后视网膜中二价铁离子水平的降低(图2p)。
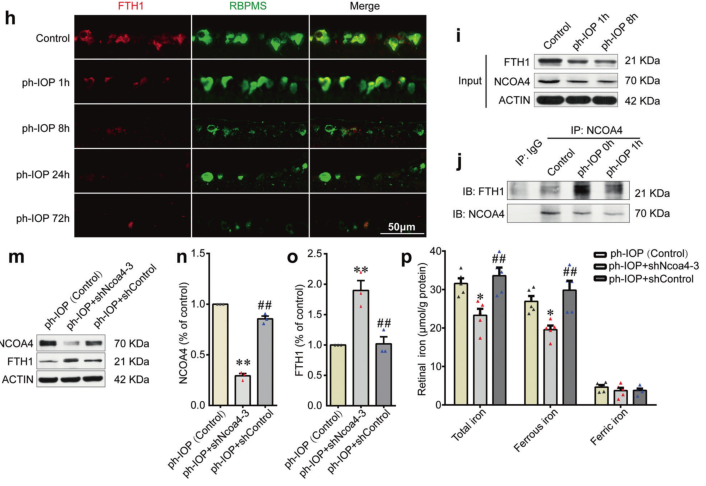
图2 NCOA4介导的FTH1降解导致 ph-IOP 诱导铁离子积累
3、Ph-IOP损伤诱导铁累积导致早期视网膜铁死亡
为了验证PH-IOP损失引起的视网膜铁积累可能导致视网膜铁死亡这一假设,测量了氧化应激相关生化指标,发现Ph-IOP损伤早期阶段MDA含量显著增加,而GSH和NADPH水平显著降低;进一步检测铁死亡核心标志物GPX4(抑铁死亡因子)和ACSL4(促铁死亡因子)发现,ph-IOP 损伤后24h,GPX4水平降低,在PH-IOP损伤后1h,ACSL4水平上调(图3d-f);并且这些铁死亡相关蛋白的变化主要集中在视网膜内层,尤其是神经节层(图3g, h),提示铁死亡诱导的细胞损伤可能集中在 RGC 中(位于视网膜最内层);TEM检测发现PH-IOP引起RGC线粒体收缩和线粒体膜密度增加,表明ph-IOP诱导的视网膜铁累积导致视网膜铁死亡,特别是在 RGC中。
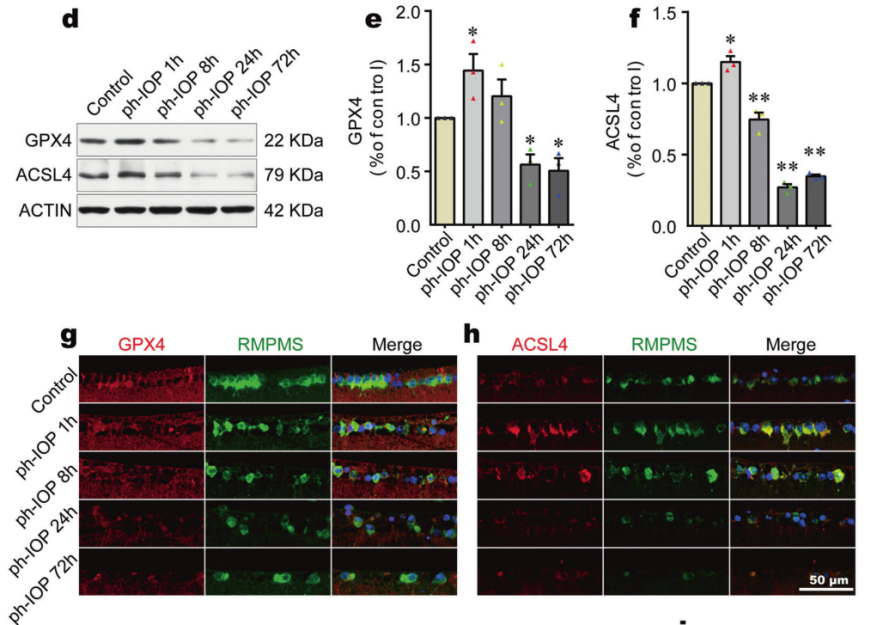
图3 Ph-IOP损伤诱导铁累积导致早期视网膜铁死亡
4、去铁酮减少Ph-IOP损伤诱导的铁离子累积
去铁酮DPF作为铁螯合剂目前已应用于临床治疗铁超负荷疾病,阻止患者血清铁的蓄积。进一步研究DFP对ph-IOP损伤小鼠铁代谢的影响。体内体外结果显示,DFP处理可以显著降低 ph-IOP诱导的视网膜二价铁累积;DFP治疗可降低ph-IOP损伤后视网膜MDA含量(图4a),增加GSH和NADPH水平(图5b, c );此外,在ph-IOP损伤小鼠中,DFP处理恢复了GPX4水平,并降低了ACSL4水平(图5d-e)。以上结果表明,DFP可以改善ph-IOP诱导的视网膜铁死亡。

图4 DFP减少Ph-IOP损伤诱导的铁离子累积
5、DFP抑制ph-IOP 损伤引起的RGC铁死亡
H&E染色结果显示,Ph-IOP损伤导致显著的RGC丢失和视功能损害;接着从形态学和功能上验证了DFP对RGC的药理作用,在 ph-IOP 损伤后5天,DFP处理减弱了神经节细胞复合体(GCC)厚度,并增加了RGC数量(FG标记RGC形态)。这些结果表明,DFP在ph-IOP损伤后保护 RGC 损伤,因此使用DFP抑制铁死亡是治疗ph-IOP诱导的RGC 损失的有效治疗策略。
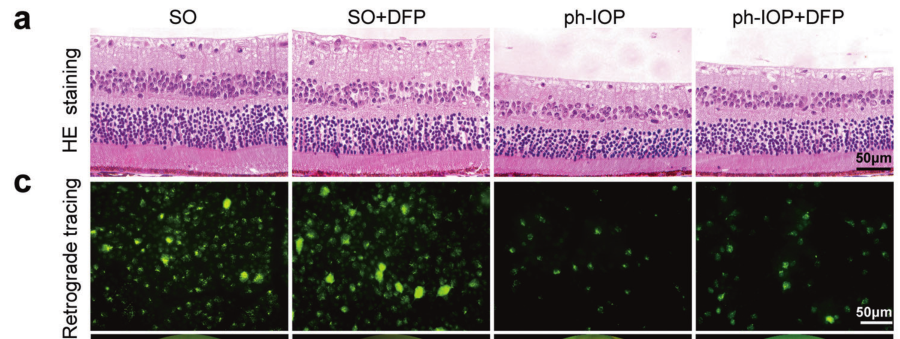
图5 DFP抑制ph-IOP 损伤引起的RGC铁死亡
研究小结
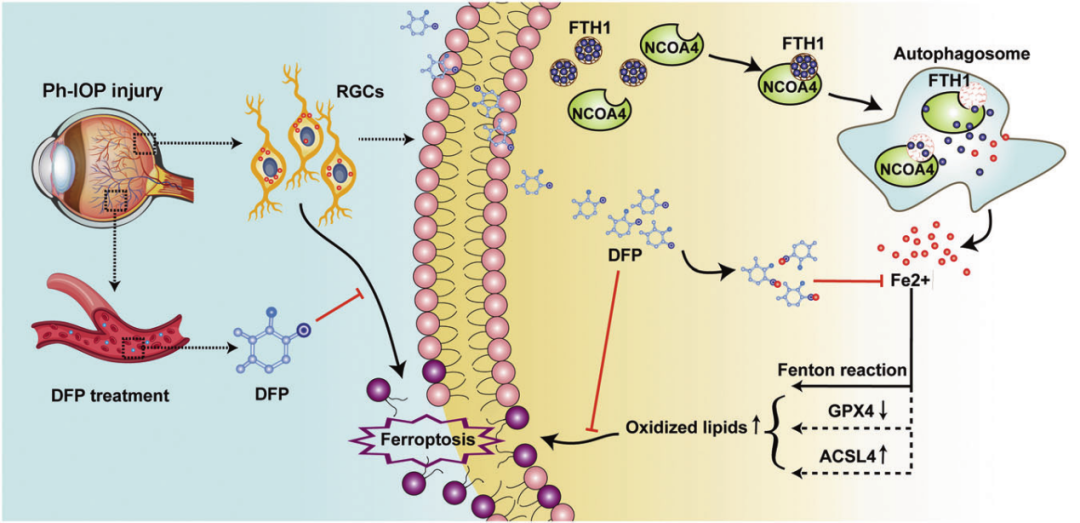
在生理状态下,细胞内铁处于动态平衡状态,但在病理状态下,这种平衡会被打破。Ph-IOP 损伤可以激活RGC细胞内的NCOA4,激活的NCOA4将结合FTH1并触发溶酶体降解FTH1(称为铁自噬)。降解的FTH1会释放大量的游离铁离子,这种具有氧化还原活性的金属会进一步参与脂质过氧化。最终,由铁引起的脂质过氧化氢的积累导致RGC铁死亡,但口服DFP可以螯合细胞内多余的游离铁离子,抑制ph-IOP诱导的RGC铁死亡。
参考文献
Yao F, Peng J, Zhang E, et al. Pathologically high intraocular pressure disturbs normal iron homeostasis and leads to retinal ganglion cell ferroptosis in glaucoma [published online ahead of print, 2022 Aug 6]. Cell Death Differ. 2022;10.1038/s41418-022-01046-4. doi:10.1038/s41418-022-01046-4
ONT全长转录组优势
- 转录本全面鉴定:超长读长,直接读取从5’端到3’’端的高质量单个RNA分子全长序列,无需组装即可获得所有全长转录组信息,所得及所有;
- 转录本精准定量:获得全长转录本序列,降低多比对和碱基错配造成的定量误差,实现转录本水平的精准定量;
- 结构变异一网打尽:统观生物体内复杂的转录情况,解释基因转录过程的真实结构,如可变剪接、可变多聚腺苷酸化、融合基因等;
- 超高性价比:样本处理及其简单,可同时进行定量和定性分析,低价格获得高质量。
如果您对nanopore全长转录组技术感兴趣,欢迎点击下方按钮联系我们,我们将免费为您设计文章思路方案。









 京公网安备 11011302003368号
京公网安备 11011302003368号