真核生物的染色质在细胞核内会折叠成复杂的三维结构,染色体的结构和数量重排等结构变异(SV),在很大程度上贡献了人类基因组的遗传多样性,往往破坏染色质TAD结构域、改变远离 SV 断点的基因表达,这些三维基因组的变化导致许多疾病发生发展。今天带来一篇利用多组学发表近17分的文章,从三维基因组学新角度阐述胰腺癌发生机制,一起来探讨这边的文章的新思路(入选同期封面论文)。
多组学解析胰腺癌中结构变异与三维基因组的动态互作
Dynamic Interplay between Structural Variations and 3D Genome Organization in Pancreatic Cancer
发表杂志:Advanced Science
影响因子:17.521
发表日期:202205
发表单位:国家癌症中心、中国医学科学院肿瘤医院和北京协和医学院

研究背景
结构变异(SV)是基因组变异的来源之一,并可能导致癌基因生成。然而,人类癌症中SV的识别和解释在技术上仍然具有挑战性。利用长读长测序和Hi-C优势检测人类胰腺导管上皮癌发生结构变化的特征,揭示了3D染色质架构的广泛重新编程,对阐明胰腺癌基因组结构变化特征对其发生发展的分子机制至关重要。
研究设计
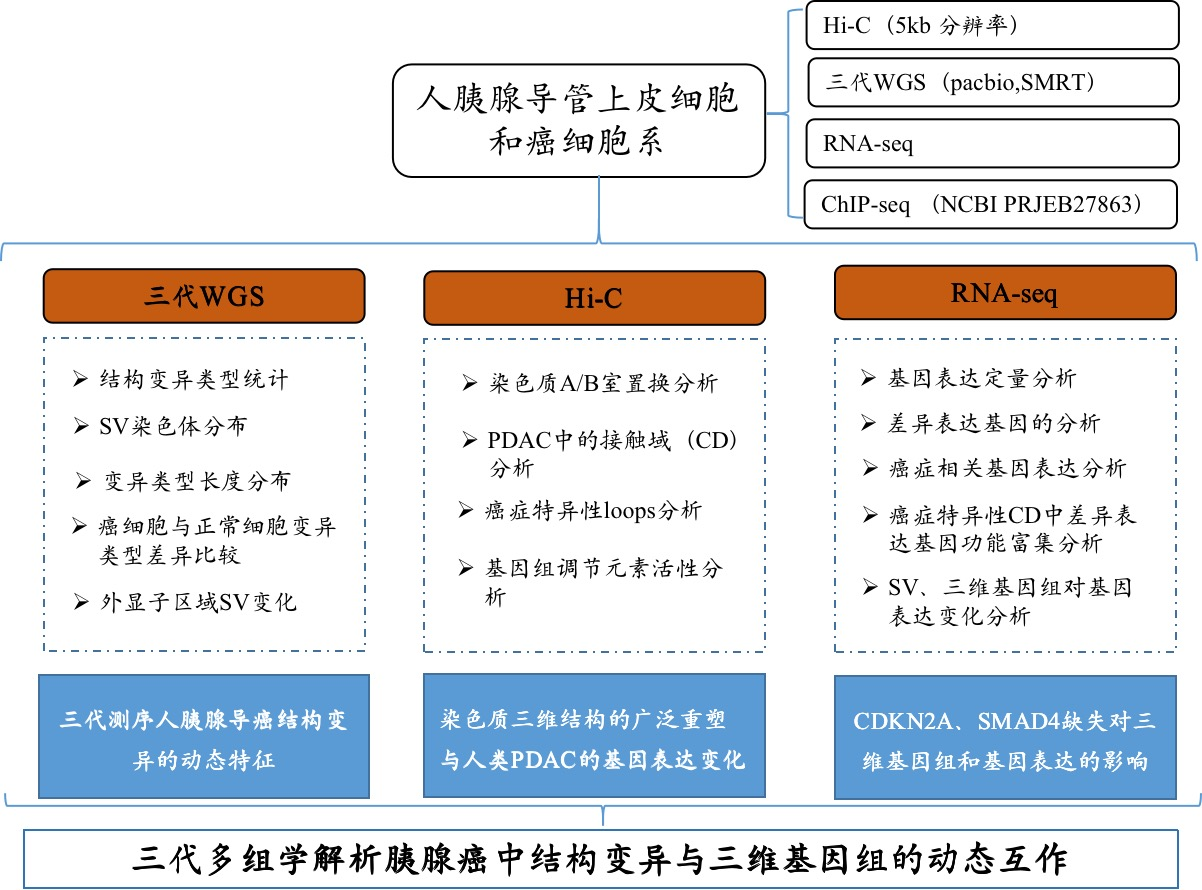
材料:人类胰腺导管上皮细胞(HPDE6-C7)和人类胰腺癌细胞系PANC1和BxPC3;CCLE+GSE97003数据库中的三条细胞系进行了转录组聚类分析
方法:Hi-C互作、单分子实时(SMRT)测序、RNA-seq、ChIP-seq(NCBI PRJEB27863)
研究结论
研究人员通过整合三代人重测序、高通量染色质构象捕获( Hi-C) 和 RNA-seq等多组学技术,对源自人胰腺导管上皮的胰腺癌细胞和正常人胰腺导管上皮细胞进行了深入研究和综合分析,成功揭示了PDAC细胞中SV的特征图谱和染色体空间结构的多尺度重塑,并进一步阐释了SV与染色质三维结构之间的复杂的相互作用及其对基因表达的影响。这一发现为全面了解SV在胰腺癌发展中的致病机制提供了全基因组资源和新的空间视角,这可能有助于识别新的预后标志物和治疗靶点。
文章亮点
借助三代人全基因组重测序技术,揭示胰腺癌关键驱动基因CDKN2A和SMAD4的复杂基因组重排,并且结合Hi-C技术识别了染色质空间构象的改变,并从线性角度和3D角度进一步阐明了它们对癌基MIR31HG、MYO5B等表达的影响,这是首次采用多组学策略集成了长读长测序和Hi-C技术研究结构变异(SV)对胰腺癌三维基因组的影响,为PDAC诊治开发提供了遗传和分子基础的根本新见解。
研究结果
1、人类胰腺癌结构变异的特征
利用SMRT测序长度长的优势全面研究了正常胰腺导管上皮细胞恶性转化过程中发生的SV的动态谱,检测到PANC1、BxPC3和HPDE6C7中存在大量的结构变异(SV),分别为20 805、21 168和23 035个SV。两种常见的SV类型是插入和缺失,分别占所有SV的约50%和41%。值得注意的是,与正常上皮细胞系相比,癌症细胞系中两种以上简单SV断端重叠的复杂SV数量增加了两到四倍,这表明在恶性转化过程中,基因组不稳定性大大增加。对这些SV进行染色体区域分布、长度分布分别进行分析,插入、缺失和重复表现出相似的特征,大多数长度都在1kb以内,表现出细胞异质性。
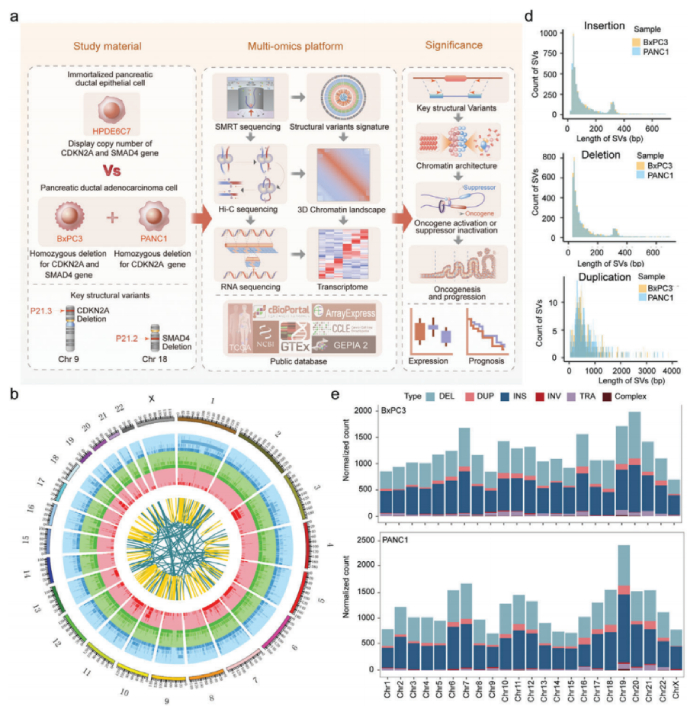
人胰腺导管癌SV整体景观
研究了在其外显子区域受到SV直接影响的基因,并分别在PANC1、BxPC3和HPDE6C7中检测到了1017、1061和1683个基因的变化。在PANC1中独立检测到14号染色体上的DICER1扩增,19号染色体上的AKT2缺失和20号染色体上的GNAS插入。在BxPC3中特异性地检测到9号染色体上的TNC缺失,11号染色体上的RRAS2插入和18号染色体上的SMAD4缺失。BxPC3样本中还存在许多基因大片段缺失,长度超过1.7 Mb,包括CDKN2A、CDKN2B、MTAP和DMRTA1等基因。基于长读长测序结果建立了人类胰腺癌中SV的特征,为全面研究SV在这种致命恶性肿瘤中的发病机制提供宝贵的资源。
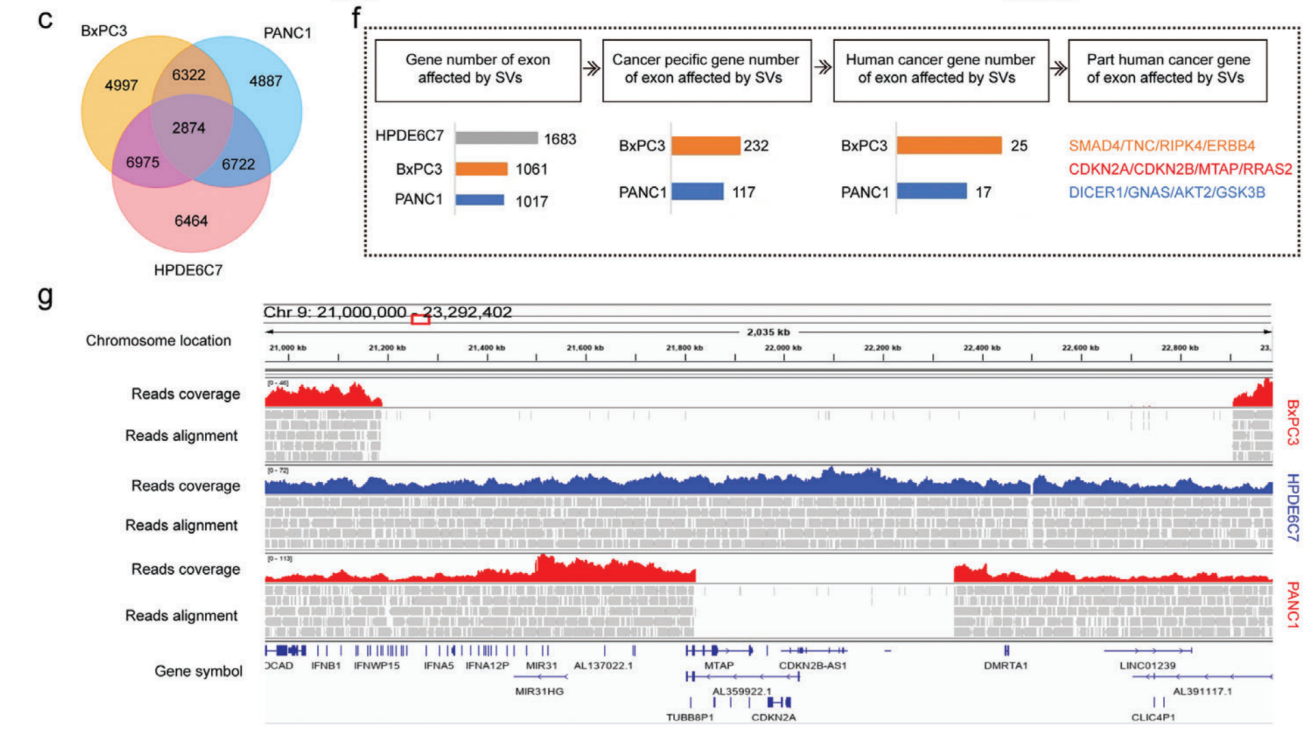
人胰腺导管癌SV影响外显子区域基因的变化
2.染色质三维结构的广泛重塑与人类PDAC的基因表达变化相关
Hi-C测序全面分析正常HPDE6C7细胞系和两种癌细胞系(BxPC3和PANC1)染色体的空间构象,对来自不同库的三个细胞系的主要读数的相关性分析表明,来自不同库的Hi-C数据是一致的,两种癌细胞类型最相似,可以与正常的HPDE6C7细胞系区分开来。
PADC中染色质A/B室置换分析,与正常细胞相比,BxPC3中A/B置换的总发生率分别为24.8%(A到B,15.3%;B到A,9.5%)和PANC1中的24.1%(A到B,16.2%;B到A,7.9%)。A/B置换与基因密度和调节活性的变化有关,稳定的A和B室到A室置换是具有活性转录的基因丰富的区域,而稳定的B室和A室到B室置换具有相反的特性,RNA-seq数据相结合也证实这一结论。其中癌症样本中PHLDA1是位于12号染色体共同B到A室置换的基因,在两个癌细胞系中都显著上调,PHLDA1在几种恶性肿瘤中显著上调,包括胰腺癌、低级胶质瘤和黑色素瘤,它与胰腺癌预后不佳显著相关。这些结果表明两个癌细胞系(BxPC3和PANC1)中染色质A和B室的空间分布发生了变化,这些转变与癌症相关基因的表达变化显著相关。
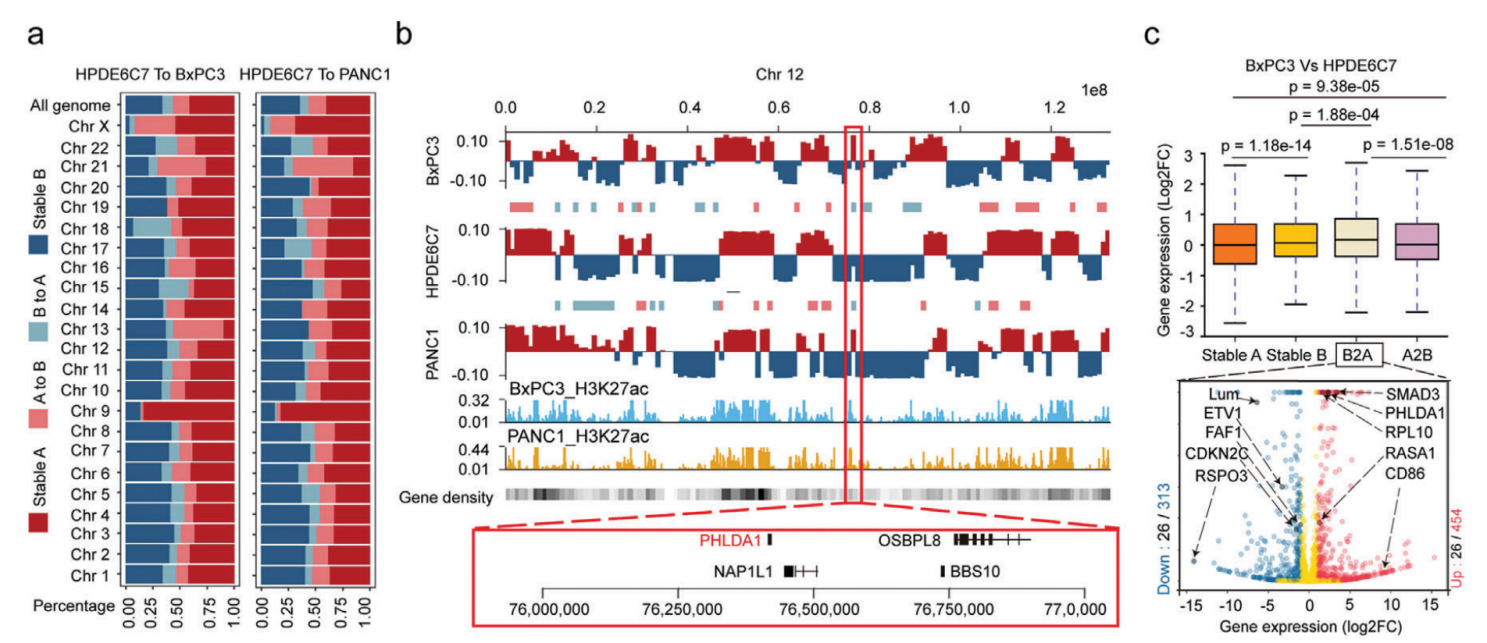
人胰腺癌染色质A/B室置换对基因表达的影响
PDAC中的接触域(CD)改变分析,拓扑关联域(TAD)是染色质结构的功能单位,这里利用高分辨率Hi-C(5kb)测序检测正常细胞系和癌细胞系的接触域边界(CDB),在HPDE6C7、BxPC3和PANC1细胞系中确定了14 581、14 318和13 494 CD,平均大小分别为211、227和214kb。CDB保存在人类基因组中任何两种细胞类型之间共享的CDB很少,CD数量和大小的变化可能会在不同的染色体区域出现截然相反的变化。与共享的的CD相比,癌症特异性CD区域与上调基因表达的关联要大得多。这些癌症特异性CD中差异表达基因的GO富集分析显示,改变的基因涉及几种关键途径,包括癌症促进、细胞分化、细胞粘附、细胞运动和迁移。
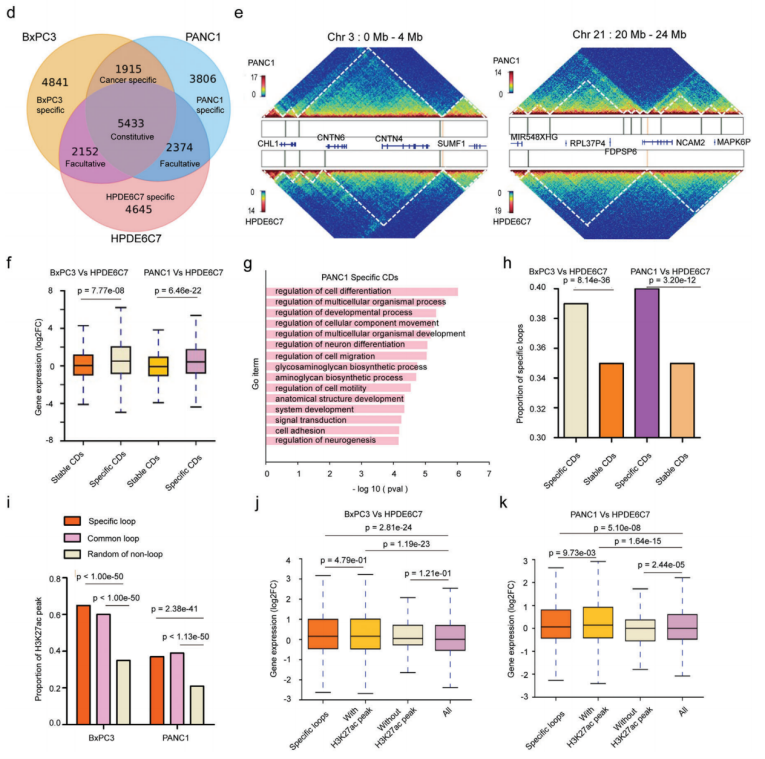
人胰腺癌染色质CDB和loops环对基因表达的影响
PDAC中的癌症特异性loops和异常增强子激活深入研究,显示癌症特异性loops异常增多,癌症特异性CD与高比例的癌症特异性loops显著相关,这些H3K27ac活性的癌症特异性loops与上调的基因表达显著相关。这些变化伴随着基因表达的上调,可能与癌症特异性loops中调节元素活性的增强有关。总之,PDAC细胞系中的3D染色质结构经历了广泛的重塑,并随之而来的基因表达失调,这可能会促进PDAC的肿瘤发生和进展。
3、三维基因组结构变异的分布
人体内SV的发生和形成往往受到染色体三维空间结构的影响,根据SV和染色质A/B室之间的关系,除了BxPC3中的缺失外,BxPC3/PANC1/HPDE6C7样本中染色质A室都有显著的插入、缺失和重复变化,发现插入、其中在PANC1的染色质A室中显著富集了缺失和重复变异,但在BxPC3的染色质A室中显著存在重复变异,两种癌细胞系之间A/B隔间中癌症特异性SV的分布模式大不相同。
SV在CD中的分布及其边界研究,根据SV和CDB断点之间的相对位置,将所有癌症特异性SV分为四类:CDB中/交叉CDB/内部CDB/部分重叠。超过90%的癌症特异性SV位于CD(CDB-SV)内部,这对它们的染色质空间构象影响很小,而跨CDB/内部CDB/部分重叠SV对CD折叠的影响更大,其比例相对较低。总之,在A/B室或CD级别的肿瘤中,SVs的发生与染色体三维空间构象之间存在一定的相关性。此外,SV在三维基因组中的分布模式具有高度细胞类型特异性。
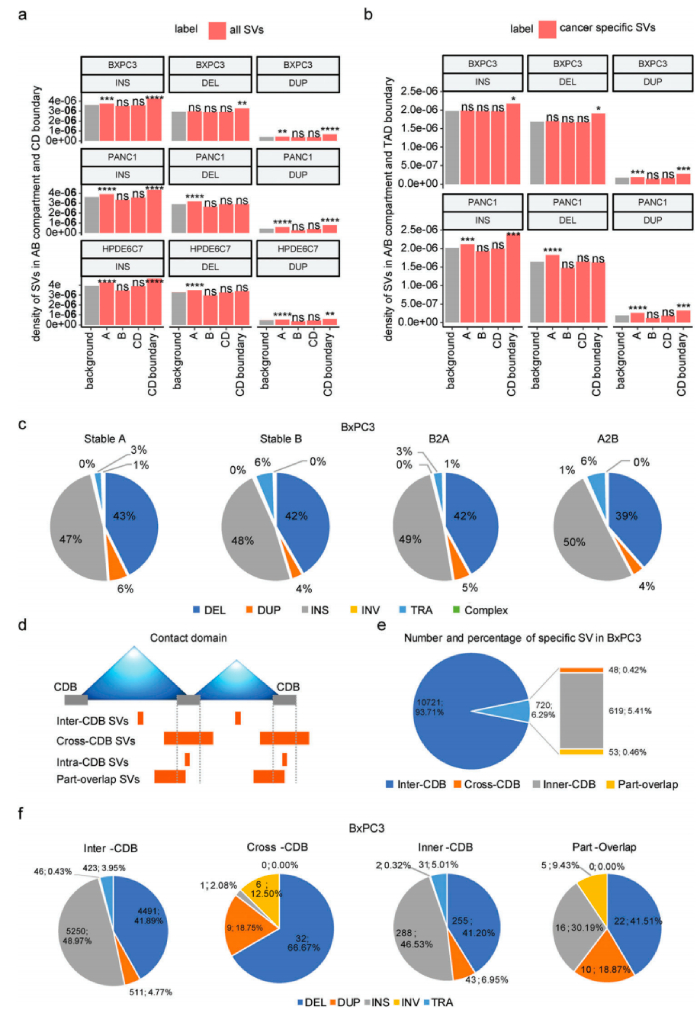
三维基因组染色质空间构象与结构变异的分布
4、PDAC基因组中特定癌症SV和染色质结构域的相互作用
SV可以重塑线性基因组染色质空间构象,从而改变顺式中的染色质拓扑和基因调控,深入探索跨CDB SV对CD中断的影响,跨CDB缺失区域的CD融合明显高于基因组的其他位点,并且只有同一细胞系中频率更高的缺失与相邻CD或CD融合的增强相互作用有关,低频率的缺失对相邻CD的相互作用没有显著影响,在这些情况下没有发现CD融合。这些表明SV对3D基因组结构的影响相当复杂,可能会受到多种因素的影响,例如SV的细胞间基因组异质性、位置和长度等。
分析了两个癌细胞系中CD融合与差异基因表达之间的相关性。结果表明,融合CD中差异表达基因的比例明显高于基因组其他区域,总的来说,这些数据表明,癌症特异性SV可以通过重塑PDAC中的CD来调节基因表达。
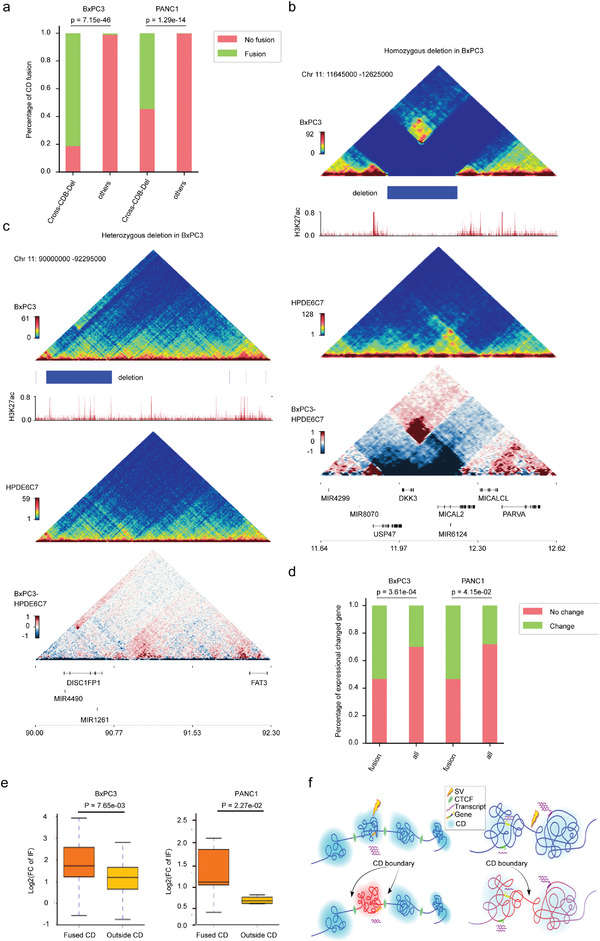
癌症特异性SV通过重塑PDAC基因组中的CD来影响基因调控
5、CDKN2A纯合子缺失对三维基因组结构和基因表达的影响
CDKN2A失活通过各种机制发生在约90%的PDAC中,其中纯合子缺失是常见的途径之一。此次研究证实了BxPC3和PANC1中CDKN2A的纯合子缺失,发现缺失两侧相邻CD之间的相互作用显著增强,形成融合CD,相邻CD区域之间的内部相互作用也显著增强。发现CDKN2A、CDKN2B和MTAP(缺失区域的基因)的表达几乎消失了,而MIR31HG和LINC01239(缺失区域两侧的基因)的表达被显著上调。发现MIR31HG表达高患者的生存率显著缩短(图5e),与MIR31HG在PDAC中的致癌作用一致。该研究揭示了CDKN2A纯合子缺失对三维基因组结构和基因表达的影响,为了解CDKN2A失活以推动PDAC的发生和发展提供了新的见解。
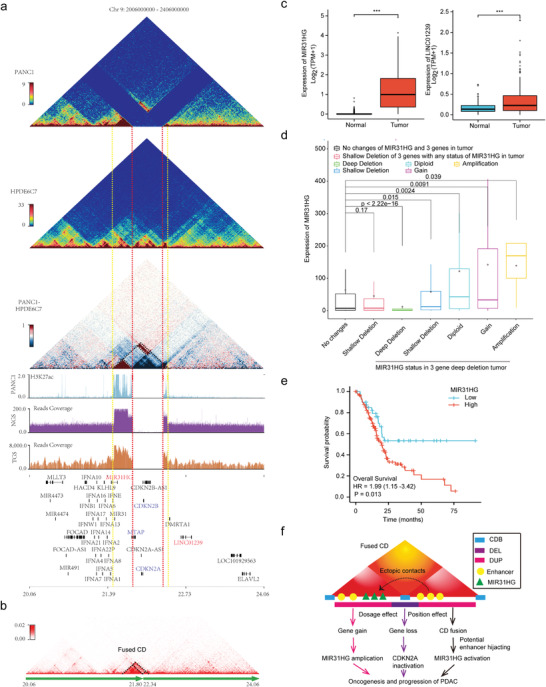
CDKN2A纯合子缺失部分通过伴随的相邻基因组扩增和CD融合与MIR31HG上调有关
6、PDAC驱动基因SMAD4缺失对三维基因组和基因表达的影响
SMAD4是PDAC的一个关键驱动基因,已知在约55%的胰腺癌中丢失,纯合子缺失占这些病例的约30%。通过三代测序技术和Hi-C方法验证了BxPC3中的SMAD4纯合子缺失。涉及SMAD4基因的交叉CDB缺失双方之间的相互作用没有增强,分析BxPC3中第18号染色体的相互作用热图,并发现了几种增强的远端异位相互作用。这些不寻常的远程区域主要与三个大型缺失点有关,包括SMAD4缺失区域。BxPC3中SMAD4的纯合子丢失和18号染色体上的多次缺失会导致巨大、复杂的染色体重排,包括反转和易位。CD可以减少复杂染色体重排造成的3D基因组组织的破坏,保持染色质的基本结构,并稳定CD中基因的表达。确定了与18号染色体上SMAD4缺失相关的复杂染色体重排,并揭示了它们对3D基因组组织和相关基因表达的影响。
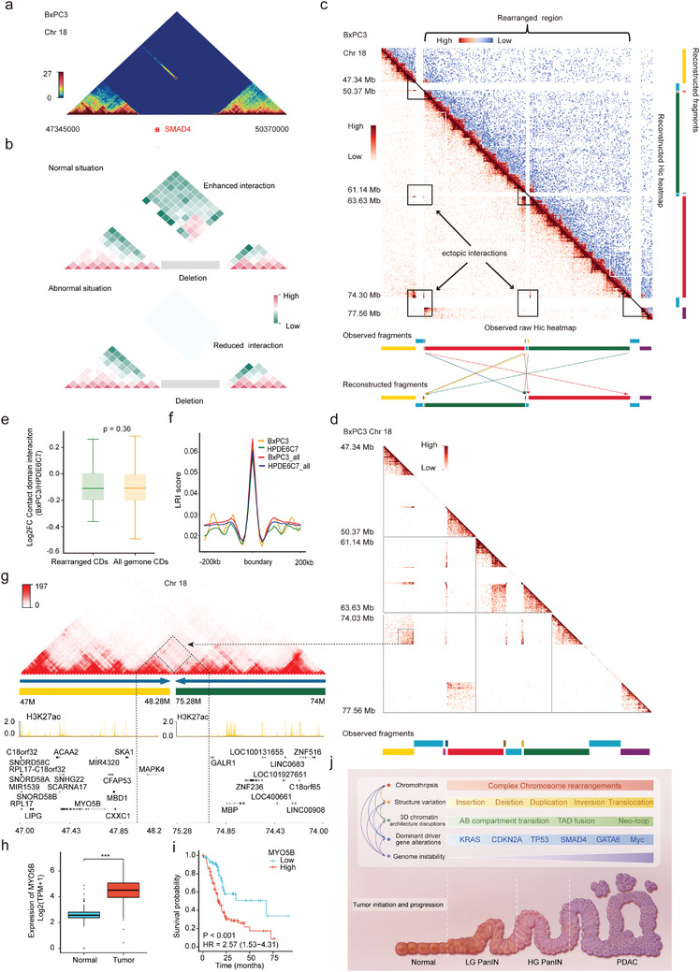
PDAC中SMAD4缺失相关的复杂基因组重排与三维基因组变化
总结
三代测序和高通量染色质构象捕获技术(Hi-C)的快速发展和应用,越来越多的证据表明,SV和3D基因组在肿瘤发生和发育中起着关键作用。建立SV和3D基因组结构的特征,并表征它们在PDAC中的动态相互作用,阐明了两个关键驱动基因CDKN2A和SMAD4的纯合子缺失对3D染色质折叠结构域的影响,以及相关基因在PDAC的致癌和进展中的表达,这项研究为全面理解SV在胰腺癌发生和发展中的功能和致病机制提供了新的空间视角。基于高维基因组学的研究将有助于识别PDAC新的分子标记物或潜在靶点,这对提高预后极差的PDAC的治疗挑战具有重要的现实意义。
参考文献
Du Y, Gu Z, Li Z, et al. Dynamic Interplay between Structural Variations and 3D Genome Organization in Pancreatic Cancer. Adv Sci (Weinh). 2022 Jun;9(18):e2200818. doi: 10.1002/advs.202200818.
如果您对三维基因研究感兴趣,欢迎点击下方按钮联系我们,我们将免费为您设计文章思路方案。
百迈客转录调控多组学研究一站式服务
百迈客转录调控事业部搭载二代Illumina Novaseq、三代Pacbio/Nanopore测序平台的测序数据开发基因及转录本水平表达及功能研究的系统化解决方案。Hi-C实验、信息分析平台具有双认证,为Cell、Nature genetics、National Science Review、Molecular plant等20余篇IF≥10文章提供HIC技术服务。具有50余篇基因组研究共同作者项目案例,以及不少于5篇通讯作者项目案例。与甘肃省人民医院、四川大学华西医院、中国医科大学等单位合作发表文章影响因子超1500+。百迈客可以提供从研究方案制定、建库测序、生物信息分析、定制化分析、个性化交互分析、生信培训班的转录调控多维解决方案。








 京公网安备 11011302003368号
京公网安备 11011302003368号