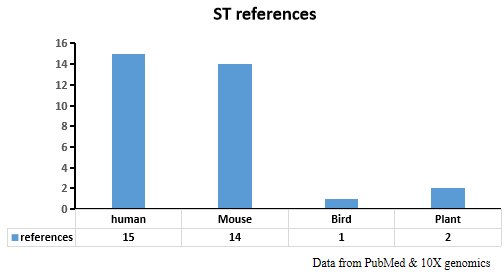
继单细胞转录组学技术之后,空间转录组技术登上2020年Nature Methods 年度技术的封面,可以说空间转录组引领科研领域的主导风向标。

空间转录组则更是带来了组织细胞空间信息,提供单细胞分辨率空间转录组视角,令科学家为之振奋。目前10 visium平台率先开发动物冷冻样本和人FFPE样本空间转录组高通量测序技术,已经在人和鼠上有大量的研究报道。然而植物在空间转录组上研究报道并不多,瑞典斯德哥尔摩皇家理工学院Stefania团队在Nature Plant(2017)[1] 、Nature Protocols(2018)[2]连续报道了拟南芥花序、杨树叶芽、冷杉雌球果在空间转录组技术上研究,但是植物空间转录组技术仍然存在太多难题难以突破。
百迈客基于大量的植物组织研究的经验,借助10x visum平台率先突破了植物空间转录组应用难题。可以正式为广大老师提供植物空间转录组技术服务,让我们一起来看看植物空间转录组技术难点和突破。
植物组织冷冻包埋
不同于动物组织的冷冻包埋,植物组织结构上跟动物组织存在很大差异性,特别是植物组织存在较硬的细胞壁以及含水量很高的大液泡等结构,常规冷冻后的植物组织器官硬度大,形成的冰晶多,从而不易获得高质量的切片。有一些研究报道对关于植物中不同组织器官冰冻切片技术的应用及方法进行了探讨,但这些方法大多数是将植物材料经过FAA、多聚甲醛或乙醇等固定液固定、以及一定浓度的甘油处理或液氮速冻等处理后才能得到较好的切片效果,不仅切片条件各异,而且操作过程也较为复杂,对于初学者较难掌握。另外对于切面组织间木质化程度差异大、直径较大且髓部含有较大面积海绵状细胞的植物组织器官(如甘蓝型油菜发育成熟的主茎)也很难获得完整的切片。因此需要选择合适冷冻保护剂处理植物组织,这里推荐利用蔗糖溶液作为冷冻保护液,将植物组织放在合适浓度蔗糖溶液中固定,用对应浓度的蔗糖磷酸缓冲液浸洗,最后抽真空[3]。
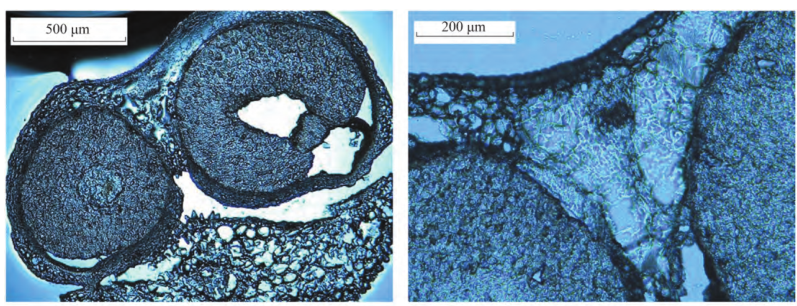
图1. 合蕊柱适合条件(16%蔗糖磷酸缓冲液,切片厚度 10 μm)冷冻切片效果
一般冷冻包埋有三种常见方法:1)直接包埋法,预处理的材料直接用包埋剂(水凝胶/OCT包埋剂)在-20℃冷冻切片机上低温冷冻处理;2)液氮速冻法:材料经常规方法固定和清洗后 , 先用包埋剂包裹在适当大小的盒内 , 再用液氮迅速速冻20s,再将样品放进 - 20 ℃ 速冻 20 ~30 min;3)异戊烷OCT冷冻包埋法:将异戊烷容器置于液氮中冷却3-5分钟,直至异戊烷从流动液体状转为粘稠液体,将包埋盒中材料放在异戊烷,当OCT由透明转变为完全不透明的白色时,取出包埋盒并放入-80℃冰箱保存。
经过蔗糖保护的组织可以通过液氮或者异戊烷冷冻包埋,经过处理的包埋块可以进行切片或者超低温保存,后续切片可完整保存植物组织原始的状态。植物空间转录组对于样本的前期处理非常重要,冷冻包埋的效果是实验成功的关键因素,包埋过程中组织中或者周围不能产生气泡,以及处理的样本要快速进行冷冻包埋。

图2. 植物组织异戊烷OCT冷冻包埋块
植物组织冷冻切片
动物组织样本细胞类型,结构相对比较简单,切片厚度比较统一,基本上保持在10μm厚度左右。但是植物样本组织结构复杂,而且木质化程度不一,组织相对RNA含量较低,因此植物切片厚度一般根据样本类型不同,选择不同的切片厚度,一般植物冷冻切片厚度范围为10-50um,根据物质组织类型切片厚度会有所不同,视具体情况而定。
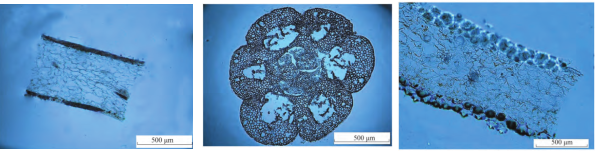
图3. 植物组织冷冻切片
植物组织冷冻切片染色
动物组织常用HE(苏木精-伊红染色法 ( hematoxylin-eosin staining ))染色,可以精准识别组织形态和病理学鉴定。然而植物的组织存在的纤维素和一些木质素不适合HE染色方法,采取的是甲苯胺蓝染色法,其基本原理是植物组织木质化细胞壁呈蓝绿色,其他组织成分呈紫蓝色,可以精准辅助判断植物组织形态学和确定捕获区域。
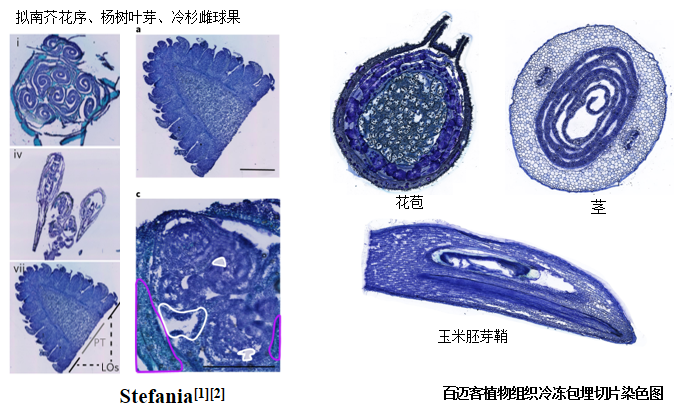
图4. 百迈客植物组织切片染色数据
植物组织优化
较大的难点是组织优化,由于植物组织结构木质化程度不一样,RNA含量水平偏低,植物组织的RNA透化难度大大加大,要想获得足够的RNA,根据Stefania[2]的方法我们自主优化了植物组织透化试剂,使用组合酶的方法,其试剂效果可保证RNA被完全透化下来,解析植物组织空间位置所有RNA表达。
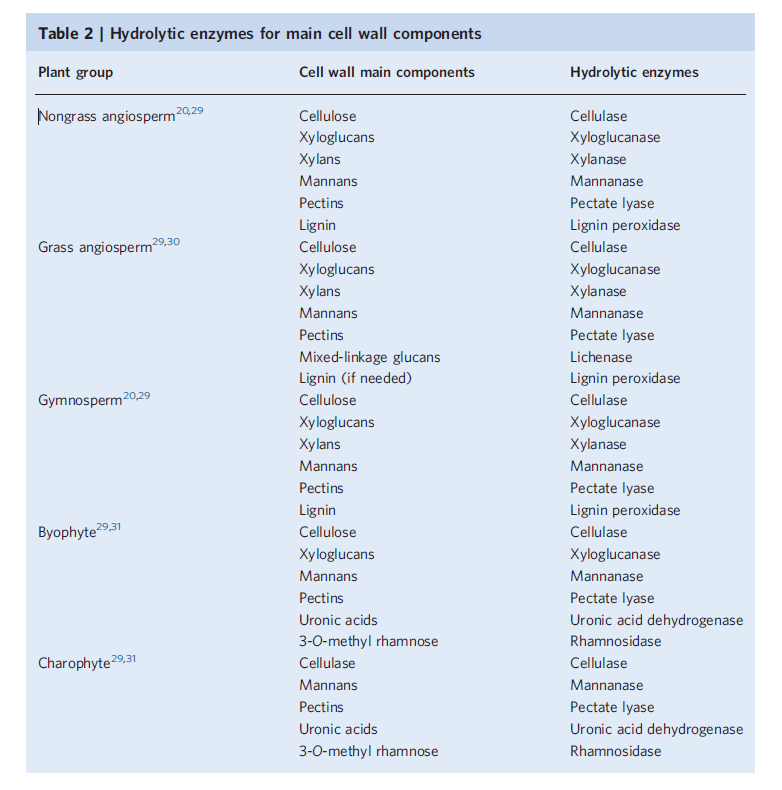
图5. 植物组织透化酶的选择参考 Nat Protoc. 2018 Nov;13(11):2425-2446.
植物空间转录组数据分析
空间转录组技术主要解决空间异质性的问题,那么该技术在植物领域有哪些应用呢?我们知道植物成长过程中组织不同位置基因表达模式的差异会呈现不同的表型,空间转录组在植物上提供一种新的视角探讨植物组织器官空间基因表达模式,主要可以围绕生长发育(育种)、抗逆应激(生物胁迫和非生物胁迫)、免疫反应和致病机理、生物进化等几个方面研究植物上一些生物学现象和表型,从而提供更高分辨率时空多维度解析科学问题。接下来我们举几个实际案例分享植物空间转录组的应用:
(1)拟南芥花序 植物生长发育-Natrue Plants,2017[1]
Stefania和 Joakim Lundeberg团队在2017年就开发了植物上空间转录组技术,通过模型被子植物(拟南芥)和裸子植物(杨树、挪威云杉)的微观切片生成空间转录组谱来证明该技术的可行性。该技术捕获区域为6.2*6.6mm2,含有1007spot,每个spot的直径距离是100µm,可以检测到植物组织在空间维度的所有RNA分子的表达。
文中首先鉴定杨树休眠期和发育期叶芽不同组织区域基因表达特征,证实了技术检测的z确性、灵敏度以及重复性。休眠期(冬季)和发育期(夏季)叶芽一共检测到17043个基因,样本每个spot检测到基因中位数为2929,转录本检测中位数为8061,跟休眠期相比,在发育期叶芽中有408高表达的基因,在发育芽还是休眠芽组织切片中,高表达的基因在同一组切片之间和不同组的复制芽切片之间的表达模式清晰一致,无论生物学重复还是技术重复都证实该方法的重显性和√确性。
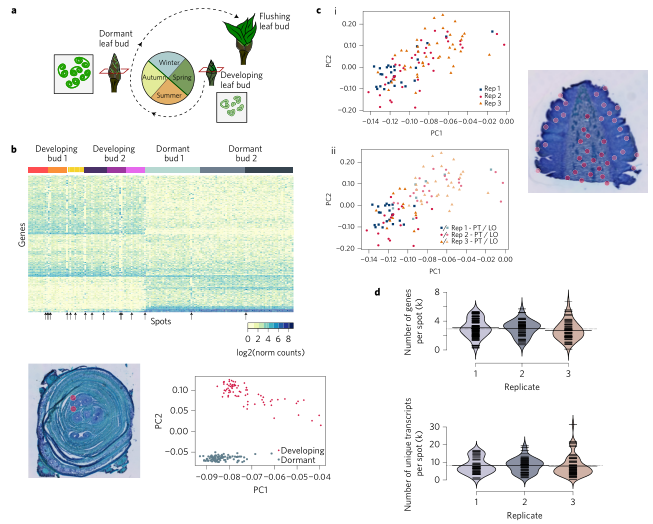
图6. 杨树休眠芽和发育芽空间基因表达特征重现性
拟南芥花苞中空间转录组检测茎、分生组织、以及3个不同花区域空间基因表达,一共检测到20215个基因,鉴定开花有关的两个关键基因At5g57720(已知的在S3和S9表达的基因)和 ATA27 (At1g75940,已知的在S11和S12表达的基因)的√确的空间定位可视化,组织区域特异性基因和通路的显著差异,发现雄蕊丝发育通路在S11(雄蕊丝伸长的位置)和茎中富集,在茎中维管通道大量存在,并且细胞伸长和维管发育过程非常活跃。其中花粉外壁形成途径在S10和S11发生改变,在这个阶段,外壁是花粉壁的主要组成部分之一,在绒毡层产生并沉积在花粉前细胞上。空间基因表达特征揭示了组织区域异质性,并为植物生长发育过程和相应功能的探索提供了高分辨率的空间植物基因表达模式,从新的维度探索植物发育过程。
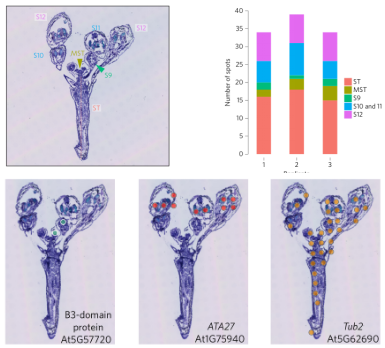
图7. 拟南芥花序空间基因表达特征
(2)拟南芥花序、杨树叶芽、冷杉雌球果 植物生长发育-Nat Protoc, 2018[2]
Stefania和 Joakim Lundeberg团队2018年继续在更多的裸子植物、被子植物转录组本空间模式探索,提供了不同的植物类型细胞壁采用不同的酶混合物处理方法,以及植物组织冷冻和透化优化、组织去除的方法,而拟南芥花序、杨树叶芽、冷杉雌球果,特别高度异质性的组织部位,精准提高了植物空间基因检测的的特异性(~93%)、z确性(~71%)以及灵敏度(~60%)。

图8. 拟南芥花序、杨树叶芽、冷杉雌球果空间基因表达
(3)拟南芥叶片-植物对细菌攻击的免疫反应途径 Plant Methods. 2019[4]
Michael Giolai等人利用 GaST-seq技术,检测拟南芥叶片8个区域(1mm2)空间基因表达特征,探讨解刨诱导的基因应激表达,以及叶片组织空间特异性基因表达,中脉与叶脉差异表达基因393个,叶缘与叶脉差异表达基因有686个;同时细菌分子鞭毛蛋白- flg22感染叶片不同组织区域,发现与水处理相比较,不同区域感染后产生差异表达基因数目不一样, flg22诱导后根据其在叶面积上的空间表达模式√确地聚为36个簇,而且这些基因主要富集在应激和防御反应相关的生物过程,探索植物器官内部空间差异和细菌PAMPs的生物刺激所引起的变化的反应机制。
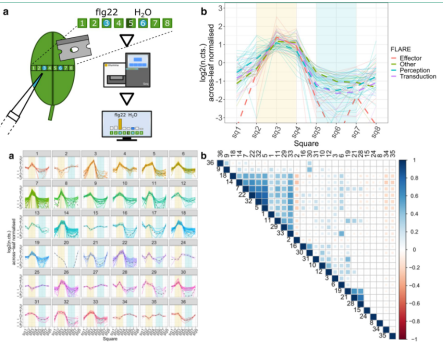
图9. 拟南芥叶片对病原体的免疫反应空间基因表达特征
(4)挪威云杉雌芽 植物生殖育种 UPPSALA UNIVERSITET, 2020[5]
挪威云杉是瑞典经济的重要出口树种,它可能需要20-25年的树木成熟时期。为了培育优良品种, Stefania Giacomello and Jens Sundström结合10x Visium技术进一步研究挪威云杉野生型和早期圆锥形突变体Picea abies var. acrocona的雌性生殖发育中的空间基因表达模式,该技术捕获区域为6.5mm*6.5mm,含有5000个spot,每个spot直径为55µm,以更高的分辨率鉴定云杉雌芽的空间发育特征。选取三个类型不同时期挪威云杉(Wildtype, Acrocona or Vegetative;August, September, October)作为研究材料,一共检测了16个样本,每个样本检测到26000个基因左右,每个spot基因检出率为525-1855个。
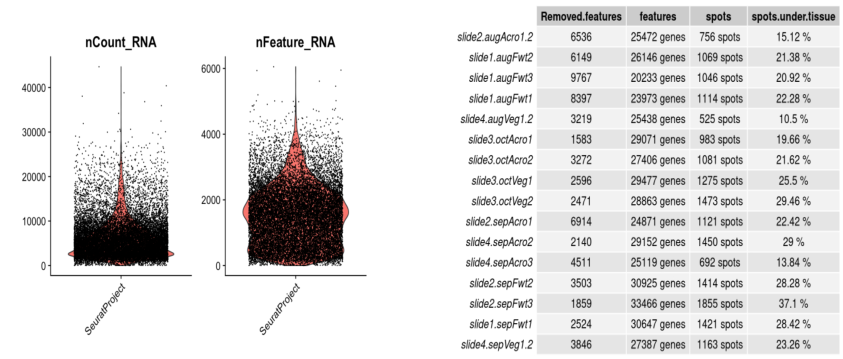
图10. 挪威云杉雌芽空间转录组基因表达
UMAP对样本进行批次效应分析,可视化展示16个样本空间基因表达聚类可视化图。
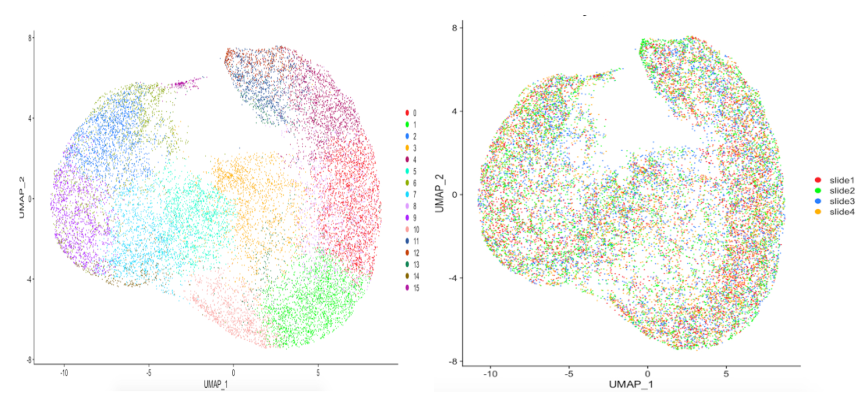
图11. 挪威云杉雌芽不同样本聚类可视化
野生型、突变株从8月、9月份、10月份空间差异表达marker基因鉴定,发现雌芽(F)和营养芽(V)类型之间的生长差异,cluster 1在F和V的9月中表达分布存在差异,主要富集在外部组织区域,可能是雌性的不育苞片和营养芽中的针部组织。不同组织区域、不同生长时期云杉叶芽存在组织空间区域特异性,突变体acrocona空间基因表达的理解可能会加速在野生型P.abies的遗传实验,并改善挪威云杉的生长周期,加快优良品种的培育。

图12. 挪威云杉不同区域marker基因的鉴定分布图
以上目前植物空间转录组技术难点和突破点,百迈客已经一一攻克这些难点,完成植物在空间实现了高通量测序。
如果对植物空间转录组感兴趣的老师,想要开展相关研究,可以电话咨询提供植物空间转录组测序。
欲知更多百迈客植物空间转录组实测数据,尽在下期分享,敬请期待。
参考文献:
[1] Giacomello S, Salmén F, Terebieniec BK, et al. Spatially resolved transcriptome profiling in model plant species. Nat Plants. 2017 May 8;3:17061.
[2] Giacomello S, Lundeberg J. Preparation of plant tissue to enable Spatial Transcriptomics profiling using barcoded microarrays. Nat Protoc. 2018 Nov;13(11):2425-2446.
[3]陆振芳, 蒋素华, 江敏,等. 蝴蝶兰花器官冰冻切片技术探讨[J]. 河南农业大学学报, 2019, 053(002):200-206.
[4] Giolai, M., Verweij, W., Lister, A. et al. Spatially resolved transcriptomics reveals plant host responses to pathogens. Plant Methods 15, 114 (2019).
[5] A spatial analysis of Norwegian spruce cone developmental stages. UPPSALA UNIVERSITET, 2020.
推荐阅读
文献分享|【综述】单细胞技术开启对肝脏病理学及发病机制的新认知
单细胞转录组助力构建不同胃腺癌亚型的转录组图谱
百迈客:10x单细胞转录组与空间转录组联合分析一睹为快
空间转录组-在生长发育中的应用2
空间转录组-在癌症中的应用1






 京公网安备 11011302003368号
京公网安备 11011302003368号