文献名称:Key role for CTCF in establishing chromatin structure in human embryos
期刊:Nature
导读
在细胞周期的中间阶段,染色质以分级结构排列在核中,这在调节基因表达方面具有重要作用。但是,人类胚胎发生过程中3D染色质结构的动力学仍然未知。在这里作者报告,与小鼠精子不同,人类精子细胞不表达染色质调节剂CTCF,其染色质不包含拓扑关联域(TADs)。人类受精后,TAD结构在胚胎发育过程中逐渐建立。此外,A / B区室化在人类胚胎2细胞阶段中消失,并在后续胚胎发育过程中重新建立。值得注意的是,阻断合子基因组激活(ZGA)可以抑制人类胚胎中TAD的建立,而不能抑制小鼠或果蝇中的TAD。值得注意的是,CTCF在ZGA之前以非常低的水平表达,然后在观察到TAD时在ZGA阶段高表达。CTCF基因被敲除后,胚胎中TAD结构显著减少,这表明合子基因组激活(ZGA)阶段,人类胚胎中的TAD建立需要CTCF表达。结果表明,CTCF在人类胚胎发生过程中的3D染色质结构建立中具有关键作用。

实验方法
材料:小鼠精子和桑椹胚
方法:Hi-C, 免疫染色,DNA甲基化测序,ATAC-seq, RNA-seq,Smart-seq2
研究内容
1、人类早期胚胎的TAD结构
作者检测了人类精子和胚胎中的染色质相互作用。但是没有检测到人类2细胞胚胎中TAD结构的特征性“三角”相互作用。在8细胞胚胎中这些相互作用的水平很低,并且在人类胚胎发育过程中相互水平逐渐升高(图1a)。为了排除read深度对分析的影响,在绘制每个阶段的相互作用热图时,作者随机选择了相同数量的read。 作者进一步调查了人类胚胎发育过程中的TAD重编程。使用TAD分离分数方法(Methods)来获得TAD结构和TAD边界。即使read深度很低,也可以检测到大多数TAD域。作者还计算了TAD信号和方向指数。本文的数据表明,TAD信号方差和方向指数在2细胞阶段最低,并随着发育而逐渐增加(图1b)。为了排除人胚TAD分析中可能的实验偏差,本文使用了小鼠morula胚胎作为对照,将其与人2细胞,8细胞和morula胚胎混合。然后,为这些混合样品构建了Hi-C库。同时,还为未与人类样品混合的小鼠桑morula胚胎生成了Hi-C库。这些结果表明,混合样品中的TAD结构在人类2细胞胚胎中仍然模糊不清,在8细胞胚胎和桑胚胎中变得更清晰,而所有掺入的小鼠morula胚胎均清晰可见TAD结构。来自混合样品的TAD信号分析支持了作者的发现,即TAD结构在人类胚胎发生过程中得以确立。
总之,这些数据表明,TAD结构在人的2细胞胚胎中基本上不存在,在8细胞胚胎中很少存在,并且在胚胎发育过程中变得越来越明显。
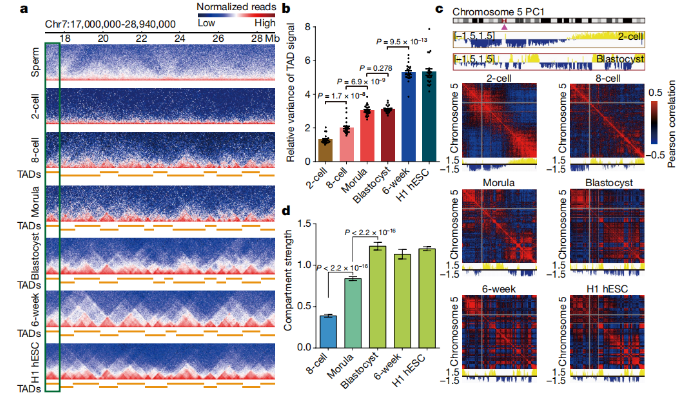
图a 人类精子,人类胚胎和H1人类ES细胞(hESCs)中高阶染色质结构相互作用热图,分辨率为40 kb(合并的生物学重复;n = 2-3)。
图b 用相等数量的reads(每个阶段从2-3个生物学复制中产生)计算出的人类胚胎中TAD信号的相对方差。每个点代表一个染色体。显示P值;双面Wilcoxon秩和检验。数据为平均值±s.e.m。
图c 人类胚胎中500kb分辨率的5号染色体的PC1值轨迹和Pearson相关热图,具有相同的read次数(每个阶段2-3次生物复制)。
图d 具有相同reads的人胚胎中的compartment强度。数据为平均值±标准偏差,通过自举获得(n = 100)。通过单侧t检验计算P值。
图1. 人类精子和胚胎的三维染色质结构
2、人类精子不包含传统的TAD结构
先前的研究表明,TAD结构存在于成熟的小鼠精子中。令人惊讶的是,本文没有在人类精子中观察到典型的三角TAD结构(图1a)。例如,人类精子的HOXA簇区域没有TAD边界,但存在于人类胚泡(图2a)和小鼠精子中。为了验证该观察结果,绘制了人类精子和胚泡在不同读取深度下的TAD信号方差。与小鼠精子和人类胚泡不同,人类精子系的y截距接近0(图2b),表明人类精子中不存在TAD。本文进一步比较了人类精子和小鼠精子之间相互作用插入物大小的密度,结果表明,人类精子在4 Mb(中程)附近出现一个主峰,而小鼠精子在933 kb附近出现肩峰,在41 Mb左右出现远距离主峰。此外,人的精子和小鼠的精子之间的接触概率衰减曲线也有差异。总之,这些结果表明人类精子不含TAD。
为了排除潜在的实验偏见,本文将小鼠精子与人类精子混合,并为精子混合物构建了一个Hi-C库(方法)。平行地,本文混合了人类HeLa细胞和小鼠HT22细胞。与本文之前的结果一致,本研究在精子混合物中观察到了来自小鼠精子而非人精子的TAD。相比之下,在人类HeLa细胞和小鼠HT22细胞中均观察到TAD结构。这些数据证实了人类精子中没有TAD。
CTCF-cohesin复合物在高级染色质结构中具有重要作用。本研究调查了人类和小鼠精子中CTCF和粘着蛋白的水平。RAD21是黏附蛋白复合物的一个亚基,存在于人类和小鼠的精子中);但是,在人类精子中未检测到CTCF,并且在使用短干扰RNA(siRNA)耗尽CTCF的细胞系中表达很弱,但是在小鼠精子,人类和对照小鼠细胞系中检测到了CTCF(图2c)。由于CTCF的消耗会导致TAD结构的破坏,因此CTCF的缺乏可能是人类精子中TAD结构丧失的基础。
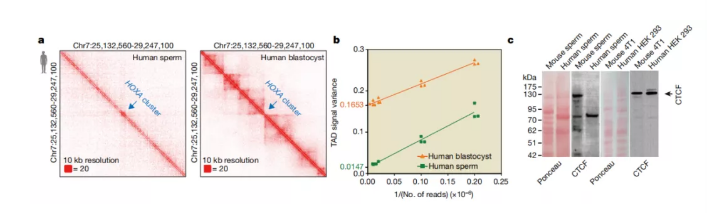
图a 人类精子和胚泡中HOXA簇周围的相互作用热图,分辨率为10 kb(生物学重复; n = 3)。
图b 人精子和胚泡中TAD信号方差与read深度(1 /读取次数)的线性回归曲线。在y轴上标记了人类胚泡和精子的回归线的线性外推。在每个读取深度进行降采样分析3次(n = 3)。
图c 用Ponceau染色的小鼠精子,人精子和体细胞系中CTCF的Western印迹。黑色箭头表示CTCF波段。每个样品在两个生物学独立的重复样本上重复实验。
图2. 人类精子不包含传统的TAD结构
3、TAD边界的建立
TAD结构在人类2细胞胚胎中并不明显。但是,两细胞胚胎中的某些区域显示出绝缘子结合的迹象,可以分隔上游和下游相互作用。在胚胎后期,这些区域大部分成为TAD边界(图3a); 这些区域因此可以被视为未成熟的TAD边界。在这项研究中,本研究将未成熟的TAD边界和成熟的TAD边界都定义为绝缘边界。然后,本研究分析了人类胚胎发育过程中绝缘边界的动力学。本研究的数据表明,分别在2细胞,8细胞,morula 和胚泡阶段分别形成635、905、317和306个绝缘边界(图3a)。本研究还在小鼠2细胞胚胎中发现了未成熟的TAD边界,并确定了小鼠阶段获得的绝缘边界。比较了人类样品中2细胞阶段的绝缘边界与胚泡阶段的总边界,结果表明2细胞边界与胚泡边界的30%重叠(图3b)。本研究的数据还显示ZGA阶段包含胚泡中67%的边界,这与小鼠模型中的比例相似(图3b)。此外,当将ZGA阶段的人类边界与小鼠的边界进行比较时,发现存在明显的重叠(图3c)。例如,本研究在人和小鼠的ZGA阶段发现了TTC1和CCNG1基因周围的绝缘边界。
接下来,作者试图确定在早期阶段优先形成绝缘边界的基因组区域。在2细胞阶段首先获得边界的基因组区域与持家基因的距离小于在后期阶段获得边界的边界区域的距离(图3d)。在小鼠胚胎中观察到了类似的结果。这些数据表明,在较早阶段获得的绝缘边界往往位于人和小鼠的看家基因周围。作者还发现边界附近的管家基因的表达水平倾向于高于其他管家基因的表达水平。
据报道,重复元素与细胞系中的TAD边界相关。因此,作者分析了胚胎中特定于阶段获得的边界周围重复元件的富集。作者的数据表明,在人类早期阶段,Alu重复序列(而不是LINE或MIR重复序列)(图3e)富集在绝缘边界周围。在小鼠胚胎中观察到了相似的结果。例如,在人类或小鼠RAB5A基因周围的2细胞阶段获得的绝缘边界被建立在Alu密集区。此外,作者的数据表明AluS元素在2细胞阶段获得的绝缘边界周围高度富集(图3e)。此外,与其他阶段相比,在2细胞阶段获得的绝缘边界周围的AluS重复序列在裂解阶段得到了高度表达。总体而言,这些结果表明,人类胚胎中绝缘的边界倾向定位在Alu密集区周围。
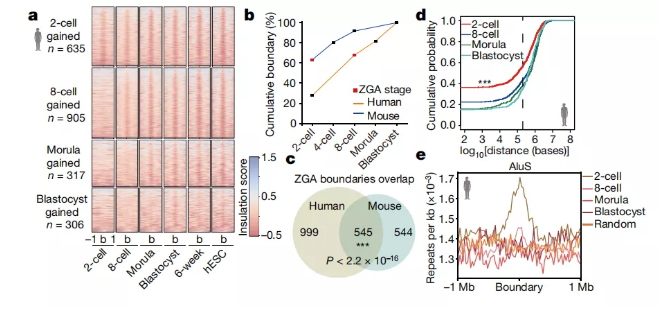
图a 绝缘得分的热图,以在特定阶段(±1 Mb范围)获得的绝缘边界为中心。n,特定阶段获得的绝缘边界的数量;b,绝缘边界中心。
图b 相对于胚泡边界数,每个阶段中绝缘边界数的累积百分比。
图c 维恩图,显示人ZGA边界和小鼠ZGA边界之间的重叠(χ2检验)。
图d 累积分布函数图,用于特定阶段获得的边界与人类胚胎中最接近的管家基因的距离(来自2-3个生物学重复的合并数据)。虚线表示200 kb的距离。P = 3.24×10−8(2单元vs 8单元阶段); P = 9.95×10-8(2细胞期与桑ula鼠比较); P = 3.83×10-11(2细胞期vs胚泡);双面Kolmogorov-Smirnov检验。
图e 在人类胚胎的特定阶段获得的绝缘边界处AluS元素的富集。
图3. 在人类胚胎发育过程中建立绝缘边界
4、TAD的建立依赖于ZGA以及CTCF调控染色体
先前的报道表明,TAD的建立独立于小鼠和果蝇胚胎中的ZGA。作者调查了这些特征在人类中是否保守。作者用α-amanitin处理人合子以抑制ZGA,并在8细胞阶段收集了胚胎。令人惊讶的是,在经过α-amanitin处理的8细胞胚胎中,TAD的结构模糊不清(图4a)。用α-amanitin处理的胚胎中TAD信号的相对方差也显着低于未处理的8细胞胚胎(图4b)。因此,在人类胚胎中建立TAD需要ZGA。
接下来,作者旨在鉴定ZGA期间参与TAD建立的蛋白质。粘着蛋白复合物和CTCF在高阶染色体结构中具有重要作用。因此,作者研究了这些蛋白质表达的差异。粘附蛋白复合物的亚基,例如RAD21,已经在ZGA之前在人类胚胎中高度表达。相比之下,当在人类胚胎中首次观察到TAD结构时,CTCF的表达在ZGA阶段之前非常有限,并且在8细胞阶段急剧增加(图4c)。在经α-amanitin处理的8细胞胚胎中,CTCF表达受到抑制。一致地,免疫染色图像显示在2细胞核中几乎未观察到CTCF蛋白(图4d)。CTCF明显存在于未经处理的8细胞核中,但在经α-amanitin处理的8细胞核中却不存在(图4d)。这些结果表明CTCF表达需要人ZGA。
接下来,作者研究了在人类胚胎中建立TAD对CTCF的需求。作者通过将CTCF siRNA(siCTCF)注入人受精卵来抑制CTCF的表达,并在morula期收集胚胎(图4d)。值得注意的是,在siCTCF morula中几乎没有观察到三角形TAD结构(图4e)。相对的TAD信号方差支持抑制siCTCF morula中TAD的建立。一致地,大多数TAD边界在对照morula中消失,而在siCTCF morula中变弱。因此,本研究的数据表明ZGA期间CTCF表达是人类胚胎中TAD建立所必需的。
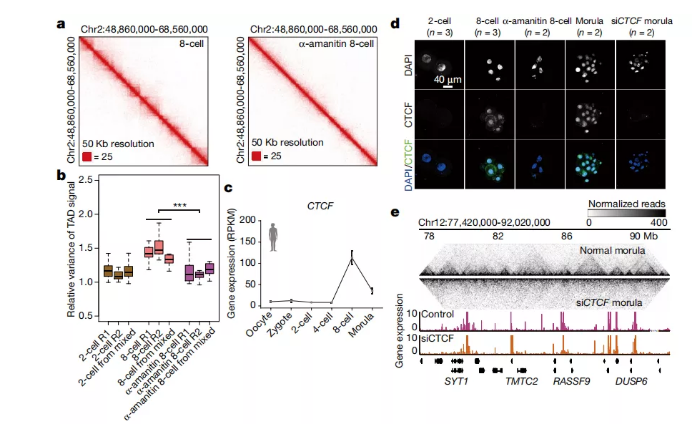
图a 人8细胞和经α-amanitin处理的8细胞胚胎中的相互作用热图。
图b 人2细胞(n = 3),8细胞(n = 3)和经α-amanitin处理的8细胞胚胎(n = 3)中TAD信号相对方差的箱形图。方框显示第25、50和75个百分位,胡须显示1.5倍的四分位间距。***对于8细胞和α-amanitin处理过的8细胞之间的所有成对比较,校正后的P <0.001(带有Benjamini-Hochberg多重检验校正的双面Wilcoxon秩和检验)。
图c 人类胚胎发育过程中CTCF表达的动态(来自参考文献22的表达数据;每个阶段3至20个细胞)。数据为平均值±s.e.m。RPKM,每百万个映射读操作的每千个转录本的读操作数。
图d CTCF在人类胚胎中的免疫荧光(n = 2-3)。比例尺40μm。
图e 跟踪未处理的对照morula和siCTCF morula中的TAD结构,其中覆盖了基因表达。
图4. CTCF调控人类胚胎中染色质的建立
总结
尽管人类和小鼠胚胎都显示出高阶染色质结构的全基因组重编程,但人类和小鼠胚胎之间的染色质结构存在很大差异。本研究的数据为哺乳动物胚胎发育过程中染色质结构的建立提供了宝贵的资源和机制的见解。
文献下载:
https://international.biocloud.net/zh/article/detail/31801998
(复制链接到浏览器获取原文,如果没有云平台账号需要先注册)
推荐阅读:
走近Hi-C数据分析,解密染色质三维结构
3D技术解密染色体构象无限可能
玩转Hi-C互作|揭示胚胎发育过程的重编程模式
科普篇 | 关于hot技术–Hi-C,你了解多少
Hi-C研究的“奠基石”来了!!!
Hi-C|多组学分析识别人胰腺β细胞和功能的顺式调节网络
心力衰竭缘何发生?用三维视角发现不一样的风景
文献套路之Hi-C和ATAC-seq联合发NC








 京公网安备 11011302003368号
京公网安备 11011302003368号