英文题目:Elevation of soybean seed oil content through selection for seed coat shininess
中文题目:通过选择种皮发亮性来提高大豆种子油含量
发表期刊:Nature Plants
影响因子:13.297
发表时间:2018年1月1日
研究背景
大豆(Glycine max)是从6000到9000年前的东亚野生亲缘大豆中驯化而来,导致了巨大的形态和生理变化,统称为“驯养综合症”。一些与驯化有关的性状(DRT)受一主要QTL控制,并且不同DRT所基于的某些QTL区域重叠。
许多豆科植物的种皮上都有一层含有致敏性过敏原的泥膜,使得种子不易被看见,为潜在的掠食者提供了双重保护,保护后代。然而,无泥膜的光泽的种子对于人类消费和健康是有利的,并且是驯化选择的目标。较早的研究提出,三个互补基因B1,B2和B3控制花开发育,但多项研究仅检测到13号染色体上的B1基因座。
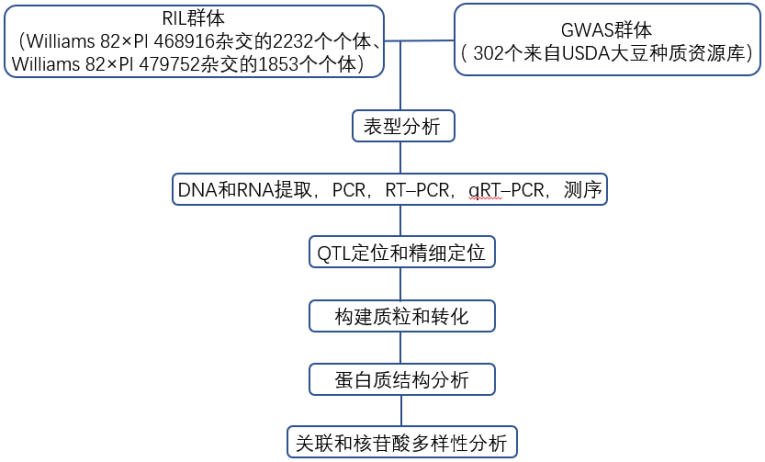
技术路线
结果展示
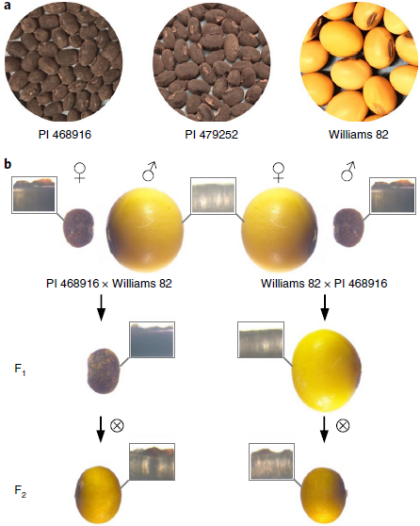
图1. G. max、 G. soja及其子代的种皮光泽
为了确定从开花到无花表型驯化过渡的基础关键基因,将无花大豆品种Williams 82引入两个高度不同的开花G. soja品种PI468916和PI 479752,并获得了由大约3500个RIL组成的两个F6:7重组自交系(RIL)群体。以Williams 82作为母本的杂交种子(F1种子)没有种皮开花,而衍生自F1植物的F1:2种子则具有种皮开花。而来自以Williams 82作为父本的杂交的F1和F1:2种子均携带种皮开花(图1b)。两个RIL群体的两个子集的表型分析显示开花与无花表型的比例为1:1。根据种皮开花与母果荚果内果皮观察表明,两种种皮开花主要由单个基因控制,并且在表皮上,开花表型为显性或部分显性。值得注意的是,开花RIL之间的种皮开花数量不同,这可能反映了少量QTL调节种皮开花积累的影响。
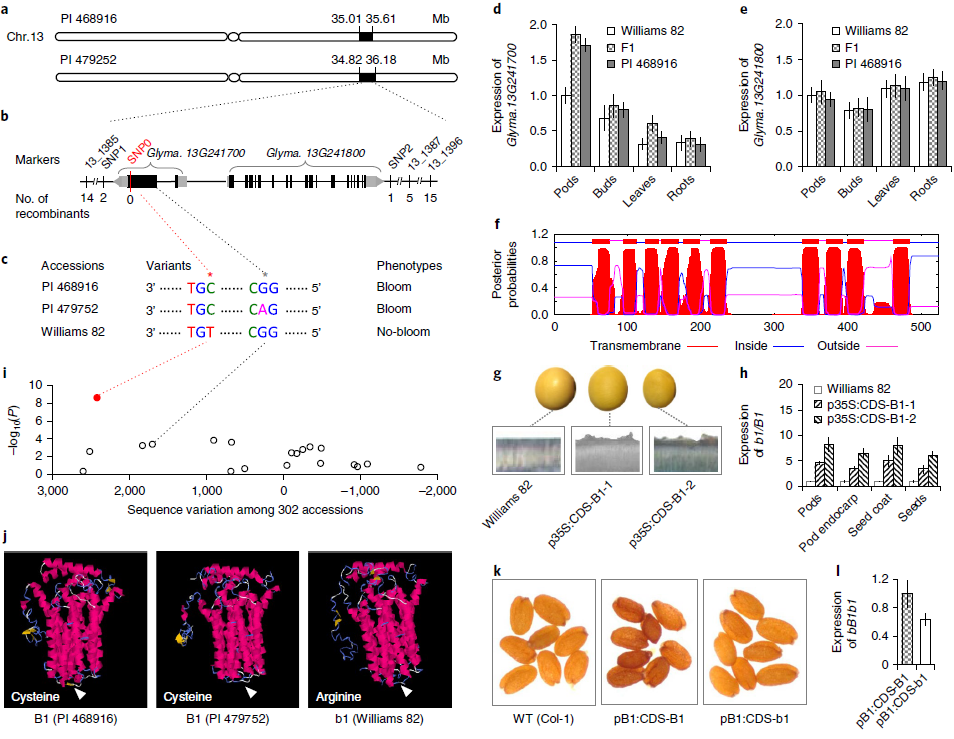
图2. B1基因克隆
随后对RIL的两个子集进行处理,以通过测序(GBS)进行基因分型。基因型和表型数据的组合在PI 468916和PI 479752中在13号染色体上种皮开花的基础上定义了一个区域(图2a),该区域与先前映射的B1区域重叠,表明这两个种质由B1基因座控制。在映射区域内的其他标记用于鉴定两个RIL群体中与B1基因座之间的重组体,最后根据大豆参考基因组序列将B1基因座精细映射到一个包含两个基因(Glyma.13G241700、Glyma.13G241800)的14.5 kb区域(图2b)。对三个亲本系的两个基因进行测序,Williams 82和两个大豆亲本之间的差异只有一个SNP位点,即Glyma13G241700的编码序列(CDS)中的一个(C到T)点突变,导致氨基酸从半胱氨酸变为精氨酸(图2c)。花后5周,Glyma.13G241700在发育中的豆荚中最高表达,其在PI 468916和(Williams 82×PI 468916)F1中的表达水平相似,但均明显高于Williams 82(图2d)。相比之下,两个亲本中的Glyma.13G241800和F1的表达水平没有显着差异(图2e)。这些观察结果表明,双亲中的Glyma.13G241700最有可能成为B1的候选基因,预计B1编码跨膜转运蛋白样蛋白(图2f)。
然后将来自PI 4768916的Glyma.13G241700的CDS与花椰菜花叶病毒35S启动子融合,并将融合构建体(p35S:CDS-B1)引入Williams82。两个独立转化事件各自获得约20个T1转基因种子。如图2g所示,在所有转基因种子的表面均观察到种皮开花,但在非转基因对照中却没有,证明Glyma.13G241700是B1基因座。在R5(种子发育)阶段,由35S启动子驱动的转基因B1在发育中的豆荚,豆荚果皮,种皮和种子中的表达水平显着高于Williams 82中的b1(图2h),并且在四个组织中的每一个中,转基因B1的表达水平与T1:2种子的表皮表面积累的泥膜量呈正相关。
检查先前重新测序的62个G. soja种质和240个G. max种质是否存在种皮开花和B1位点的序列变异。发现2大豆和Williams 82之间B1的CDS内(C到T)多态性与302个种之间种皮开花的表型差异完全相关(图2i),提示(C到T)点突变是表型转变的原因。预计该点突变会导致该基因编码的蛋白质的螺旋结构丢失,而两个大豆亲本之间的另一个SNP(A到G)并未导致该蛋白质的任何明显结构变化(图2j)。
随后,将来自PI 468916的B1的CDS和来自Williams 82的b1分别与B1启动子区域融合,并将融合的pB1:CDS-B1和pB1:CDS-b1构建体引入拟南芥以获得T2转基因品系。由于拟南芥的种子较小且种子表面粗糙,因此无法清楚地区分转基因种子与非转基因对照之间的种子表面纹理。然而,pB1:CDS-B1转基因种子的表面比pB1:CDS-b1转基因种子和非转基因对照的表面更苍白和暗沉(图2k)。与G. soja和G. max中的B1 / b1等位基因相似(图2d),pB1:CDS-B1在拟南芥背景中的表达水平明显高于pB1:CDS-b1(图2l)。 B1 / b1之间的C到T多态性与基因的表达水平有关。
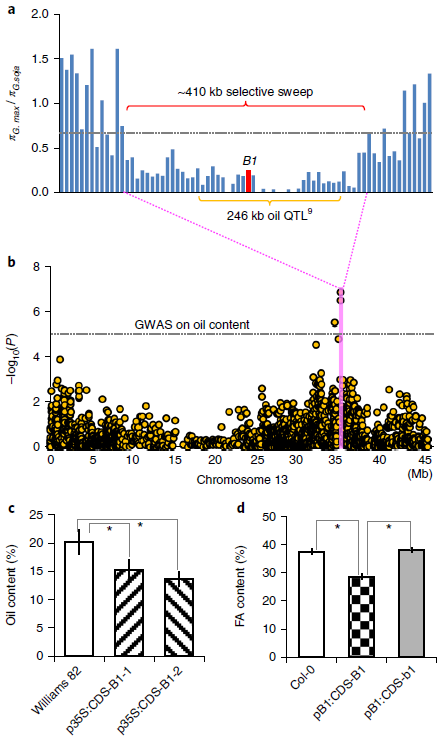
图3. B1基因座对种子油含量的多效性影响
先前通过全基因组关联研究(GWAS)使用302个重测序种质的子集,确定了潜在的主要QTL种子油含量,包括46 个G. soja种质和127个 G. max种质的种子油含量信息(www.ars-grin.gov/npgs)和一个246 kb 的QTL区域在35,194,140 bp处达到峰值,位于B1基因座的下游约31 kb处(图3a)与籽油含量的变化显着相关。由于G. soja和G. max的种子油含量差异很大,前者的平均值约为10.9%,后者的平均值约为18.0%,因此认为该油脂QTL为可能是造成栽培大豆种子油含量升高的原因。
由于B1位点和油脂QTL均被定义为一个约410 kb的“驯化”区域(由大豆驯化形成)(图3a),想知道这两个基因座(如果不同)是否通过连锁同时选择,或单个基因座是否对这两个性状具有多效作用,从美国农业部大豆种质资源库(www.ars.grin.gov/npgs)中选择全部70个开花的G.max品种和从先前选择用于调查GWAS种子油含量的遗传多样性的这个收集物中的52个“无花”的G.max品种。利用来自这122个种质的全基因组SNP数据,检测到与B1选择性清除区域中种皮开花相关的种子油QTL(图3b),表明B1基因座可能对种子油含量具有多效性作用。据推测,与非转基因对照相比,来自两个独立事件的大豆p35S:CDSB1转基因种子均显示出种子油含量显着降低(4.5%和6.9%)。种子油含量降低的水平似乎与转基因的表达水平相关(图2h)。与pB1:CDS-b1转基因种子或非转基因对照相比,拟南芥pB1:CDS-B1转基因种子中的脂肪酸含量也显着降低,但在pB1:b1-CDS转基因种子和非转基因对照之间未检测到种子油含量的显着差异(图3d),表明(C到T)多态性是表型差异的原因。
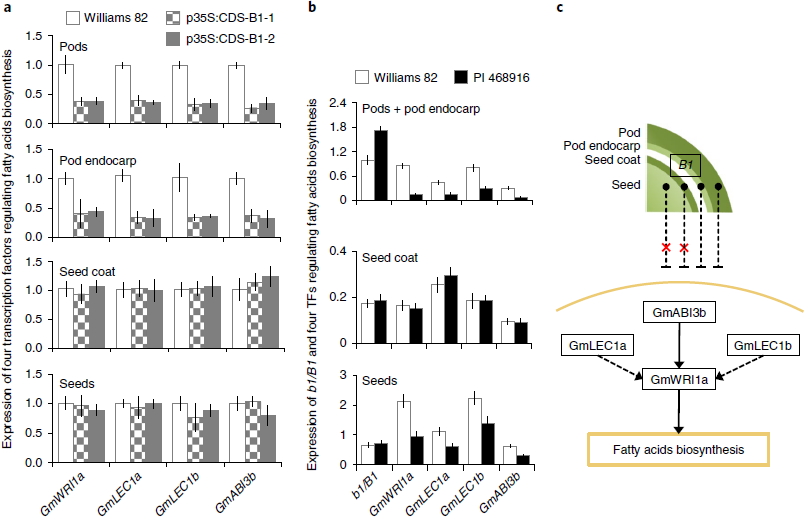
图4. 调控大豆脂肪酸生物合成的四个转录因子基因的表达水平和相互作用
为了阐明B1介导降低种子油含量的机制,分析了Williams 82发育豆荚、豆荚内果皮、种皮和种子中四种转录因子GmWRI1a,GmLEC1a,GmLEC1b和GmABI3b的表达水平。B1和PI 468916的T1转基因植物在R5阶段过表达。这些转录因子上调了大豆种子中脂肪酸的生物合成,其表达水平与种子油含量呈正相关。在B1的过表达下发育中的豆荚和豆荚果皮中四种转录因子的表达水平均显着降低而在发育中的种皮和种子中未观察(图4a)。Williams 82和PI 468916之间的B1 / b1表达模式与之呼应(图4b)。表明B1基因不影响大豆种子中脂肪酸的合成,是通过下调脂肪酸生物合成影响荚果(图4c)。
总结
B1基因座对种皮开花和种子油含量均具有多效性,为进一步分离B1介导的两个重要种子性状的基因网络奠定了基础。尽管已经在种群水平上对许多植物物种进行了测序和重测序,但有限数量的驯化相关基因,其中表型转变的致病性突变已阐明。部分原因可能是由于基因-环境相互作用和各种基因-等位基因相互作用(包括多效性)决定了驯养综合征的复杂性。最近的一项研究表明,在非洲水稻驯化过程中人为选择SHATTERING 4的无意义突变会导致不破粒但颗粒尺寸较小。多效性并不总是对古代和现代农业有利。










 京公网安备 11011302003368号
京公网安备 11011302003368号