一、百迈客Hi-C取样要求
1、基本要求
1.1安全
1)人身安全:现有实验条件下(采取一定防护后),样品对实验人员本身无伤害
2)环境安全:样品对室内、室外环境无影响(以免因为不小心导致一些活体样本进入外界 环境造成不良影响)
1.2无污染
1)植物样本不得有其它植物的污染,不得有病害,不得有虫害(尤其是一些肉眼不容易发 现的虫卵等)
2)全血样品不得引入取血物种本身携带的病菌、病毒等潜在污染
1.3依据“理论”&“实践”
1)“理论”:基于各种实验原理的理论依据
2)“实践”:基于 BMK 本身积累的多物种、多样品的项目经验
1.4送样说明
1)客户或销售人员应将样本的信息详细说明,所有样品必须标注好关键样品信息:如物种名 称、样品名称、到样日期、是否需要返样等
2)样品信息单必须早于或与样品同时到达公司,一则方便样品中心录样,二则方便项目尽快 启动
3)因为样品首次取样不足、质量不好或信息单未及时到位造成项目进度延后时需要由客户或 销售部承担相关责任(特殊项目除外)
4)因公司内部培养条件不能同时满足各种物种的生长需求,因此,送达活体样品应该尽量是 送到即可进行实验的样品(量足,质好),不建议在公司保存过长时间,防止培养样本死亡
5)所有需要特殊关注的样品,在华开任务单中需要备注相关信息,并提前邮件通知 Hi-C 相关 注意事项;特殊物种需要书面告知材料培养条件(光、温度、水、肥 or 有机营养物等等)
6)生长状态趋于不好的样品,或一些离体枝条需要提前与实验沟通,保证到样后可及时处理 样品
1.5法定节假日期间和周末送样要求
1)节假日当天及假日前后各一周不建议再到样, 如遇特殊情况需要节前一周与实验平台沟通送样需求
2)周末休息日2 天不建议到样,如遇特殊情况需要节前一周与实验平台沟通送样需求
2、动物样本-全血
2.1新鲜血液
血液采集后加入含 EDTA 或柠檬酸钠抗凝管中(因肝素钠抗凝会影响后续实验,故不 建议用肝素钠抗凝),轻轻颠倒十次混匀,室温正立放置,平衡 2 h 后立即送样,并尽量确 保 24h 内运至实验室
2.2冻存血液
血液采集后加入含 EDTA 或柠檬酸钠抗凝管中(因肝素钠抗凝会影响后续实验,故不 建议用肝素钠抗凝),轻轻颠倒十次混匀,室温正立放置,平衡 2 h 后直接液氮速冻,干冰 运输
2.3血液需求量
每一个样品,建议送样 1~2 mL
2.4全血取样注意事项(防止污染、溶血)
1)取样前要做好消毒处理:包括取样部位、取样器材、取样者戴的手套等,防止所取血液 样品被物种本身携带的细菌等污染物污染
2)准备柠檬酸钠或 EDTA 抗凝管(抗凝管有多种规格)
3)依据抗凝管的实际规格采取全血样品,比如:10mL 规格的抗凝管可以取样 10mL
4) 取完血后,迅速轻柔颠倒混匀全血样品,保证血液与抗凝剂充分混匀
5)天气较热时:含有血液样品的抗凝管运输时使用冰袋低温运输,注意,冰袋不要与抗凝 管直接接触,以防止血液冻凝;天气较冷时:含有血液样品的抗凝管运输时无需加冰袋 运输
3、动物样本-组织标本
3.1冻存样品取样要求
1)应保证组织样品新鲜冻存,保存时间不要太长(以冻存时间 1 个月为宜)
2)应将肌肉表面附着的血液、脂肪、毛皮等非肌肉组织处理干净
3)直接液氮速冻干冰运输
3.2冻存组织样品理论用量
组织量 2 g 为佳,最少 1 g;1 g 可满足 3 个文库构建,最低要求至少 0.2 g
4、动物样本-细胞
4.1取样要求
需要进行甲醛交联固定后送样
4.2细胞样品量要求
一般来讲 2*10^6个细胞满足一个 Hi-C 文库,建议培养到 107 个细胞用于固定,以保证 试验的可重复性, 由于细胞的数量可能会影响 Hi-C 试验的质量,因此需要细胞数目尽量精确
4.3交联细胞
1) 取 10^7 个新鲜活细胞置于 15 mL 离心管中,加入 10 mL 的 cold 1×PBS 摇匀,1000 g, 4℃离心 2 min
2)吸弃上清,每管再次加入 10 mL 的 cold 1×PBS 轻混匀,1000g ,4℃离心 2 min
3)吸弃上清,用 10 mL cold 1 × PBS 重悬沉淀,加入适量(570 µL)37%甲醛(终浓度 2%)混匀,室温放置 10 min(1-2 min 混匀一次);(注意甲醛需要使用 sigma 等进口品 牌,以免影响固定效果,也可以由当地销售申请实验室寄送固定试剂)
4)加适量(710 µL)2 M 的甘氨酸(常温保存)终止反应(终浓度 0.125 M),室温混匀5min,冰上放置15min
5)固定好的细胞 600 g 4℃ 离心 8 min ,弃上清
6)1 mL cold PBS 重悬沉淀,600g 4℃ 离心 8 min ,去上清
7)液氮速冻干冰运输或-80℃保存
注:做到此步直接液氮速冻,干冰运输,信息单中备注:“细胞交联完成”
5、真菌样本
5.1冻存样品—“慢冻快融”或“直接速冻 ”
1) 应保证菌体为对数生长期,保存时间不要太长(以冻存时间 1 个月为宜)
2)直接液氮速冻干冰运输
5.2组织样品理论用量
组织量 1 g 为佳,最少 0.2 g
6、植物样本
6.1活体植株
1)幼嫩植株:种子培育的低龄幼苗、组培苗——全部叶片、部分幼嫩茎
2)成熟植株:茎尖组织及靠近茎尖的第 1-2 片幼嫩叶片
3)取样量:保证每一个库的理论用量 1g
4)其它:特殊贵重活体样品需要客户提供样品的种植、保存条件,以保证样品的正常生长
6.2离体枝条
1)枝条选择:枝条顶端有待萌发叶芽,且叶芽周边有几片幼叶(到样后会选择叶片进行实验);枝条中下端保留部分成熟叶片
2)枝条预处理:剪断枝条, 自底端往上约 5 cm 用浸透水的吸水纸包裹好,放入自封袋, 袋中 喷水,填充部分空气,密封袋口
3)枝条运输: 自封袋放入泡沫箱,箱体内侧壁放部分冰袋(保证低温运输),冰袋与自封袋 间放置泡沫板,防止冰袋积压样品或因冰袋与样品直接接触导致样品被冻伤
4)运输时间:保证 24h内到样,最多不得超过 3天
5)取样量:保证每一个库的理论用量1g
6)其它:取“离体枝条”仅限比较难以获得幼嫩活体植株的项目,如野外采样、植株过大等导致的取样或运输比较困难的项目;离体枝条到样后如有损伤等将不再用于实验;离体枝条如果保存、运输不善会存在部分潜在风险:即得到的实验效果可能会比活体植株检测结果 稍差(理论上的潜在风险)
6.3冻存植物组织
6.3.1冻存组织风险
1)植物组织液氮速冻后容易造成破碎,导致后续固定等操作无法有效实施
2)植物组织破碎严重时会对核甚至染色体造成物理机械损伤
6.3.2取样要求
1)从植物体上,取下新鲜组织,取材后需用清水将材料表面的灰尘或泥土冲洗干净,吸干
2)如果组织体积较大,应在冰上将组织切成小块薄片
3)将处理好的组织样本混合均匀保存于 2mL或更大体积的旋盖冻存管中,每份植物> 1 g,准确标记样品名称
4)迅速置于液氮中冷冻至少 5min ,然后转移至-80℃冰箱中保存
5)为确保实验的顺利,建议样品备份 1-2 份,植物> 1 g/份,以防部分样品降解重新取材、制备或送样
6)应保证组织样品新鲜冻存,保存时间不要太长(以冻存时间 1 个月为宜)
7)运送方式:将冻存管置于密封性好的塑料袋中,用胶布缠到冰袋上,并在泡沫盒中装入 足量的干冰进行运输
6.4其他植物样本
1)非叶片(活体植株):有常规提取经验,须为 DNA 提取率高、黏度低的部位
2)非叶片(离体植株):处理与运输与离体枝条相同,有常规提取经验,须为 DNA 提取率高、黏度低的部位
3)取样量:保证每一个库的理论用量 1 g
4)非叶片样品适用于叶片难提取的植株或老师的特殊要求,此类样品DNA提取失败的风险高于叶片样本,需要销售与老师交代清楚
6.5植物取样注意事项
1)建议一次送样量在 1~4g
2)所有待取的幼嫩组织长势必须正常(无病虫害、无营养缺失)
3)对于需要保留茎尖的特殊情况,取样时不取茎尖组织,只取紧靠近茎尖的第1-2 片嫩叶
4)因为通常裸子植物比被子植物更难选择适合的解离液,裸子植物的叶子大多为针形、 线形、鳞形,叶片表面有较厚的角质层,细胞内次生代谢物多,这对提取完整的细胞核极为不利,因此,选取
萌发的新鲜幼苗作为材料会更合适
5)客户没有条件寄送活体植物样本时,可以选择自己固定,由当地销售像实验室申请寄送固定试剂 ( β-巯基乙醇需要老师自己准备)
7、Hi-C交联流程
1)配制NIBuffer工作液 1 ,配制好后置于冰上放置
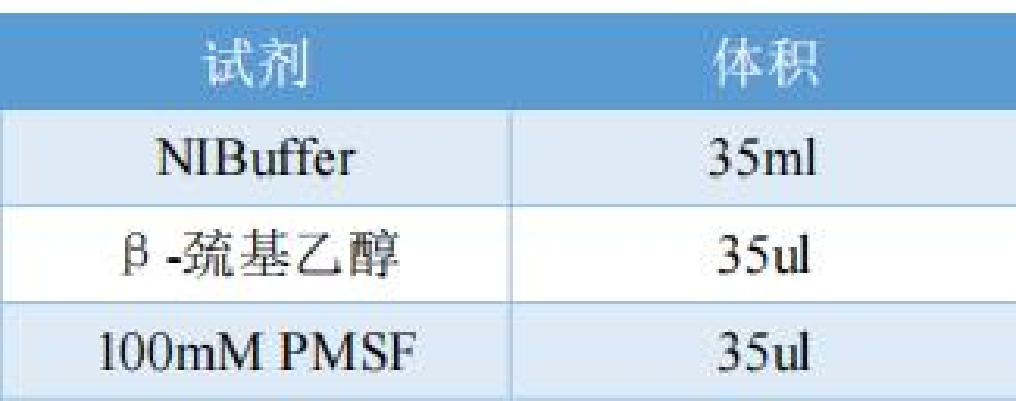
2)取2g新鲜幼嫩组织样品,用冰水清洗干净
3)用剪刀将样品组织剪碎,放置于50mL 离心管中
4)加入上述配制好的NIBuffer 工作液1
5)加入 2 mL 36%甲醛溶液,室温条件下,旋转杂交炉中反应 90 min
6)加入2.5 mL 2M甘氨酸,连续手摇 5 min终止交联反应
7)滤掉液体,用灭菌水清洗至无泡沫为止
8)吸干样品表面水分,将样品置于预冷的50ml离心管中,并将管置于液氮中
9)-80℃保存或干冰寄送
二、百迈客 ATAC-seq 取样要求
1、生物学重复
取样应尽量减少重复间样品的差异。尽可能做到重复在取样时间、部位、处理条件等方 面保持一致,不同样本的性别、年龄尽量相同,否则可能会影响实验结果的可重复性及可信度
每个处理至少3个生物学重复
2、样品的保存与运输
简单处理并标记后,应立即浸入液氮中速冻,之后保存于-80℃冰箱,以免实验操作前 样品降解的可能性
3、取样要求
3.1组织样本
1)获取组织样本
A.动物:取下新鲜的组织,立即剔除结缔组织和脂肪等杂质部分,用预冷的 1×PBS 溶液漂洗,将组织表面的残留血液冲洗干净
B.植物:从植物体上,取下新鲜组织,取材后需用清水将材料表面的灰尘或泥土冲洗干净,吸干
2)如果组织体积较大,应在冰上将组织切成小块薄片
3)将处理好的组织样本混合均匀保存于2 mL或更大体积的旋盖冻存管中 ,每份组 织>50mg ,准确标记样品名称
4)迅速置于液氮中冷冻至少 5min ,然后转移至-80℃冰箱中保存
5)为确保实验的顺利,建议样品备份 1-2 份,组织>50mg/份,以防部分样品降解重新取材、 制备或送样
6)运送方式:将冻存管置于密封性好的塑料袋中,用胶布缠到冰袋上,并在泡沫盒中装入 足量的干冰进行运输
7)注意事项
A.昆虫类样本建议进行饥饿处理后送样
B.若样本有微生物污染(细菌、病毒等),实验过程无法去除,下机数据会有污染
3.2细胞样本
3.2.1贴壁细胞
3.2.2悬浮细胞
1)细胞获取
A.将贴壁细胞用移液器缓慢地吹/刮至悬浮状,或采用胰酶或 EDTA 消化方法制备细胞悬液
B.确定细胞生长状态良好
2)按照 50万个细胞每管进行分装,准确标记后将分装好的细胞 4℃、500G 离心 5min。(到公司后解冻, 由我们再挑选 5万个相对完整的细胞核进行实验)
3)小心吸去全部上清,加入 500 µL 预冷的 1×PBS 溶液洗涤,4℃ 、500G 离心 5min
4)小心吸去全部液体,加入 1 mL 预冷的细胞冻存液,宽口枪头轻轻吹打细胞沉淀混匀, 管壁标记样本名称,慢速梯度降温冻存
5)梯度降温可参考:4 度 10min>负 20 度 30min>负 80 度过夜>液氮冻存
6)将冻存管置于密封性好的塑料袋中,用胶布缠到冰袋上,并在泡沫盒中装入足量的干冰 进行运输
7)为确保实验的顺利,建议样品备份 1-2 份,50万个/份,以防部分样品降解重新取材,制备或送样
注:若细胞样本有支原体污染,实验过程无法去除,下机数据会有污染
3.3全血样本
1)新鲜血液:每一个样品,建议送样 1~2 mL 。血液采集后加入含 EDTA 或柠檬酸钠抗凝管中(因肝 素钠抗凝会影响后续实验,故不建议用肝素钠抗凝),轻轻颠倒十次混匀,4℃正立放置,确保
5天内运至实验室
2)冻存血液:每一个样品,建议送样 1~2 mL 。血液采集后加入含 EDTA 或柠檬酸钠抗凝管中(因肝素钠抗凝会影响后续实验,故不建议用肝素钠抗凝),轻轻颠倒十次混匀,4℃正立放置,平衡
2 h 后直接液氮速冻,干冰运输
3)注意事项
A.取样前要做好消毒处理:包括取样部位、取样器材、取样者戴的手套等,防止所取血液样品被物种本身携带的细菌等污染物污染
B.准备柠檬酸钠或 EDTA 抗凝管(抗凝管有多种规格)
C.依据抗凝管的实际规格采取全血样品,比如:10mL规格的抗凝管可以取样 10mL
D.取完血后,迅速轻柔颠倒混匀全血样品,保证血液与抗凝剂充分混匀
E.天气较热时:含有血液样品的抗凝管运输时使用冰袋低温运输,注意,冰袋不要与抗凝 管直接接触,以防止血液冻凝;天气较冷时:含有血液样品的抗凝管运输时无需加冰袋运输








 京公网安备 11011302003368号
京公网安备 11011302003368号