到目前为止,已经在切除的脑组织中研究了癫痫脑中的基因表达变化,以评估所有类型的神经元、胶质细胞以及非神经细胞(血管、室管膜细胞等)的平均变化。尽管这些研究提供了一些关于基因表达大规模变化的重要信息,但仅发现了相对较小的转录组变化,即使与高度硬化组织相比也是如此。这可以很容易地通过批量测序的局限性来解释,在所有细胞类型的组织样本中平均基因表达,由于丢失特定细胞类型的信息,导致信号稀释。因此,为了研究不同亚型的神经元是如何在癫痫中受到影响的,需要通过单细胞水平精准鉴定癫痫病各亚型神经元基因表达变化。由于新鲜脑组织样本难以获取、并且解离过程会有偏差无法得到全部的细胞类型,因此新的技术单核RNA测序(snRNA-seq)的出现极大的解决目前的困境,可以直接通过冷冻脑组织抽提细胞核进行单细胞水平研究。今天,小编为大家献上近期发表在Nature Communication杂志上利用snRNA-seq研究颞叶癫痫症(TLE)的应用一文,值得大家了解更多snRNA-seq技术应用,帮助大家完成更多冷冻样本、珍稀样品单细胞水平研究。

英文题目:Identifification of epilepsy-associated neuronal subtypes and gene expression underlying epileptogenesis
中文题目:鉴定癫痫相关的神经元亚型和诱发癫痫的基因表达
发表时间:2020年10月7号
影响因子:12.121
研究背景
癫痫是一种神经系统疾病,具有自发性和反复发作的特征,其主要发生在海马体或大脑皮层区域。人们对癫痫的病理生理学仍然知之甚少。虽然有一些动物模型研究显示某些神经元亚型对癫痫发作的产生和传播有一定的促进作用,但在人类癫痫患者的相应数据却很少。这是由于癫痫发生过程中复杂的神经网络现象。
实验方法
10x snRNA-seq,Smart-seq2 snRNA-seq,RNA-seq,ISH等
结论
该项研究揭示了癫痫对神经元转录的不同影响—即虽然许多亚型表现出轻微的基因表达变化,但其对一些特定的SUB型主要神经元和GABA能间神经元产生了很大的影响。
结果
一、癫痫皮质中与疾病相关的神经元亚型
为了识别哪些神经元亚型受癫痫影响或导致癫痫,文章中比较了来自癫痫性颞皮质和非癫痫性颞皮质的snRNASeq数据,研究结果表明,在一些位置,例如,皮层上层L2_Cux2_Lamp5和L2-3_Cux2_Frem3,在癫痫和非癫痫的皮层产生的神经元之间存在明显的转录组转移(图1a)。此外,尽管癫痫病和非癫痫病样本中每个亚型的神经元数量大致相似,但观察到几种亚型中已被鉴定的细胞核数量显著减少(图1b)。在癫痫患者中,L2/3亚型的数量减少了,当对每种情况下的序列神经元总数进行归一化时,这种减少更加明显(图1c)。对于中间神经元,Pvalb_Sulf1亚型的神经元数量减少较多(图1c)。
通过基因表达相关性分析,发现癫痫和非癫痫神经亚型之间的巨大差异(图1d),这可能表明癫痫对其转录组有特定的影响。对于主要神经元,L5-6_Fezf2_Tle4_Abo、L5-6_Themis_Ntng2、L2_
Cux2_Lamp5和L2-3_Cux2_Frem3亚型在癫痫和非癫痫皮质中转录组差异大(图1d)。对于gaba能间神经元,在癫痫发作的颞叶皮层中,Vip_Cbln1、Sst_Tac1、Pvalb_Sulf1、Pvalb_Nos1和Id2_Lamp5_Nos1的转录组改变大。同时也证实了癫痫相关DE基因在具有较大转录组差异的神经元亚型中普遍存在(图1e、f)。
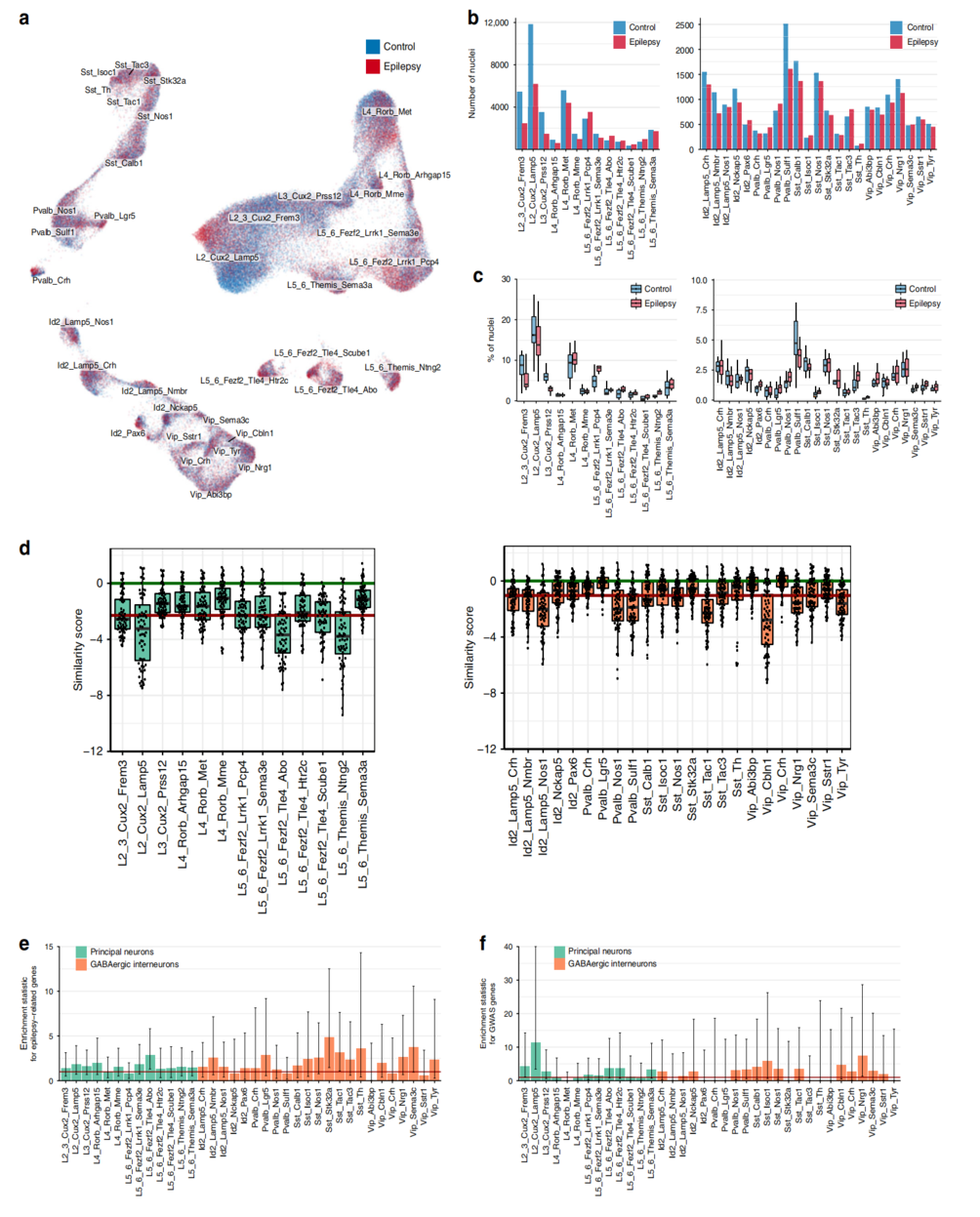
图1癫痫和非癫痫数据集的整合和疾病相关神经元亚型的鉴定
二、共有和亚型特异性癫痫相关途径
作者计算了每种已鉴定亚型GO中DE基因的富集程度,一些神经元亚型在癫痫中表现出了大的转录组改变(>100丰富的GO),但多数神经元亚型中只有少数GO,特别是对于生物过程(BP)来说,这应该与通路的生物学功能相关(图2a)。这些受影响较小的亚型中,大多数在癫痫细胞和非癫痫细胞之间也具有高的基因表达相关性(图1d),从而证实癫痫和非癫痫之间转录组相关性高的亚型中,癫痫改变的信号通路也较少。
根据GO分析,发现一些Sst亚型、Vip_Cbln1和Id2_Lamp5亚型显示DO高度富集,如局灶性癫痫(DOID:2234)、癫痫综合征(DOID:1826)和颞叶癫痫(DOID:3328)。此外,还发在L3_Cux2_Prss12、L5-6_Fezf2_Lrrk1_Sema3e和L5-6_Fezf2_Tle4_Abo主要神经元亚型中富集的与癫痫相关的DO相同。这表明,与癫痫相关的DO在不同的神经元亚型中富集差异很大,与谷氨酰胺能细胞相比,在GABAergic和Sst亚型Vip_Cbln1和Id2_Lamp5中,癫痫相关的DO在GABAergic和Sst亚型Vip_Cbln1和Id2_Lamp5中富集更广泛,显示出对癫痫的特殊易感性。
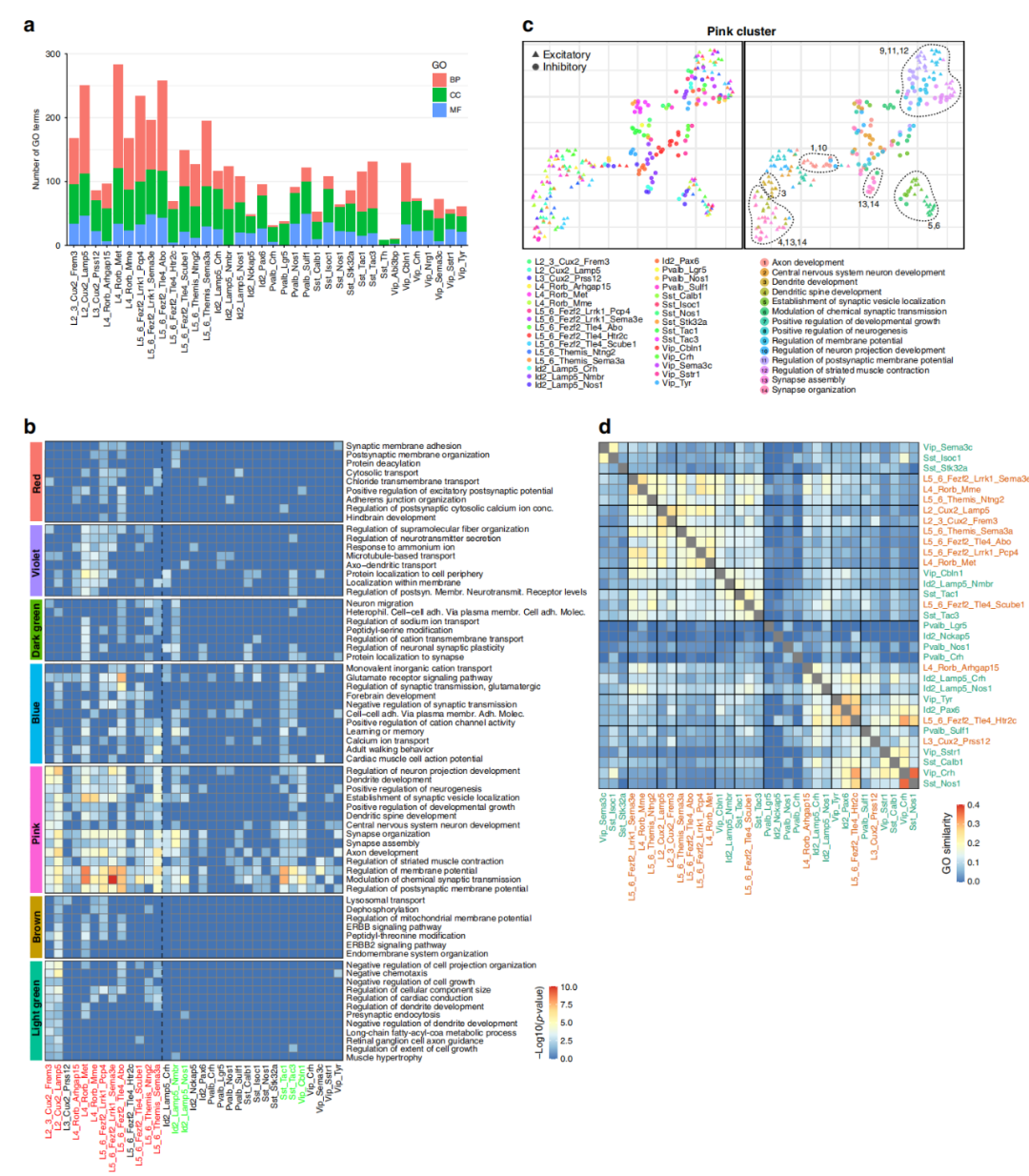
图2神经元亚型中癫痫相关通路和转录转移的鉴定
三、癫痫活动的信号通路
谷氨酸受体,尤其是AMPA受体被证明是癫痫发作的主要驱动力之一,在筛选出缺乏表达的基因后,寻找富含与奋性相关转录组学变化的亚型,并从这些GO项中绘制DE基因(图3a–d)。CKAMP44是贯穿整个颞叶皮质的主要AMPA受体辅助亚基,这一事实也强调了CKAMP44上调的重要性(图3c, d)。癫痫对AMPA受体辅助亚基编码基因的上调有相当普遍的影响。
多种谷氨酸受体亚基和神经元活性相关基因表达复杂失调,其中大部分在癫痫中未见报道。因此,虽然大多数的基因编码谷氨酸受体亚基表达上调(GRIA1、GRIA3 GRIA4, GRIK3, GRIK4, GRIK5, GRIN2B, GRIN3A, GRM1, GRM7,和GRM8),但一些是表达下调(GRIA2、GRIA3 GRIN2A, GRM5, GRIK1,和GRIK2)(图3 b, c)。
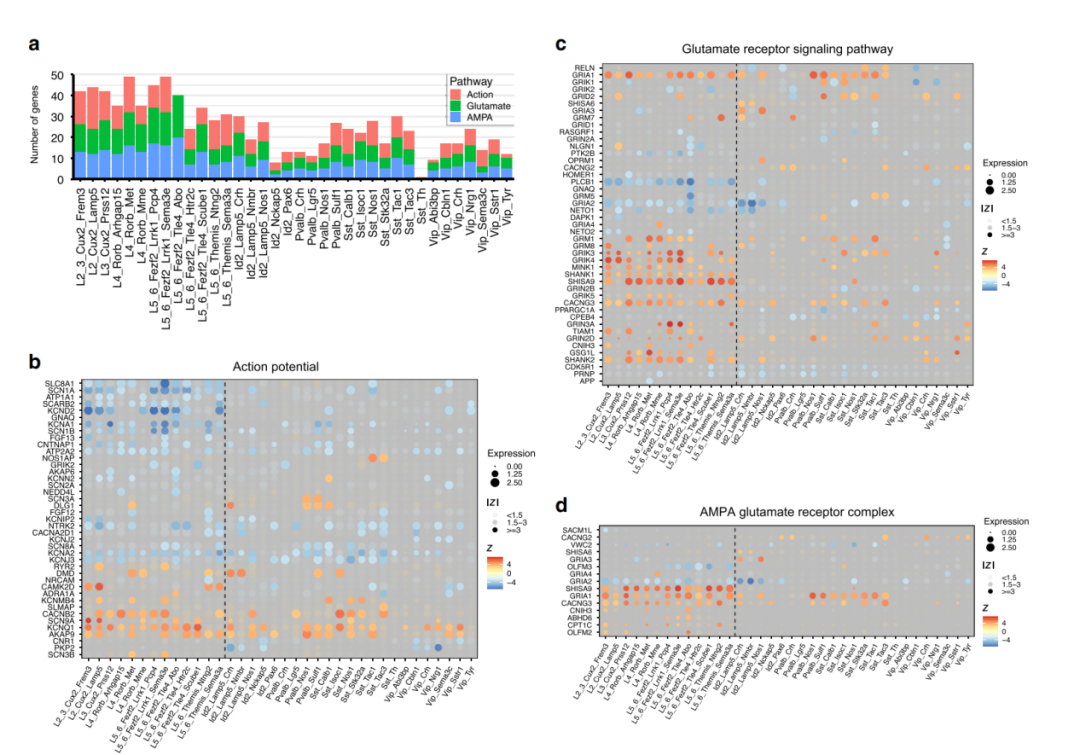
图3鉴别可能导致癫痫发作的皮层神经元亚型的信号通路和基因
癫痫患者皮层谷氨酸介导兴奋相关基因显著分层上调或下调。作者用单分子荧光原位杂交(smFISH)方法标记了几个高度调控基因的mRNA。如上所述,在主要神经元的亚型中,编码AMPA辅助亚基的许多基因分层上调。因此,在一组癫痫和非癫痫样本的皮质切片中标记了CKAMP44 mRNA,通过与Rorb和DAPI共标记,并确定了L2/3、L4和L5/6的位置(图4b)。重要的是,证实了各层中CKAMP44的表达显著上调(图4b)。
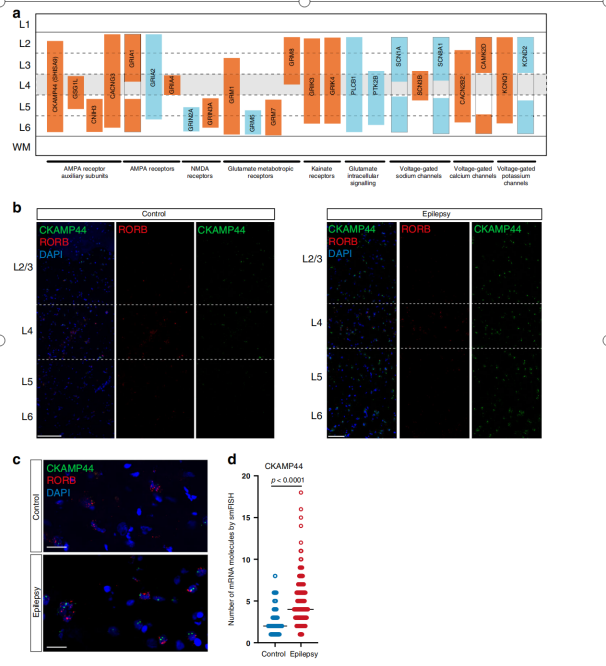
图4癫痫患者皮层谷氨酸介导兴奋相关基因的复杂分层失调
四、受癫痫影响的基因网络
在癫痫样本中,六个与癫痫密切相关的模块上调,六个下调。另外,在细胞水平分析中突出的几个涉及过度兴奋信号和癫痫发作的基因也是一个或多个癫痫相关基因模块的成员。编码谷氨酸受体亚基的基因也广泛存在于癫痫相关模块中。这些基因共表达分析捕获了主要神经元L5-6_Fezf2_Tle4_Abo和L2-3_Cux2亚型中活跃的核心转录网络。与癫痫状态相关的基因模块指向与突触和离子通道相关的转录变化,包括AMPA受体辅助亚基、谷氨酸受体亚基和电压门控钠通道,这些可能与癫痫回路异常高的兴奋有关。同时观察到主要神经元和GABAergic间神经元的受影响的亚型根据丰富的GO项的相似性聚集在一起(图5b)。因此,L2-3_Cux2和L5-6_Fezf2亚型与Sst_Tac1和Vip_Cbln1亚型共聚,而L3_Cux2_Prss12亚型与Pvalb_Sulf1亚型共聚,这可能是癫痫转录组中受影响严重的局部神经网络的基础。
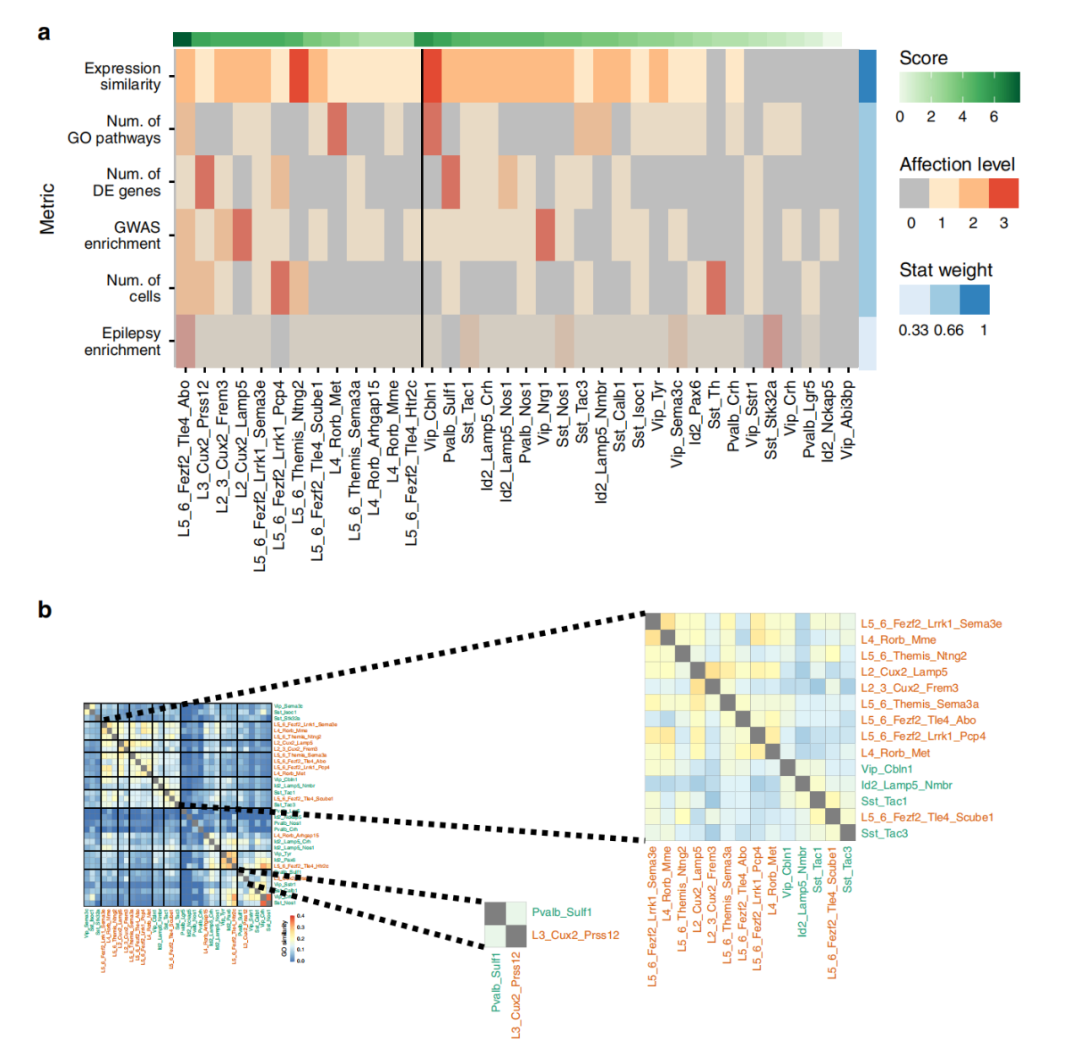
图5综合分析癫痫易受影响的神经元亚型
结论
总之,该研究通过单核转录组测序(snRNA-seq)发现癫痫患者的神经转录组发生了大规模而复杂的变化,其中一些亚型表现出了明显的癫痫驱动的基因表达异常,而其他亚型则大部分未受影响。癫痫相关的转录组改变可以聚集成包含多个神经元亚型的模块,这些神经元亚型可能是受癫痫影响的不同神经元聚集的基础。未来需要在小鼠模型和人类组织中进行转化研究,以解决哪些已确定的通路导致癫痫的产生和传播,以及哪些更能代表神经网络的稳态可塑性。
百迈客引进10xGenomics单细胞测序平台,使用Chromium系统采用微流控、油滴包裹和barcode标记等技术实现一次性分离、高效标记捕获;同时具有10x 单细胞转录组、单细胞核转录组、单细胞ATAC-seq、单细胞免疫组库、全长转录组测序、空间转录组,实现10x平台全面优质服务;已经具有大量单细胞分离捕获,极低量RNA反转录扩增建库成功经验;提供单细胞分离捕获、反转录建库、测序、标准分析和高级分析全套单细胞测序服务;强大的生信团队不仅提供基本分析,还提供细胞分化轨迹分析等多种高级分析;资深单细胞技术人员为您提供专业的课题方案设计,为您量身订造专属个性化分析。
点击下方按钮联系我们,免费获取文章思路设计方案。








 京公网安备 11011302003368号
京公网安备 11011302003368号