上一次,小编带大家一起看了两栖动物蝾螈神奇的断肢再生。那么,是否有水生动物也具有强大的再生能力呢?今天就为各位老师分享一篇关于斑马鱼心脏再生的单细胞&时空组学文章。

发表期刊:Nature Genetics
发表单位:柏林医学系统生物学研究所
影响因子:41.307
发表时间:2022.07.21
DOI号:10.1038/s41588-022-01129-5
研究背景
成年哺乳动物的心脏损伤通常会导致永久性瘢痕。然而,成年斑马鱼心脏损伤后能有效再生,这使得斑马鱼成为研究心脏再生细胞和分子机制的理想模型。在模拟心肌梗塞的低温损伤后,受伤的斑马鱼心脏会经历一个短暂的纤维化期。在此期间,受损的心肌会通过去分化和增殖进行再生,这与心肌梗死的某些方面相似。然而,在以往的斑马鱼心脏再生研究中,还没有系统的数据来确定再生细胞的状态和细胞类型的起源,对再生生态位的细胞组成、潜在的信号传递和相互作用的认识仍不全面。目前对活化巨噬细胞和成纤维细胞的定义严重依赖于转基因,可能受到观察偏差的影响,从而低估斑马鱼心脏再生过程中细胞状态的复杂性。
材料方法
单细胞RNA-seq :
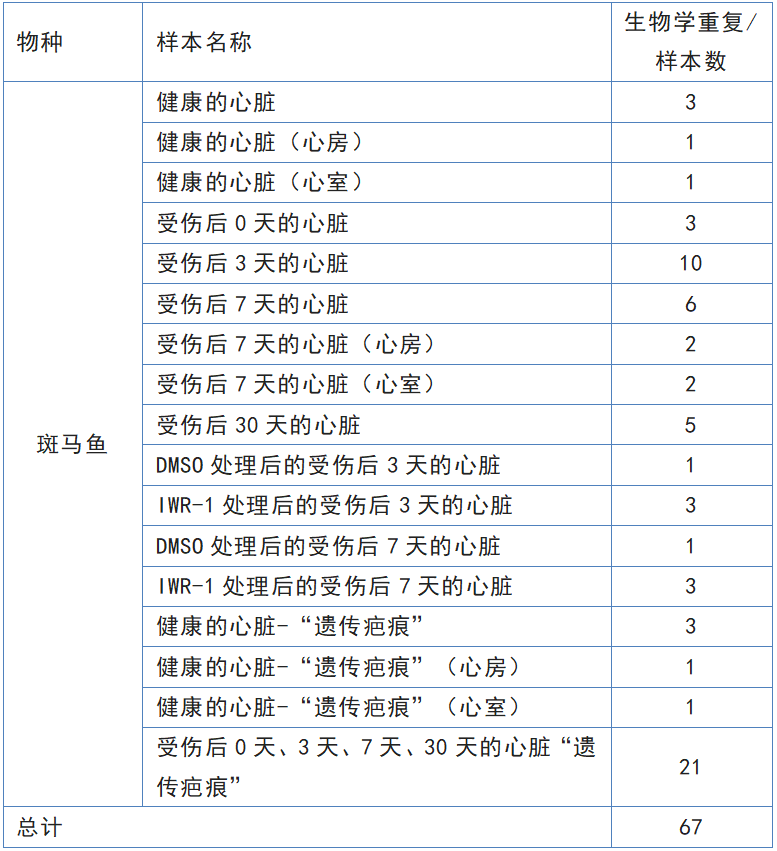
表1 实验样本一览表
空间转录组(Tomo-seq):斑马鱼心房和心室一共100张切片,每张切片分别做RNA-seq
方法:scRNA-seq、Tomo-seq、荧光原位杂交和基于CRISPR-Cas9技术的谱系追踪
研究结果
为了系统地识别健康和再生斑马鱼心脏中的细胞类型,作者对损伤前后不同阶段的大约20万个解离细胞进行了scRNA-seq(图1a)。为了准确得到细胞发育起源的相关信息,作者还应用了一种基于CRISPR–Cas9技术的大规模平行谱系追踪方法,通过注射Cas9和针对多拷贝转基因(斑马鱼系中的dTomato:一种用于斑马鱼细胞追踪和谱系分析的多光谱细胞标记)的sgRNA,创建了作为谱系条形码的“遗传疤痕”来记录早期发育中的谱系关系。
作者首先评估了健康和再生心脏中的细胞类型多样性,单细胞转录组的聚类分析显示了所有主要的心脏细胞类型。正如预期的那样,观察到成纤维细胞和免疫细胞在损伤后强烈增加(图1b)。进一步检查聚类数据发现,心脏的三个主要层:心外膜、心肌和心内膜的细胞类型之间存在一个亚结构。作者假设,由于心房和心室中这些细胞类型的功能差别,这种细胞类型的亚结构可能存在空间差异。于是使用Tomo-seq方法(一种用冷冻切片机沿感兴趣的轴对组织进行切片,然后在每个切片上进行RNA-seq的技术)进行空间分辨率转录组,并将空间数据解卷积为单细胞转录谱,可以验证一些细胞亚型在心房和心室富集(图1c)。之后再通过物理分离心房和心室,使用scRNA-seq证实了这一发现(图1d)。
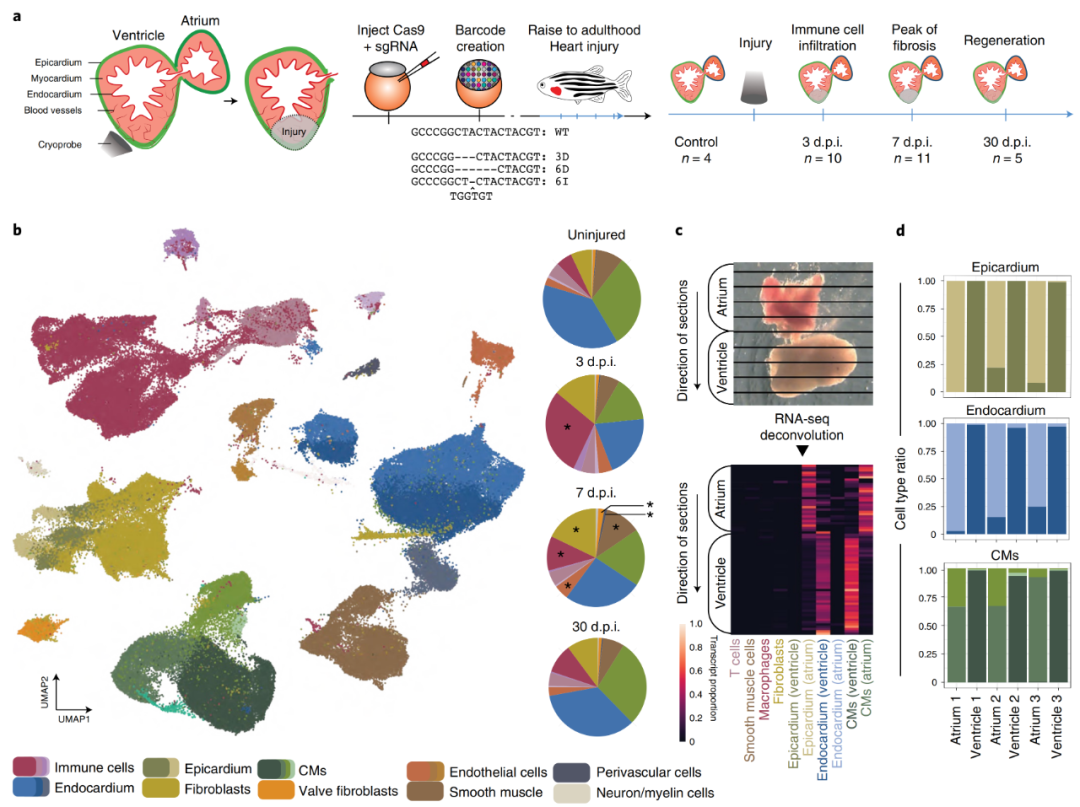
图1 再生心脏的细胞组成
作者进一步确定了心肌细胞中的一个转录亚结构(图2a)。除了以表达ATP合成和三羧酸循环相关基因(atp5pd和aldoaa)为特征的成年心肌细胞外,还检测到一个较小的与心肌细胞发育相关的基因簇(ttn.1, ttn.2, bves and synpo2lb),以及nppa——此前已被证明是边界区去分化心肌细胞的标记基因。这些去分化心肌细胞是心脏再生的标志,其数量在3 d.p.i.(受伤后天数)增加了(图2a),并与已建立的标记基因nppa22部分共定位于7 d.p.i.。
作者注意到心脏再生中三个成熟的信号因子在成纤维细胞中高度富集:合成视黄酸的酶aldh1a2、心肌细胞有丝分裂原nrg1和再生细胞外基质(ECM)因子fn1a(图2b)。为了更详细地研究心脏成纤维细胞的多样性,作者对成纤维细胞进行了亚群聚类。结果显示出惊人的多样性,有13个转录上不同的成纤维细胞聚类(图2c)。这13个基因簇在ECM相关基因的表达谱上表现出明显的差异(图2d),但它们的转录组多样性远不止于此——去除ECM相关基因后,可以高精度鉴定相同的成纤维细胞亚型。
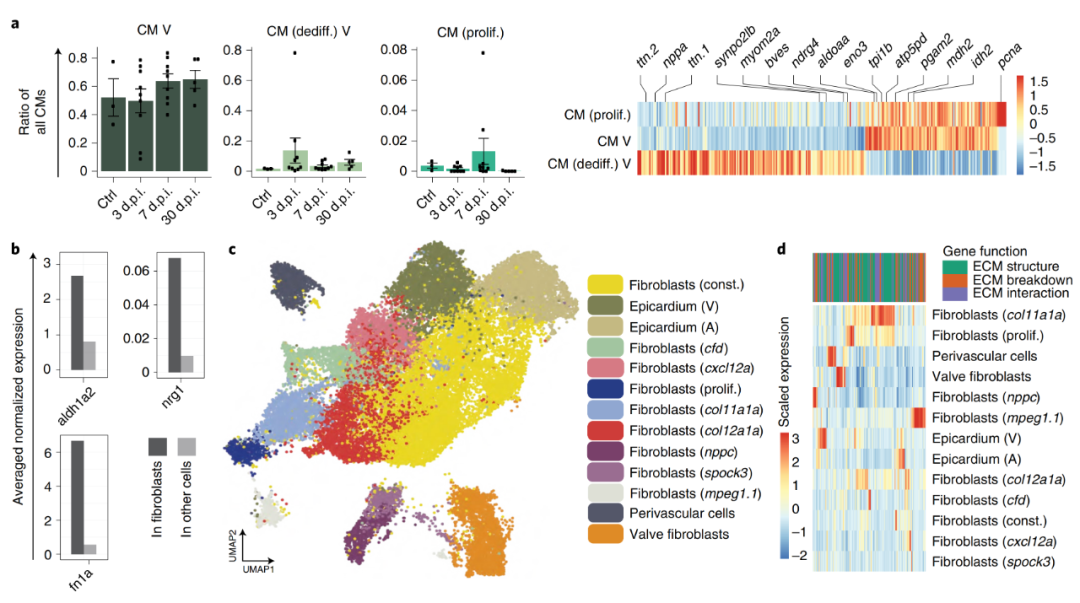
图2 心脏成纤维细胞的细胞类型多样性
3. 心脏再生成纤维细胞的鉴定
为了集中分析那些可能是再生生态位一部分的成纤维细胞亚型,作者分析了损伤后细胞簇的动力学。col11a1a、col12a1a和nppc特征表达的3簇成纤维细胞在再生高峰期短暂出现 (3、 7 d.p.i.),但在受伤前和再生完成后几乎不存在。由于其短暂性,作者将这三个基因簇称为细胞状态,而不是细胞类型(图3a)。为了对鉴定的成纤维细胞进行空间分辨,作者进行了荧光原位杂交证实了瞬时成纤维细胞状态在边界区以及损伤区的位置(图3b)。之后发现nrg1在col12a1a成纤维细胞中特别高的表达,而fn1a几乎只在col11a1a成纤维细胞中表达(图3c)。作者推断瞬时细胞状态的潜在再生功能可能是由分泌因子驱动的。生物信息学分析显示,与未损伤的对照组心脏相比,再生心脏的分泌组基因表达在3 d.p.i.和7 d.p.i.时增加(图3d)。col11a1a和col12a1a成纤维细胞中分泌组基因的表达在所有检测到的细胞簇中最高,且其分泌组基因包含在再生、形态发生和组织发育等方面具有功能的基因(图3e)。
虽然作者对单细胞基因表达谱的时空分析强烈表明了瞬时成纤维细胞的再生功能,但还需要额外的实验来验证这一假设。为了从功能上评估瞬时col11a1a和col12a1a成纤维细胞的作用,作者使用硝基还原酶/甲硝唑(NTR/MTZ)系统进行靶向细胞剔除。在MTZ处理后的转基因系Tg(-4kbcol12a1a:GAL4VP16;UAS:NTR:RFP)中,在7 d.p.i.时相较于对照,5 / 6的心脏显示心肌细胞增殖减少,col12aa表达细胞减少(图3g,h)。在30d.p.i.时,col12a1+细胞剔除显著损害心脏再生(图3i,j)。总之,作者确定了心脏再生过程中具有潜在再生作用的三种成纤维细胞状态:col11a1a、col12a1a和nppc成纤维细胞。基因细胞剔除数据强烈表明col12a1a表达细胞在再生生态位中发挥了作用。
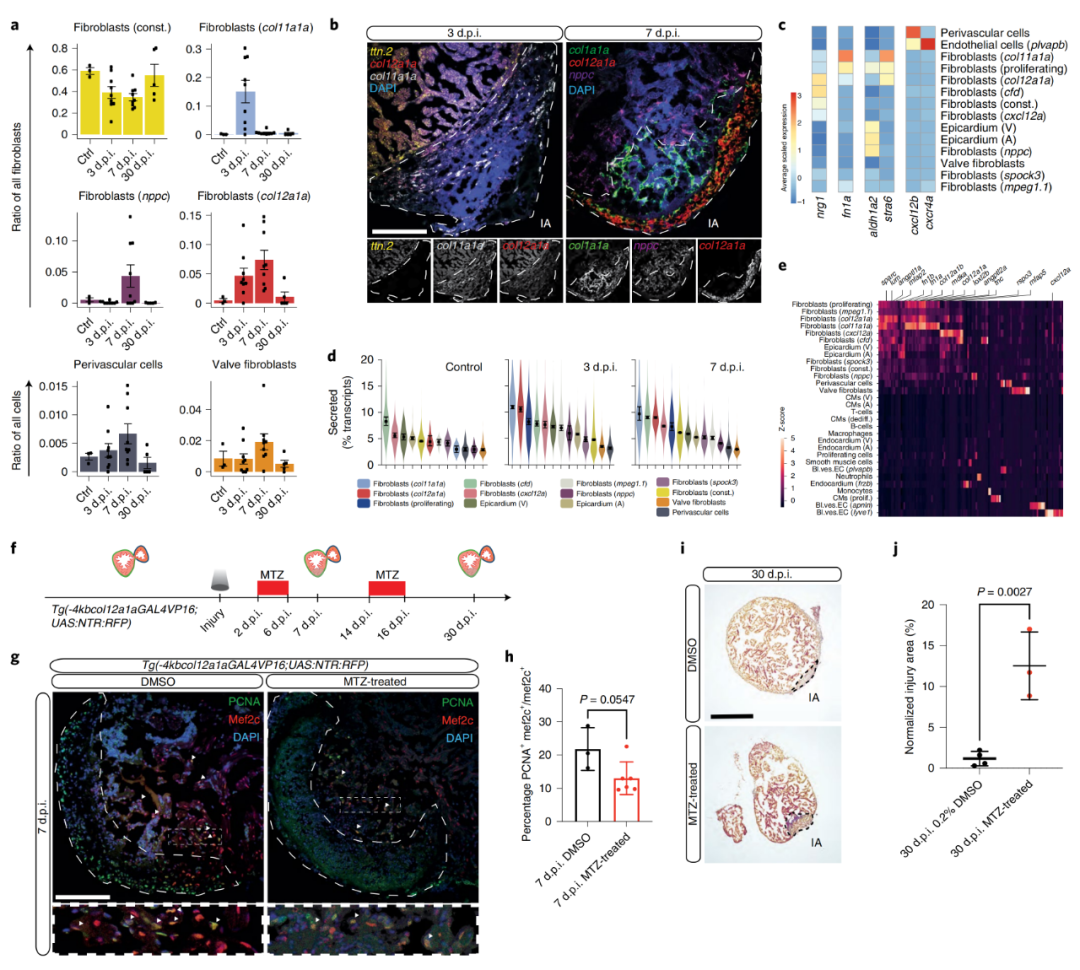
图3 心脏再生成纤维细胞的鉴定
4. 心外膜成纤维细胞的鉴定
接下来,作者想要阐明短暂成纤维细胞状态的起源,以便更好地理解它们的激活机制。于是作者使用了基于CRISPR-Cas9技术的大规模平行谱系追踪方法LINNAEUS。这种方法将细胞通过可遗传的DNA条形码(遗传疤痕)标记,它们由Cas9在早期发育过程中产生,其独特的序列能够识别疤痕产生时来自同一亲本的细胞。通过对同一个单细胞的遗传疤痕和转录组进行测序,作者便可以建立谱系树,揭示这些细胞类型的共同发育起源(图4a)。在谱系树中,一个节点中的所有细胞共享相同的发育祖先(比如图4a,B和C节点就共享相同发育祖先A),并且每个节点上不同瞬时细胞状态下的每个细胞均可在相同的上一节点中对应找到(比如在图4a的谱系图中节点C就包含了3种瞬时细胞状态,这三种状态下的所有细胞均可以在上一节点的对应细胞状态中找到)。作者还计算了不同树节点中细胞类型比率之间的相关性,以确定哪些细胞类型通过谱系相关联(图4b)。谱系相关性聚类热图显示,在3 d.p.i.时有4簇细胞类型,在7 d.p.i.时有7簇细胞类型。在这两个时间点,所有的免疫细胞共享一个相同的谱系。此外,几种成纤维细胞:col11a1a、col12a1a和构成型成纤维细胞,它们和心外膜细胞聚集在一起,这表明这些成纤维细胞与心外膜细胞具有共同的发育起源(图4c,d)。为了验证这一结论,作者又构建了转基因系TgBAC(tcf21:Cre-ERT2;ubi:Switch)。重组后,在7 d.p.i.表达的mCherry与内源性表达的col12a1a共定位(图4e),证实了瞬时col11a1a和col12a1a成纤维细胞为心外膜或心外膜衍生成纤维细胞的起源。为了进一步阐明短暂心外膜成纤维细胞状态的起源,作者应用了RNA速度分析方法,对心外膜谱系簇中所有心室细胞类型在3 d.p.i.和7 d.p.i.下的发育轨迹进行推断(图4f),得到了相同的结论。
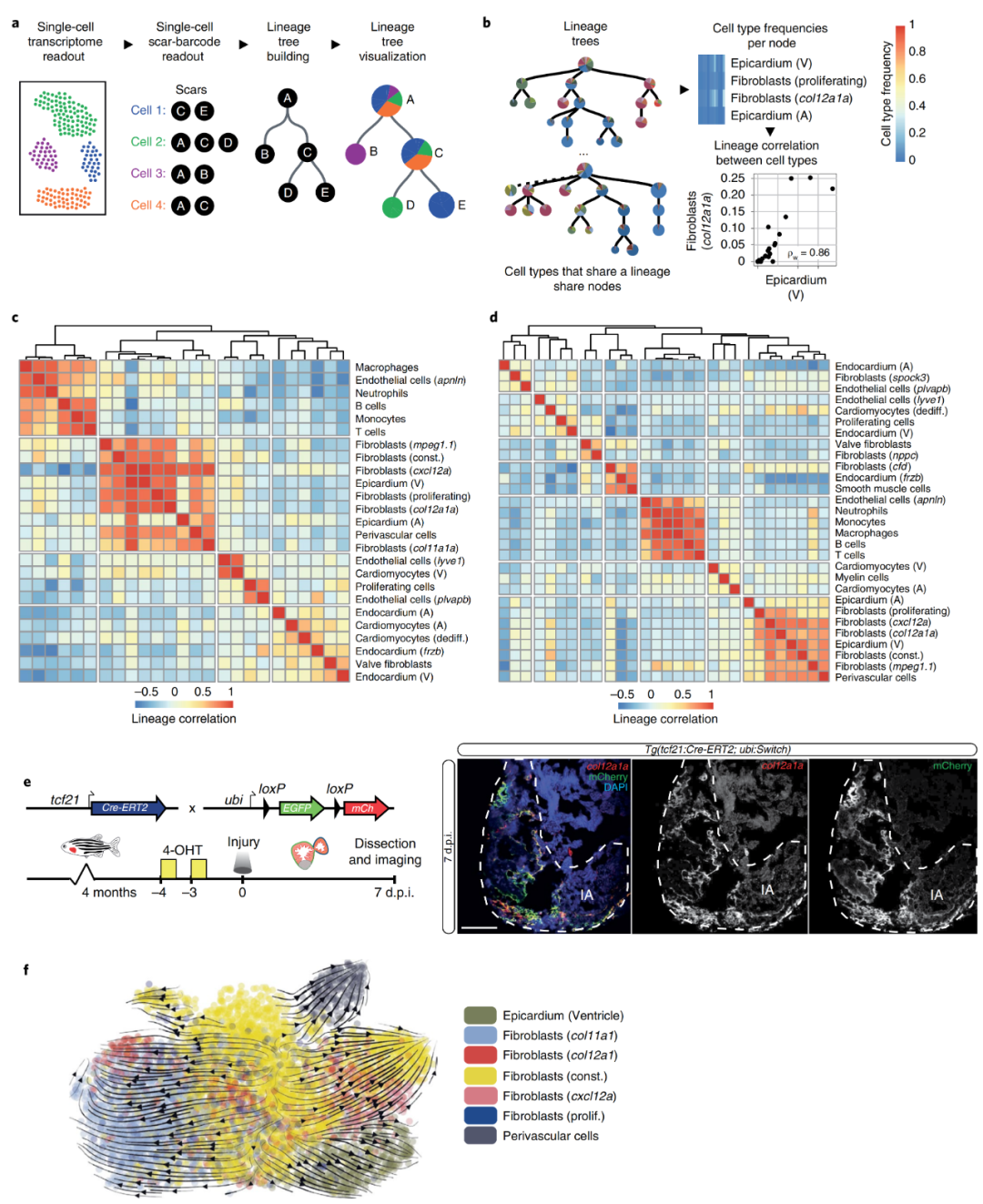
图4 心外膜成纤维细胞的鉴定
5. 心内膜成纤维细胞的鉴定
瞬时nppc成纤维细胞和其他几个成纤维细胞亚型(spock3、cfd和瓣膜成纤维细胞)在3 d.p.i.或7 d.p.i.时不属于心外膜谱系,但与心内膜以及彼此之间显示中度正相关。基于相关性的分析有一个潜在的假设,即所有克隆体都会表现出相似的转换率(图5a),但是这种假设并不适用于所有细胞类型,于是作者引入条件概率开发了第二种算法(图5b)。在3 d.p.i.时,不同成纤维细胞类型:col11a1a成纤维细胞、构成型成纤维细胞、心外膜(心室)转变为col12a1a成纤维细胞类型的条件概率均大于0.9(图5c)。在7 d.p.i. 时,不同的心内膜细胞类型:心内膜(心房)、心内膜(心室)和心内膜 ( frzb )转变为nppc成纤维细胞的条件概率均大于0.8,表明这种成纤维细胞类型与心内膜之间存在谱系关系。为了验证算法的真实性,作者构建了转基因系Tg(fli1:Cre-ERT2; hsp70l:Switch)。在7 d.p.i.表达的EGFP与内源性表达的nppc共定位(图5e),证实了瞬时nppc成纤维细胞的心内膜起源。RNA速度分析揭示了心室内膜和nppc成纤维细胞之间的转录相似性和潜在的过渡路径(图5f)。从单细胞转录组数据中观察到,与健康对照组心脏相比,心内膜在7 d.p.i.时发生了激活反应(图5g)。
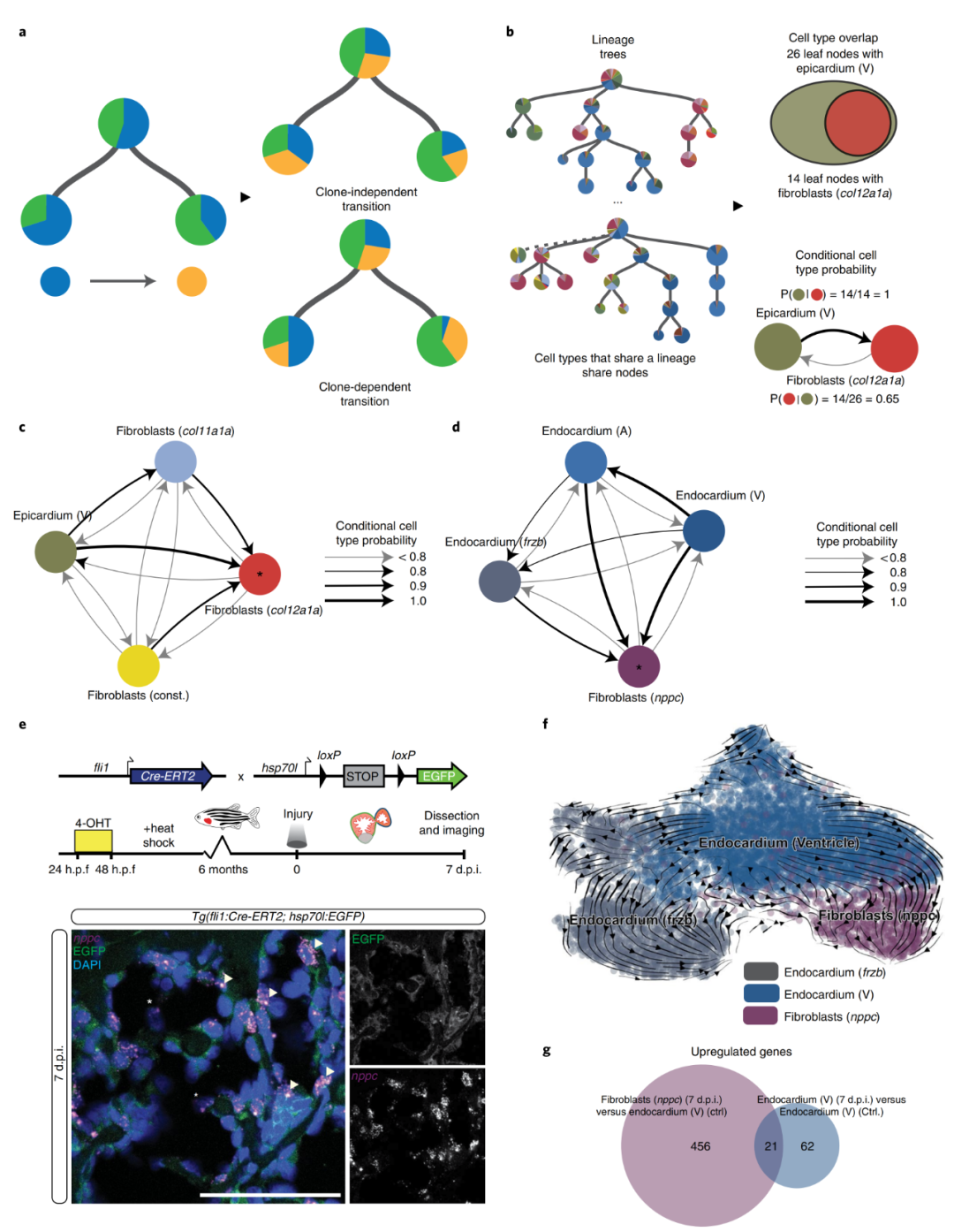
图5 心内膜成纤维细胞的鉴定
6. 典型Wnt信号通路作用的细胞解剖
作者发现成纤维细胞中表达了许多与Wnt信号有关的基因(配体、受体和调节剂)(图6a),于是这启发了他们去研究Wnt信号在斑马鱼心脏再生过程中的作用。一方面,Wnt通常被认为是一种促增殖因子,Wnt的激活已被证明对斑马鱼鳍和脊髓再生有益。另一方面,Wnt信号通路在心肌细胞去分化和增殖中的作用存在争议。于是,作者在斑马鱼心脏冷冻损伤后,使用特征良好的Wnt/β-catenin依赖的信号抑制剂IWR-1抑制典型的Wnt信号,并在3,7,15和30 d.p.i.观察其影响。结果发现,Wnt/β-catenin信号通路抑制导致心脏再生显著延迟,与对照组相比,心肌纤维化延长,损伤面积增大(图6b)。IWR-1处理后心脏的单细胞转录组数据显示心肌细胞去分化延迟,与对照组相比,去分化心肌细胞数量在3 d.p.i.时减少,而在7 d.p.i.时未定位于损伤区域(图6c)。Wnt抑制后,血管周细胞和所有心内膜成纤维细胞(nppc、spock3和瓣膜成纤维细胞)的水平显著降低,而其他短暂增加的成纤维细胞总体上保持在类似水平(图6d)。通过荧光原位杂交也证实了,Wnt信号对于心内膜成纤维细胞的激活是必需的,类似于所描述的Wnt在诱导小鼠内皮细胞向间充质细胞转化中的作用。
为了评估血管再生,作者对4d.p.i.下冠脉内皮细胞(cECs)的增殖以及7 d.p.i.损伤区冠状动脉的覆盖范围进行了定量分析。发现注射IWR-1后,cEC增殖在4 d.p.i.时有边缘但不显著的下降(图6f,g)。然而,在7d.p.i.时,损伤区冠状动脉覆盖明显减少(图6h,j)。这些结果表明,Wnt抑制后观察到的心脏再生减少至少部分是由血管再生缺陷介导的。这种缺陷似乎不是由cECs增殖减少引起的,而可能与血管再生的其他方面有关。
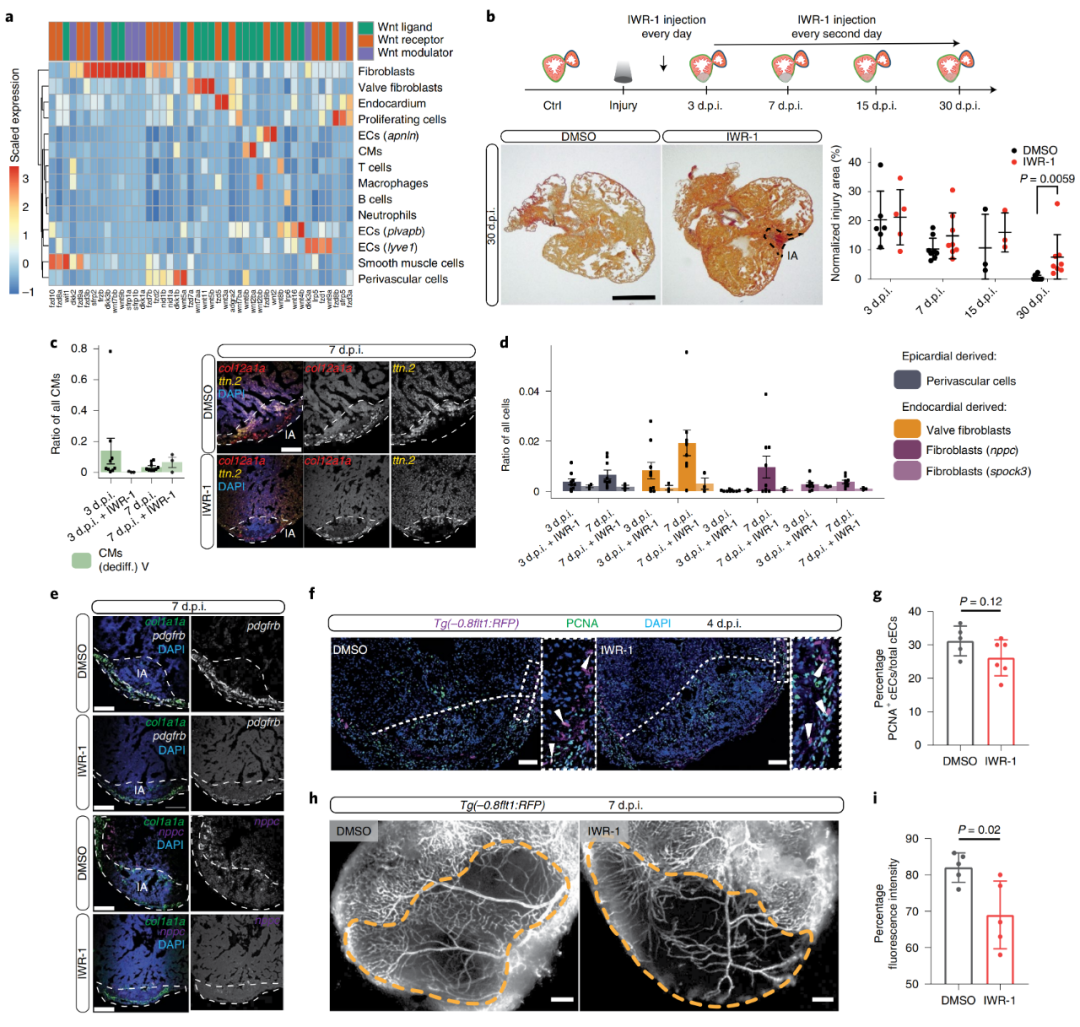
图6 对典型Wnt信号作用的细胞剖析
总 结
成年斑马鱼心脏损伤后具有很高的再生能力。然而,再生生态位的组成在很大程度上仍然难以捉摸。这篇文章基于单细胞转录组学和时空分析,解剖了再生斑马鱼心脏中激活细胞状态的多样性。观察到损伤后出现的几种具有成纤维细胞特征的瞬时细胞状态,并概述了表达胶原-12的成纤维细胞的促再生功能。为了了解导致心脏再生的级联事件,作者通过高通量谱系追踪确定了这些细胞状态的起源。最终发现激活的成纤维细胞有两个不同的来源:心外膜和心内膜。在机制上,确定Wnt信号作为心内膜成纤维细胞反应的调节器。总之,本文确定了促进心脏再生的特殊活化成纤维细胞状态,从而为调节脊椎动物心脏再生能力开辟了可能的途径。
如果您对我们提供的服务感兴趣,欢迎联系我们,我们将免费为您设计文章思路。









 京公网安备 11011302003368号
京公网安备 11011302003368号