少量样本,实验只做qPCR验证,如何发表8+文章?
今天跟大家分享一篇少量样本结合多组学数据联合分析的研究报道,“弥漫性甲状腺肿和桥本甲状腺炎微环境中免疫细胞基因表达失调和代谢信号异常的全局调控网络”,该文是百迈客合作客户青岛大学医学院附属烟台毓璜顶医院宋西成教授团队发表在Frontiers in Immunology(IF=8.786)的研究成果,发表时间为2022年5月。百迈客为该研究提供了单细胞转录组、全转录组、全长转录组和代谢组的建库测序服务。

研究背景
人类自身免疫性甲状腺疾病 (AITD) 是最常见的器官特异性自身免疫性疾病,也是甲状腺功能障碍和非地方性甲状腺肿的最常见原因,主要表现为弥漫性甲状腺肿(Graves’disease,GD)和桥本甲状腺炎(Hashimoto’s thyroiditis,HT);HT和GD具有不同的临床特征,但它们在组织损伤方面是相似的,包括体内淋巴细胞浸润。研究表明,T淋巴细胞及其特异性细胞因子作为免疫不可或缺的组成部分,在AITD的发生中起关键作用,例如调节性T细胞(Tregs)和辅助T细胞17 (Th17)的失调、Th1/Th2失衡在AITD的发病机制中起着关键作用,但这些细胞亚群免疫功能障碍引起的致病分子机制在很大程度上仍未得到解释。
本研究基于HT患者、GD患者和健康对照甲状腺组织的单细胞RNA测序、全转录组测序、ONT全长转录组测序和代谢组测序数据,探讨了HT和GD疾病微环境中基因表达失调和代谢信号异常的免疫细胞,构建了免疫细胞的全局调节网络,为进一步了解HT和GD免疫紊乱和代谢异常介导的疾病机制、更好地干预和治疗疾病提供了科学的理论指导和研究基础。
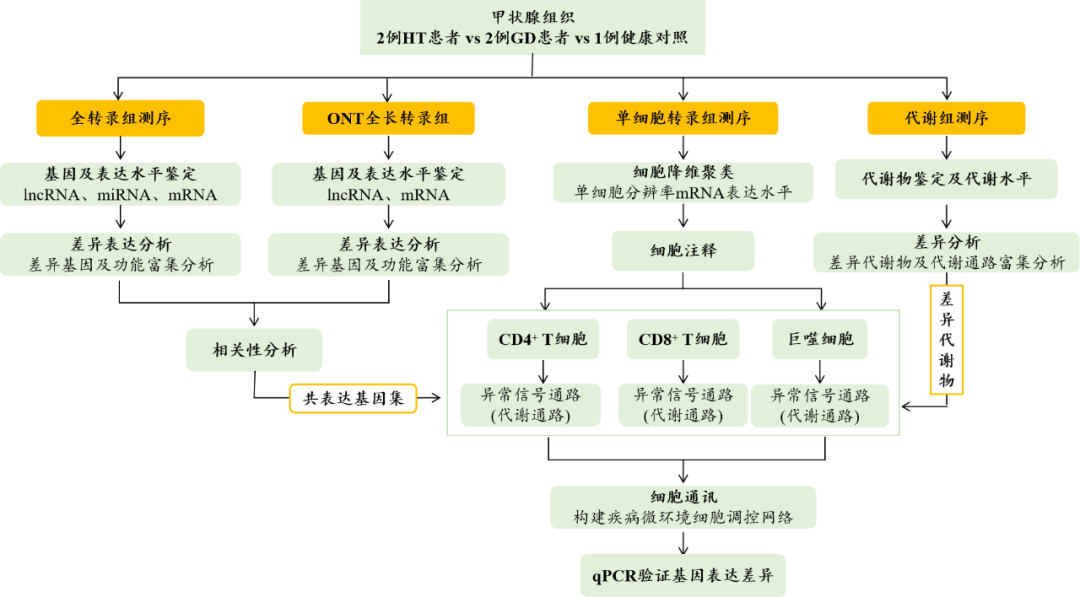
研究思路
主要内容
1、全转录组测序分析HT和GD的异常表达基因
为了鉴定HT组和GD组中异常表达的lncRNA和miRNA,分别进行了ONT全长转录组测序和全转录组测序数据。差异表达分析结果显示,共检测到6,153 个 lncRNA s和 741 个 miRNAs 在 HT 患者中存在差异表达(图 1A);GD患者中检测到5,492个lncRNAs 和 165 个 miRNAs 存在差异表达(图 1B);相关性分析结果验证了本研究中两种测序方法的检测稳定性(图 1C, D)。
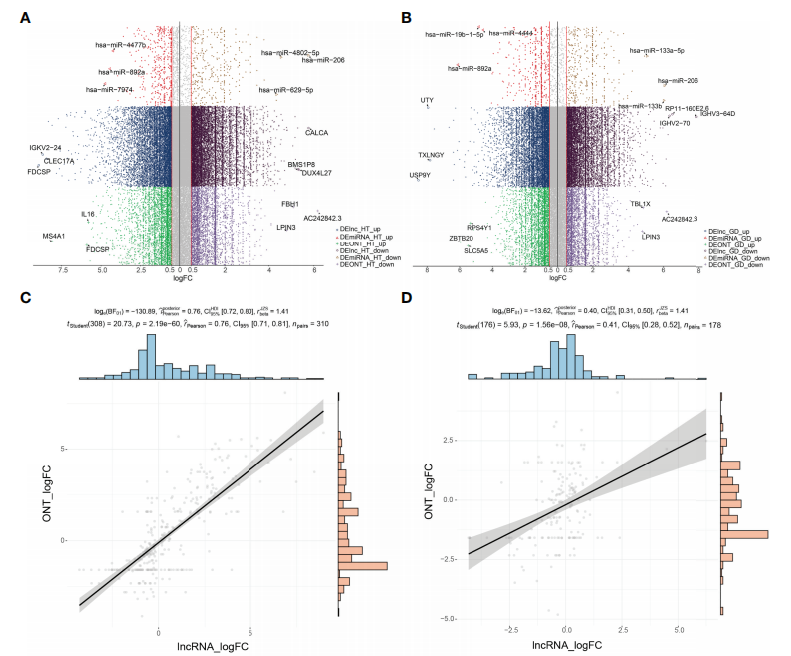
图1 HT和GD基因表达差异分析
2、HT和GD基因表达差异与异常免疫级联和代谢信号传导有关
对HT组和GD组显著差异基因进行功能富集分析,结果显示,HT组中显著富集的通路为白细胞-细胞粘附、T 细胞活化和分化、细胞因子代谢过程和免疫反应激活的信号转导(图 2A),而GD组中,则显著富集的信号通路为白细胞-细胞粘附、激素代谢过程和的细胞趋化性(图 2B);此外,HT(图 2C)和GD(图 2D)均富含与甲状腺疾病相关的信号通路,包括甲状旁腺激素合成、甲状腺激素分泌、甲状腺激素信号通路作用和自身免疫性甲状腺疾病;同时,HT和GD还富集了其他几种免疫炎症和代谢信号相关通路,包括细胞因子-细胞因子受体相互作用、趋化因子信号通路、Th1和Th2细胞分化、NF-kappa B信号通路、苯丙氨酸代谢、色氨酸代谢和酪氨酸代谢。
为了进一步确定代谢物在HT和GD中的作用,对HT组、GD组及对照组的代谢组数据进行差异代谢物分析及代谢通路富集分析(图 2E, F)。结果显示,相较于对照组,苯丙氨酸、酪氨酸和色氨酸生物合成、苯丙氨酸代谢和类固醇生物合成的代谢通路在HT组中显著激活(图 2G(a)),而亚油酸代谢和类固醇激素生物合成代谢通路受到抑制(图 2G(b));此外,类固醇激素生物合成、咖啡因代谢和花生四烯酸代谢通路在GD组中被激活(图 2G(c)),而苯丙氨酸、酪氨酸和色氨酸生物合成以及亚油酸代谢通路受到抑制(图 2G(d))。
鉴于免疫反应在HT和GD中的重要作用,利用GSEA方法进行免疫浸润分析,进一步评估了样本中免疫细胞的丰度,发现CD4 +T细胞、CD8 + T细胞、巨噬细胞、Th1和Th2细胞均有不同程度的浸润(图 2H)。
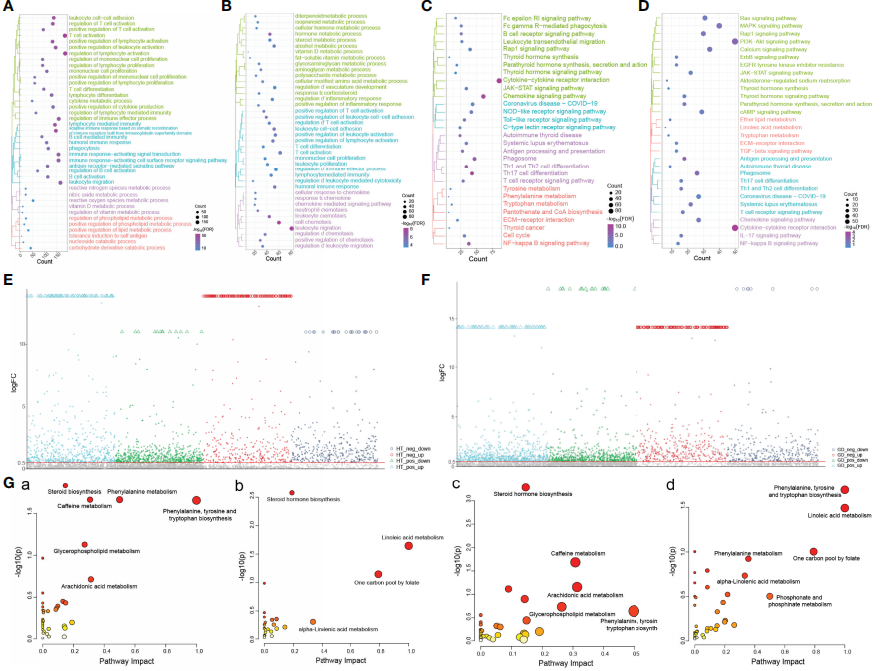
图2 HT和GD中失调的基因表达与异常的免疫级联和代谢信号传导有关
3、HT和GD中疾病微环境中CD4+ T细胞中基因表达失调和代谢信号异常
对单细胞转录组数据中的CD4+ T细胞亚群进行进一步分析,发现在HT、GD和对照组中细胞丰度存在明显差异(图 3A)。将bulk RNA-seq数据中显著差异表达的基因,与CD4+ T细胞的单细胞RNA-seq数据中的基因取交集,并对这些共表达的基因集进行功能富集分析;分析结果显示,HT组中显著差异富集的通路有甲状腺激素信号通路、T 细胞受体信号通路、Th1和Th2细胞分化、Th17细胞分化、细胞因子-细胞因子受体相互作用和NF-kappa B信号通路(图 3B);而在GD组中,甲状旁腺激素合成,分泌和作用、ECM-受体相互作用、嘌呤代谢、cAMP 信号通路、NF-kappa B 信号通路、细胞因子-细胞因子受体相互作用和T细胞受体信号通路显著富集(图 3C )。GSEA富集分析结果显示,HT组中细胞因子-细胞因子受体相互作用和T细胞受体信号通路显著富集(图 3D),但GD组中未观察到显著富集的通路。此外,氨基酸生物合成和嘌呤代谢相关的代谢通路在HT和GD组中均显著富集。
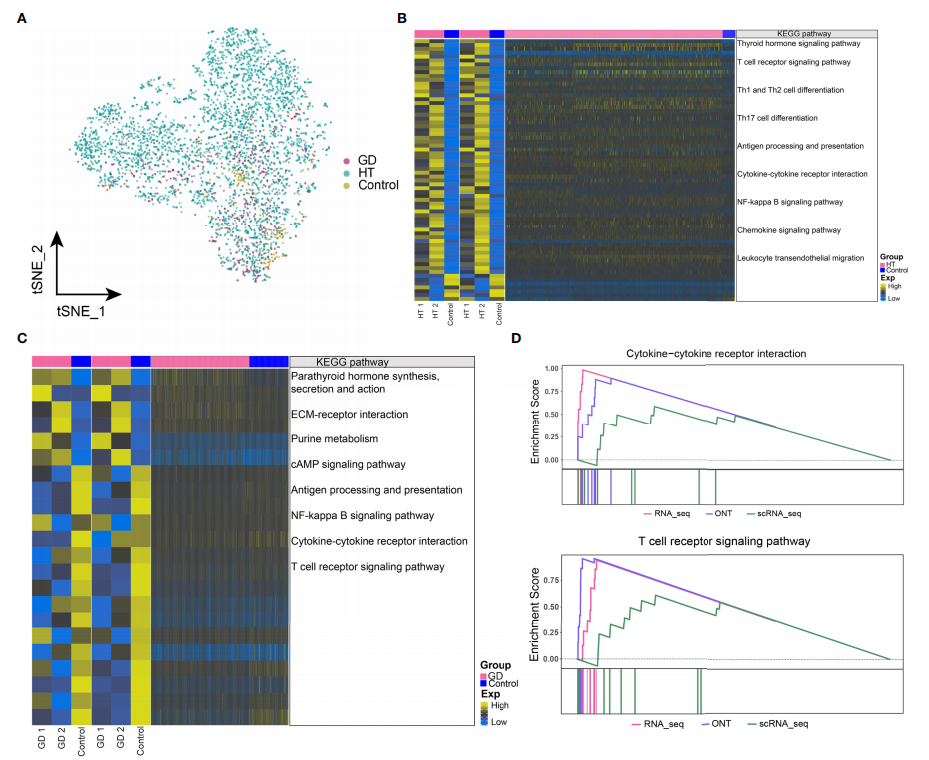
图3 HT和GD微环境CD4+ T细胞中基因表达失调和代谢信号异常
4、HT和GD疾病微环境中CD8+ T细胞中基因表达失调和代谢信号异常
对单细胞转录组数据中的CD8+ T细胞亚群进行进一步分析,发现在HT、GD和对照组中细胞丰度存在明显差异(图 4A);与CD8+ T细胞亚群类似,将与bulk数据中共表达的基因集进行功能富集分析。结果显示,在HT(图 4B)和GD(图 4C)中,显著富集的通路有抗原加工和呈递、Th1和Th2细胞分化、Th17细胞分化、细胞因子-细胞因子受体相互作用和 NF-kappa B 信号通路;甲状旁腺激素的合成、分泌和作用及白细胞跨内的迁移途径在HT组显著富集;而GD组中,嘌呤代谢和cAMP信号通路显著富集。GSEA分析结果显示,HT组中细胞因子-细胞因子受体相互作用和 NF-kappa B 信号通路显著富集(图 4D),而在GD组中未发现显著富集的通路;嘌呤代谢信号通路在HT组和GD组中均富集。
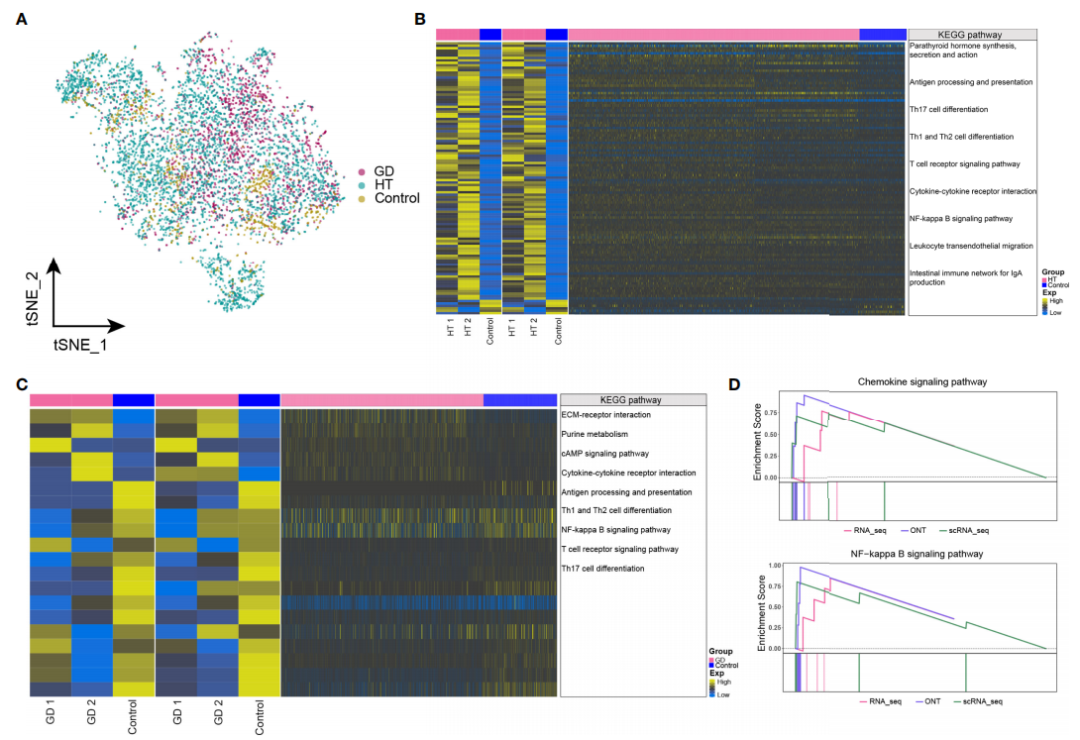
图4 HT和GD微环境CD8+ T细胞中基因表达失调和代谢信号异常
5、HT和GD微环境巨噬细胞中基因表达失调和代谢信号异常
对单细胞转录组数据中的CD8+ T细胞亚群进行进一步分析,发现 HT、GD 和对照组中巨噬细胞丰度存在明显差异(图 5A)。同样地,将与bulk数据共表达的基因集进行功能富集分析;分析结果显示,HT组(图 5B)和GD组(图 5C)显著富集的信号通路有甲状旁腺激素的合成,分泌和作用、抗原加工和呈递、Th1和Th2细胞分化、Th17细胞分化、NOD样受体信号通路、NF-kappa B信号通路和细胞因子-细胞因子受体相互作用;T组中,甲状腺激素信号通路和Toll样受体信号通路显著富集;GD组中,吞噬体、苯丙氨酸、酪氨酸和色氨酸生物合成途径显著富集。GSEA富集分析结果显示,HT组中细胞因子-细胞因子受体相互作用、NF-kappa B信号通路、Th1和Th2细胞分化以及Th17细胞分化通路显著富集(图 5D),而GD组中没有发现类似的富集通路;嘌呤和苯丙氨酸代谢信号通路分别在HT组和GD组中显著富集。
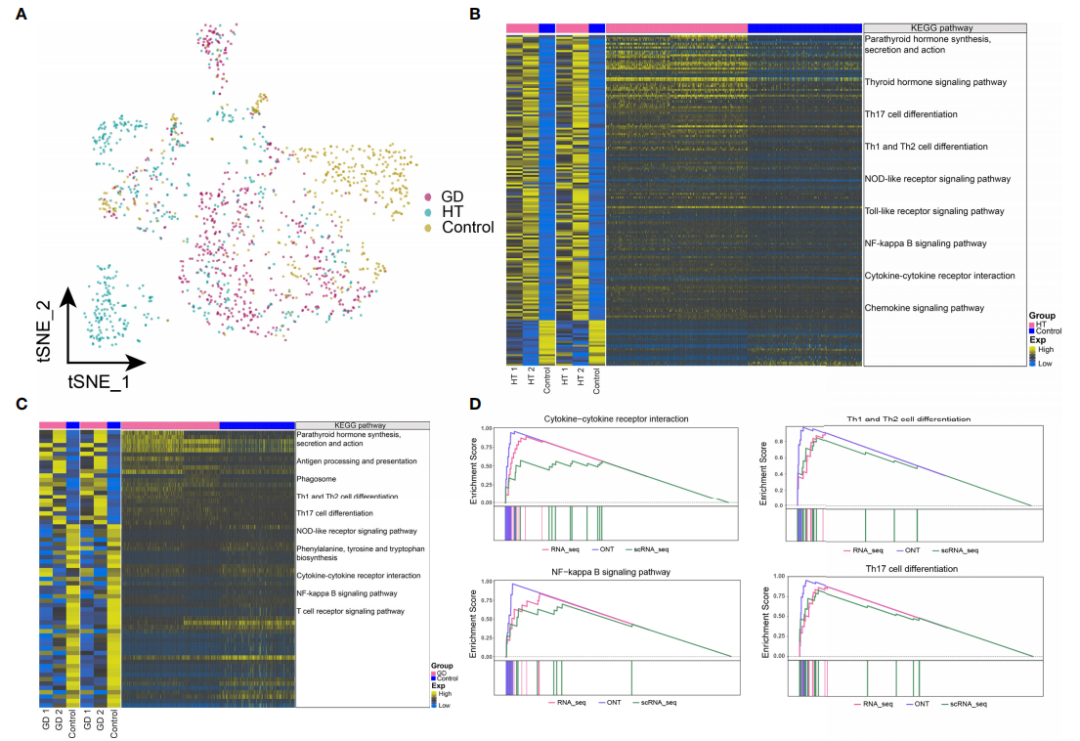
图5 HT和GD微环境巨噬细胞中基因表达失调和代谢信号异常
6、HT和GD微环境中T细胞和巨噬细胞的调控网络分析
为了确定HT和GD疾病微环境的细胞间调节机制,对CD4+ T细胞、CD8+ T细胞和巨噬细胞进行iTALK细胞通讯分析。分析结果显示,HT(图 6A)和GD(图 6B)中配体-受体对的丰度存在显著差异;HT组中,微环境中的T细胞主要通过IL16-CCR5、FGF10-FGFR1、CXCL13-CXCR3和CD70-CD27受体配体对靶向巨噬细胞,激活细胞因子-细胞因子受体相互作用和T细胞受体信号通路(图 6C);GD组中,微环境T细胞主要通过CXCR3-CXCL10、PKM-CD44和 CCL21-CCR7受体配体对靶向巨噬细胞,激活EMC受体相互作用和NF-kappa B信号通路(图 6D);相较于对照相,调控网络中的关键基因(CCL21、CCR7、CD4、CD27、CD70、CXCL13、ICOS、IL-16、LAT、TNF及IL16),经qPCR实验验证,在HT组 (图 6E ) 和GD (图 6F )均显示存在显著差异表达。
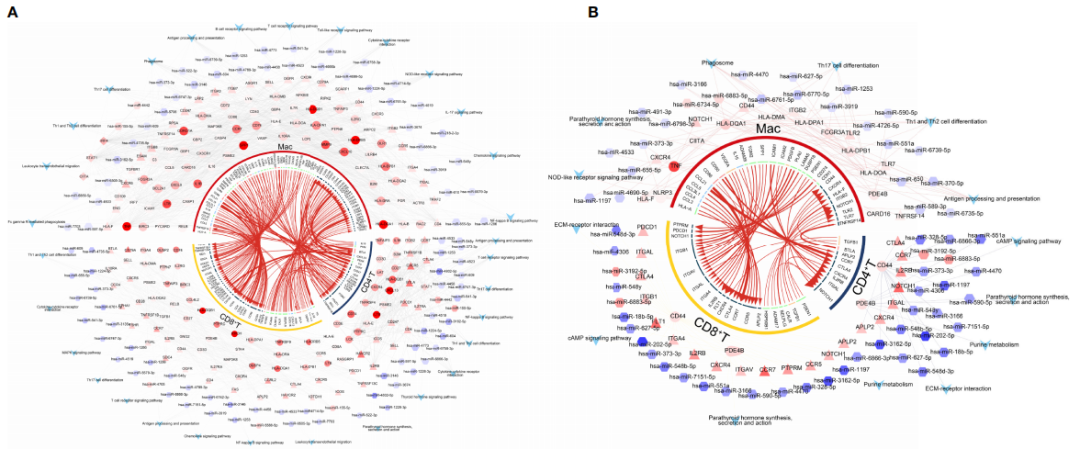
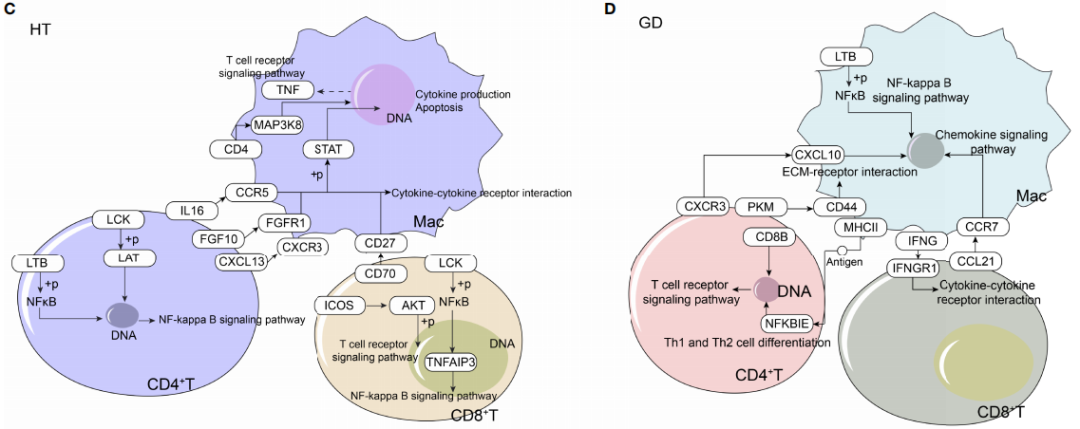
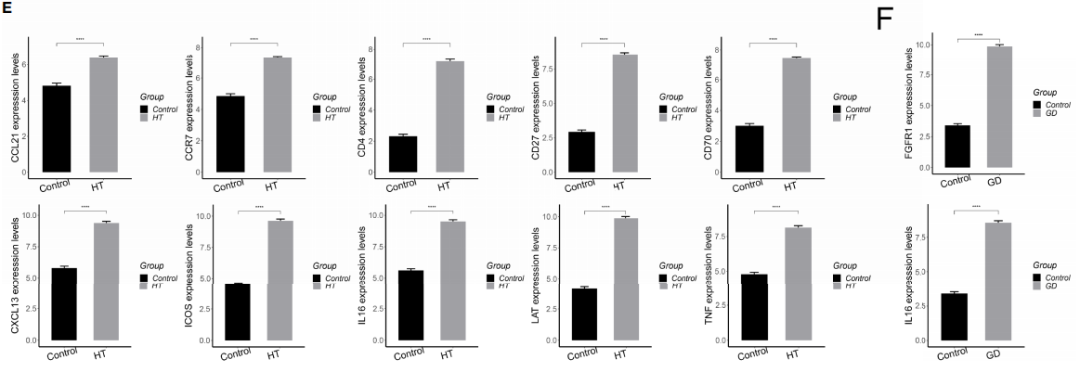
图6 HT和GD疾病微环境T细胞和巨噬细胞的全局调控网络
研究小结
本研究利用转录水平和代谢水平的测序数据联合,在单细胞水平上鉴定了HT和GD疾病微环境中基因表达失调和代谢信号异常的免疫细胞;同时,构建了免疫细胞的全局调控网络,为HT和GD疾病机制介导的免疫失调和代谢异常提供了新的视角。
参考文献
Zheng, Haitao et al. “A Global Regulatory Network for Dysregulated Gene Expression and Abnormal Metabolic Signaling in Immune Cells in the Microenvironment of Graves’ Disease and Hashimoto’s Thyroiditis.” Frontiers in immunology vol. 13 879824. 26 May. 2022, doi:10.3389/fimmu.2022.879824







 京公网安备 11011302003368号
京公网安备 11011302003368号