近年来,单细胞组学领域发展非常迅速,广泛应用于人类和动物的研究中,为人们研究细胞异质性以及微生物群落的生态多样性提供了新的视角。在植物中,由于细胞壁的存在,大大阻碍了单细胞RNA测序(scRNA-seq)的应用,虽然原生质体已用于scRNA-seq分析,但仅仅限于适合消化细胞壁的组织。许多细胞类型在原生质体制备过程中可能出现基因异位表达或细胞类型偏好等问题。随着scRNA-seq技术的发展,单细胞核RNA测序(snRNA-seq)让植物单细胞测序不再受制于制备原生质体,能够更好的解决传统研究中存在的细胞异质性的问题,为研究者们提供更多选择。
本文介绍的是利用snRNA-seq技术,解密番茄茎尖的发育轨迹,在这里,本文展示了一种用于高通量单核RNA测序(snRNA-Seq)的方法,该方法可用于分析番茄茎尖细胞。
获得的高分辨率表达图鉴定了主要的茎尖组织和发育阶段的不同细胞类型,描绘了叶肉细胞,脉管系统细胞,表皮细胞和毛状体细胞的发育轨迹。这项研究证明了snRNA-seq在植物研究中的作用,并为异质茎尖细胞提供了时空基因表达图谱。该文章已发表在预印本杂志BioRxiov上。
文章题目:Single-nucleus RNA-seq resolves spatiotemporal developmental trajectories in the tomato shoot apex
细胞核提取方法
材料预处理:在解剖显微镜下对番茄茎尖进行解剖,保留了2周龄植株的茎尖分生组织区和早期叶原基,叶原基到P3(第三片叶的叶原基)。
细胞核提取方法:将冷冻番茄茎尖分生组织重悬于10ml含0.1%蛋白酶抑制剂的核分离液(NIB:10 mM MES-KOH(pH = 5.4),10 mM NaCl,10 mM KCl,2.5 mM EDTA,250 mM蔗糖,0.1 mM精胺,0.5 mM亚精胺,1 mM DTT)中,在冰上使用匀浆器低速匀浆,冰上裂解30分钟后,将匀浆物在三层尼龙网中过滤两次。同时为了消除叶绿体,将10%Triton X-100滴加到溶液中,使其最终浓度为0.1%(v / v),直到大多数叶绿体降解为止。然后将核悬浮液以1000 g离心5分钟。将沉淀的核洗涤两次,然后将其悬浮在NIB中。通过台盼蓝染色确定细胞核的质量和浓度,并在显微镜下计数。
结果
1.原生质体引起异位基因表达
茎尖分生组织和早期叶片原基具有复杂的细胞结构,该结构由嵌入不同组成的细胞壁中的异质细胞组成。制备原生质体,需要长时间的酶消化。异位激活和随机基因的表达与原生质体形成相关。为了评估原生质体对基因表达的影响,本文检测拟南芥叶片和叶肉原生质体中的基因表达,并观察到频繁的异位激活。例如,WOX2未在叶子中表达(图1a)。追踪了10,000多个原生质体,观察到超过21%的原生质体表达了WOX2(图1b)。该观察结果强烈暗示通过原生质体化存在基因表达的异位随机激活。
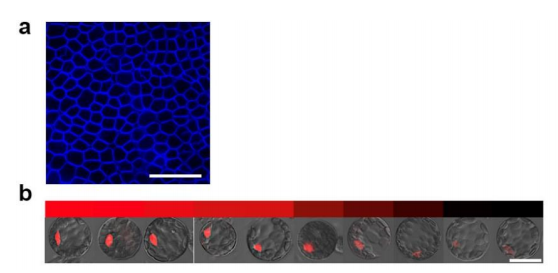
图1叶片和原生质体中WOX2的表达模式
2.snRNA-seq鉴定了番茄茎尖的主要细胞类型
根据本文细胞核提取的方法,得到正常形态的番茄茎尖分生组织的细胞核,进行snRNA-seq。(图2a)。经过质量控制和过滤,获得了13377个核,检测到基因数为21402。为了评估snRNA-seq数据的可重复性和敏感性,本文用番茄茎尖进行Bulk RNA-seq。snRNA-seq检测到的基因,有92.3%可以通过Bulk RNA-seq检测到(FPKM > 1),表明snRNA-seq具有较高的敏感性,snRNA-seq和Bulk RNA-seq的相关性达到0.9(图2b),表明具有很高的重现性。
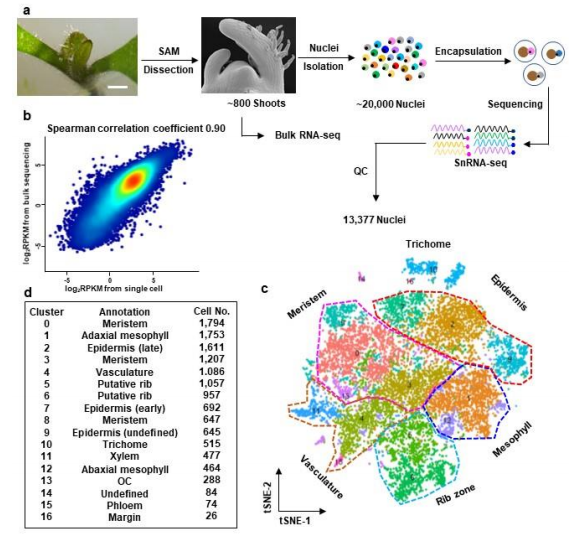
图2 snRNA-seq绘制番茄茎尖细胞图谱
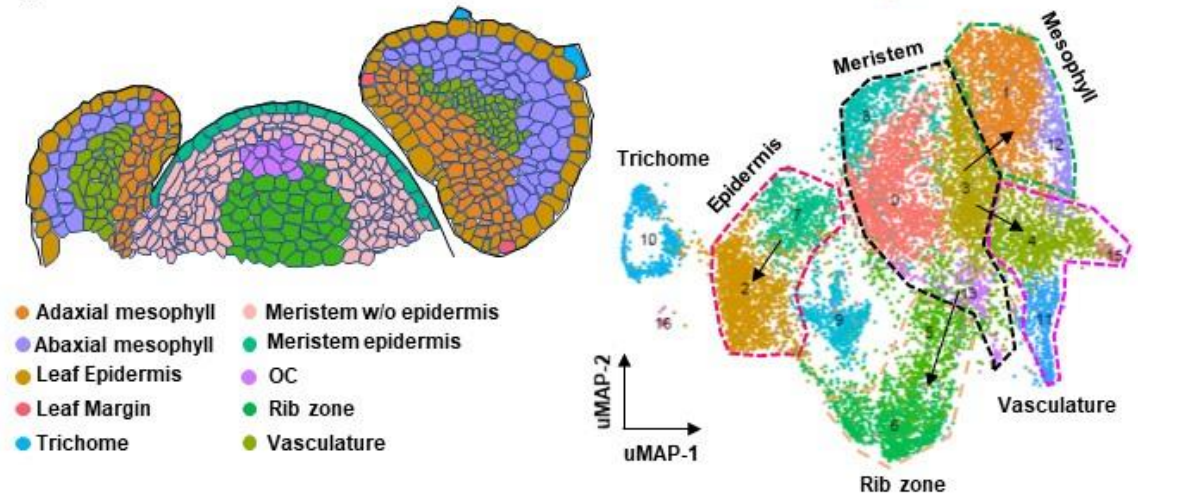
为了鉴定不同的细胞类型,本文采用无监督聚类分析。采用t-SNE算法,将细胞核分组为16个clusters(图2c)。每个cluster具有显著差异的基因表达模式。鉴定了每个cluster的一系列特异性标记基因(图3a)。为了注释这些clusters,本文将cluster的marker基因与已知的marker基因进行了关联。此外,本文还与拟南芥富集于相应细胞结构域的同源基因相关联。本文发现在几个clusters中,显著富集到拟南芥细胞域特异性的同源基因,这些结构域包括表皮,叶肉和脉管系统域(图4)。此外,在拟南芥分生组织中广泛表达的marker基因SlSTM和SlBP在clusters 0、3、4、5、6、7中特异性表达,由此得出,本文的样本中有相当一部分与茎尖分生组织相对应。基于以上信息,将clusters分为4个cluster clouds,分别对应于番茄的表皮和毛状体(clusters 2、7、9、10和16),叶肉(clusters 1、12和14),脉管系统(clusters 4、11和15)和分生组织细胞(clusters 0、3、5、6、8和13)(图2c,d)。
总之,本文鉴定了茎尖的主要的细胞类型,提供了茎尖细胞空间分布的基因表达信息(图3b,d).
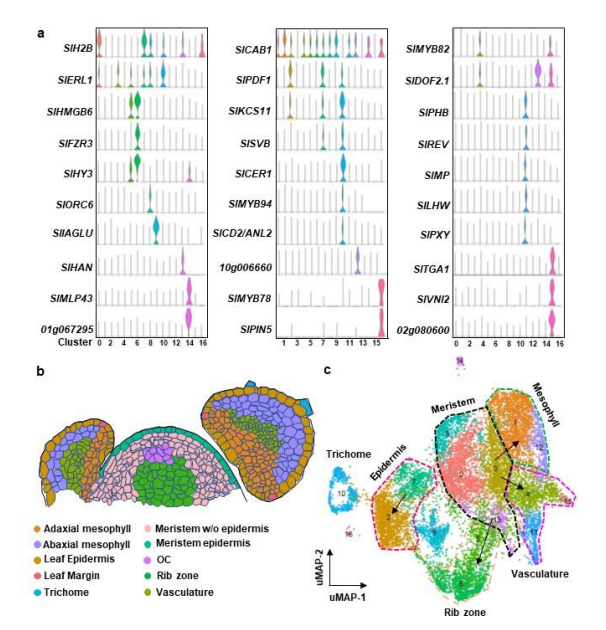
图3 marker 基因的表达模式和细胞空间分布
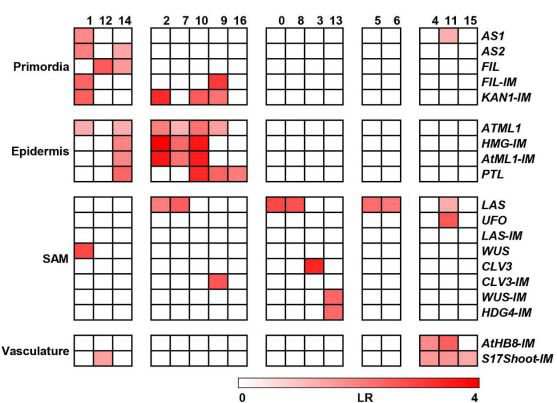
图4 细胞类型特异性基因的富集分析
3.番茄茎尖细胞轨迹分析
单细胞转录组学可以捕获具有过渡状态的细胞,从而使本文能够追踪特定细胞类型的发育轨迹。为了获得茎尖细胞发育轨迹图,本文用uMAP算法分析clusters聚类和等级结构(图3c),鉴定出相似的clusters,对应分生组织细胞的clusters位于中心。起源于分生组织细胞的茎尖细胞连续分化形成表皮细胞,毛状体细胞,叶肉细胞和脉管系统细胞。
根据细胞轨迹分析,在茎尖分生组织的外围区域处叶片开始萌发,叶肉细胞分化,伴有脉管系统的形成。细胞发育轨迹起始于分生组织细胞(cluster 3),叶肉细胞(clusters 1和12)与脉管系统细胞(clusters 4,11和15)明显分离,随后,脉管系统细胞分离为木质部细胞和韧皮部细胞(图5a,b)
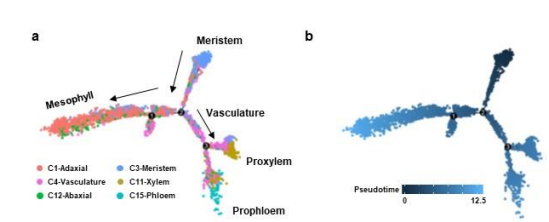
图5 叶肉细胞和脉管系统的发育轨迹
结论
细胞壁的存在极大阻碍了单细胞转录组学在植物研究中的应用。在这项研究中,本文开发了一种处理组织的方法,可对几乎任何植物细胞类型进行snRNA-seq分析。此外,snRNA-seq有望减轻与原生质体形成相关的异位基因表达变化。本文用snRNA-seq已获得番茄茎的高分辨率细胞表达图谱,可识别大多数已知的细胞类型,并在细胞和分子水平上表现出显著的异质性。综上所述,本文提供了一个强大的单核转录组分析流程,可以广泛应用于其他物种和组织,并为研究干细胞稳态和早期器官发生提供了宝贵的资源。






 京公网安备 11011302003368号
京公网安备 11011302003368号