
合作单位:丹麦奥胡斯大学
文章标题:Metabolic Communication by SGLT2 Inhibition
期刊名称:Circulation
影响因子:37.8
研究对象:小鼠、临床队列
测序技术:宏基因组测序、代谢组检测。
百迈客生物为该研究提供了宏基因组测序服务。
研究背景
钠-葡萄糖协同转运蛋白2(SGLT2)主要在肾脏近曲小管S1段表达,负责对葡萄糖进行定量重吸收。SGLT2 抑制剂(SGLT2i)是治疗高血糖的有效疗法,在2型糖尿病患者中,还可以保护心脏和肾脏免于衰竭。SGLT2i被认为具有许多作用和多效机制,涵盖增强生酮和类禁食代谢反应、肾脏和全身血流动力学效应。然而,目前还未有研究阐明SGLT2i保护心血管和肾脏的关键机制,该机制对于心血管和肾脏保护至关重要。
丹麦奥胡斯大学学者在Circulation杂志上发表题为“Metabolic Communication by SGLT2 Inhibition“研究论文,研究团队使用Akita小鼠模型和临床队列样品,通过整合宏基因组、代谢组、蛋白组等多组学数据,确定了SGLT2i对肾脏、心脏、血管和其他器官的几种SGLT2依赖性效应和脱靶效应,通过重构肾脏代谢物转运和全身代谢通讯,发挥心肾保护作用。提供了关于SGLT2相互作用因子和SGLT2i依赖性蛋白质组、代谢组、磷酸化蛋白质组和宏蛋白质组的新见解,从而为SGLT2i新型和早期机制靶标提供了潜在的路线,促进代谢药物的开发。
材料方法
小鼠SGLT2i处理
19 只 8 周龄 C57BL/6J 雄性小鼠和 16 只糖尿病 C56BL/6-Ins2Akita/J 雄性小鼠,然后给予WD4周,WD后1周添加达格列净或驱避WD饮食(vehicle;WT,n=9;Akita,n=8)。
组学技术
盲肠粪便宏基因组学和宏蛋白质组学
肾组织、尿液、血浆非靶向代谢组
肾脏、肝脏、心脏、肌肉和白色脂肪组织蛋白质组
研究结果
1、综合组学方法发现和翻译策略概述
该研究旨在阐明SGLT2i的生理机制。作者假设大量的代谢器官通讯是对SGLT2i的反应而发生的,因此选择了综合组学方法。对非糖尿病小鼠的所有主要代谢器官、生物体液和肠道微生物群以及Akita小鼠单纯性高血糖的早期阶段进行了综合代谢组学和蛋白质组学分析,Akita鼠是1型糖尿病的遗传小鼠模型,长期SGLT2i处理对其有改善作用(图1A 和1B)。研究短期暴露于SGLT2i 1周,目的是确定主要代谢效应和可能建立保护作用的代谢通讯,而不是研究长期治疗后器官功能改善的后果。选择高脂肪西方饮食(WD)是为了模仿西方生活方式的代谢环境。选择达格列净是因为其对患有和不患有糖尿病的患者具有心脏保护和肾脏保护特性。作者通过研究分析发现了一些意想不到的代谢信号(图1C)。在后续研究中,将人肠道微生物培养物暴露于SGLT2i,使用SGLT2敲除 (KO) 小鼠来探测SGLT2i的脱靶效应,并在人肾、患者血浆和人诱导多能干细胞 (hiPSC) 中进行翻译验证。同时在人肾、患者血浆和人诱导多能干细胞 (hiPSC)中进行验证(图1D)。所得数据提供了关于SGLT2相互作用因子和SGLT2i依赖性蛋白质组、代谢组、磷酸化蛋白质组和元蛋白质组的新见解,从而揭示了SGLT2i的下游通路,这也为代谢性疾病药物的开发提供了新思路。
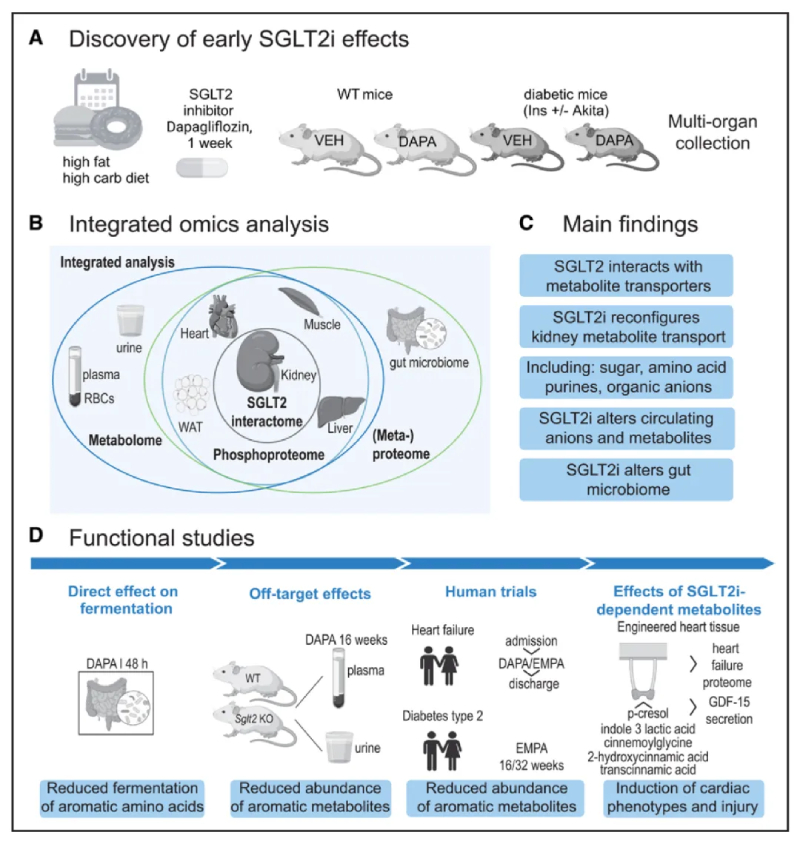
图1-研究设计和表型概述
2、匹配综合有机组学发现和翻译策略概述
使用达格列净或溶剂对照一周后,对同一动物的主要代谢器官的蛋白质组学、磷酸化蛋白质组学、代谢组学和宏蛋白质组学方法进行了深度多组学分析(图1A和1B)。结果表明,达格列净可降低Akita小鼠的血浆葡萄糖水平,但不会降低非糖尿病WT小鼠的血浆葡萄糖水平。达格列净在WT小鼠中诱导糖尿,但在Akita小鼠中没有观察到明显的进一步增加(图S1A)。通过蛋白质组学检测,在肾脏、肝脏、心脏、肌肉和白色脂肪组织中总共鉴定到9501个蛋白质(8421个基因)和10744个磷酸化位点。其中,大多数SGLT2i引起的显着变化是在肾脏中观察到的。
3、SGLT2抑制对肾脏蛋白质组的重新配置
定量了肾皮质中的6676种蛋白质,其中在WT组鉴定到6107种蛋白质,Akita小鼠鉴定到6207种蛋白质。分析表明,SGLT2i对肾脏蛋白质组的影响比糖尿病小鼠更强:在WT小鼠中,SGLT2i增加了455种蛋白质,减少了485种蛋白质(图2A)。SGLT2i治疗糖尿病小鼠的蛋白质变化较少(29个增加,53个减少)。两组小鼠肾脏线粒体蛋白丰度均有显著变化,但只有WT组小鼠体内线粒体膜蛋白显著上调(图S2A)。此外,只有WT小鼠对SGLT2i有反应,肾脏顶端或基侧膜上的蛋白质(图2B)或参与mRNA剪接的蛋白质下调。在WT小鼠中观察到的更强烈的变化之后,GO富集分析表明,跨各种功能相互连接的蛋白质的跨膜转运发生了一致的变化,大多数转运蛋白在WT小鼠中被SGLT2i下调。
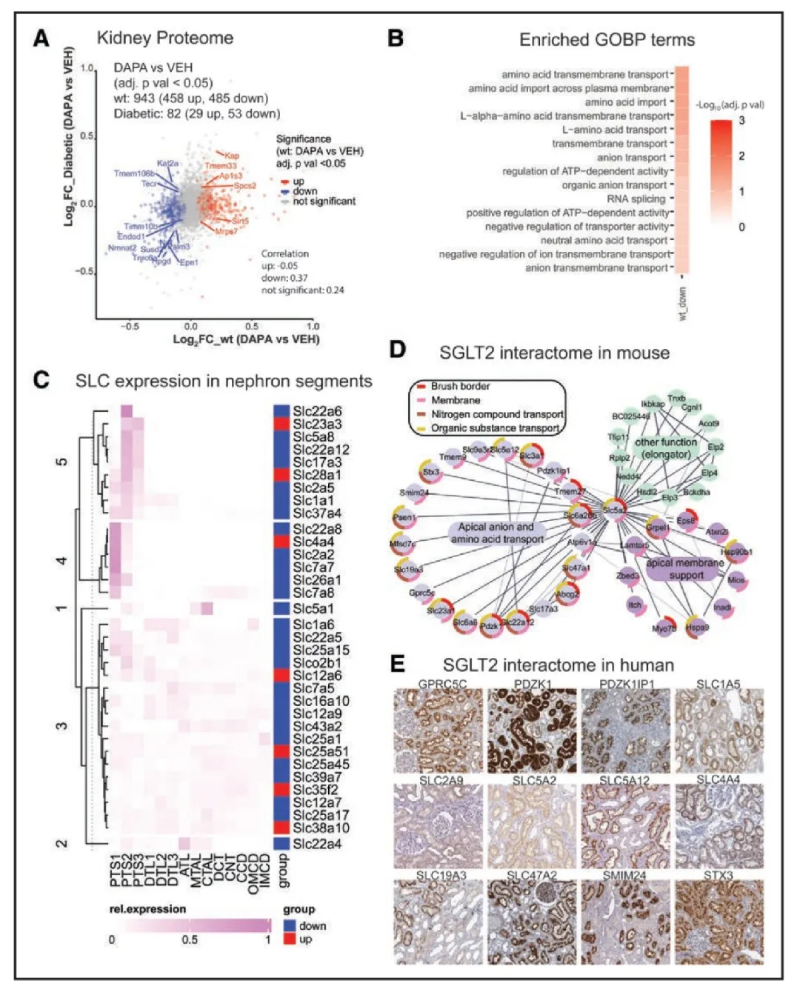
图2-综合蛋白质组/相互作用组分析表明SGLT2i对肾脏代谢产物转运的广泛重塑
4、SGLT2i降低血浆肠源性有机阴离子(尿毒症毒素)水平,尽管肾脏分泌转运蛋白表达降低
为了确定除了葡萄糖之外的其他代谢信号通路是否影响了整体代谢谱,作者在选定的器官和生物体液中进行了非靶向代谢组学分析,总共有186种代谢物发生了显著变化(所有器官总计322种)。作者发现SGLT2i主要影响尿液和血浆中代谢物的丰度,并且与糖尿病小鼠相比,非糖尿病小鼠受影响的分子多样性更广泛(图3A)。
SGLT2抑制剂(SGLT2i)改变了肾蛋白质组和磷酸蛋白质组,同时调控其他代谢物转运蛋白。其抑制作用引起了血浆和尿液代谢物的显著变化。因此,研究者提出肾蛋白质组的重编程可能部分解释了观察到的代谢物变化。文章中指出了可能影响体液循环代谢物组成的多个过程,包括尿液排泄的改变(图3B)。在WT小鼠中,SGLT2i在肾脏中减少了27种SLC的表达。结合这些结果和尿液代谢谱,表明了SGLT2i可能通过影响其他器官的代谢物组成,从而导致尿液中代谢物的变化(图3C)。
接下来,作者分析了血浆和尿液中代谢物的含量,这些代谢物可以反映对肾脏转运的主要影响。正如预期的那样,葡萄糖和多种其他糖代谢物的血浆:尿液比率下降(图3D),可能是因为肾小管重吸收减少。血浆:尿液比率增加的代谢物是赖氨酸代谢物,包括二氨基庚二酸、三甲基赖氨酸、哌可酸和氨基己二酸,一种针对小鼠模型中肥胖和糖尿病的保护性代谢物。许多响应SGLT2i而增加血浆:尿液比率的化合物是近端肾小管有机阴离子转运蛋白OAT1的底物(图3D):其中包括乙酰半胱氨酸、瓜氨酸、葡萄糖酸盐和蛋氨酸, 表明这些化合物的肾脏分泌可能会减少。蛋白质组分析结果证实了这一点,即SGLT2i降低了WT中OAT1和OAT3的表达,肾膜组分的免疫印迹分析证实了这一点(图3E)。与此同时,观察到SGLT2i降低了所谓的滞留毒素或尿毒症毒素的血浆水平(图3A)。为了证实这一发现,对已知在肾脏疾病中保留且主要由肠道微生物组产生的血清代谢物进行了针对性分析。SGLT2i减少了 WT 小鼠血浆中的许多尿毒症毒素,包括PCL、ILA、邻氨基苯甲酸、香草酸和3-吲哚基硫酸盐(图3F)。在独立的非糖尿病动物模型(高血压Dahl SS大鼠)中,SGLT2i 同样显着降低了PCL硫酸盐和ILA:尿液比率(图S4E)。如前所述,这不能通过肾尿毒症毒素 (OAT1/OAT3) 分泌能力的下调来解释,并且表明SGLT2i改变了这些化合物的形成。
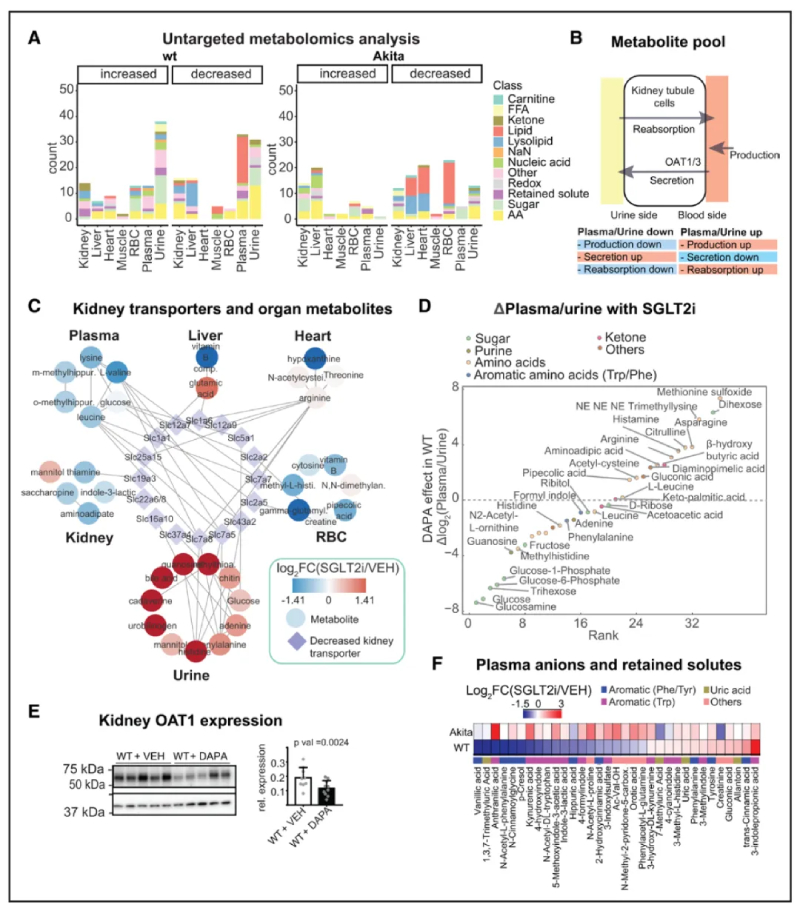
图 3-非靶向代谢组分析揭示了SGLT2i诱导的氨基酸和有机阴离子代谢变化
5、SGLT2i重组尿毒症毒素氨基酸肠道菌群发酵
许多尿毒症毒素是由菌群产生的,SGLT2i改变尿毒症毒素的代谢物,主要来自苯丙氨酸和色氨酸。因此,作者假设SGLT2i影响菌群,从而改变这些代谢物的产生。为了检验这一假设,使用宏基因组辅助宏蛋白质组学分析了匹配的盲肠微生物组(图 S6A)。通过宏基因组学总共发现了6899个物种。将其转化为蛋白质组,定量了这些物种的14621个蛋白质(WT为8249个,Akita小鼠为10847个),与Akita小鼠相比,SGLT2i在WT中的作用更强。系统发育概述总结了SGLT2i在WT小鼠中从门到科水平对微生物群的重新配置(图4A)。在属水平上,SGLT2i促使Akkermansia 和Lachnoclostridium增加,Acetatifactor和Bilophila减少(图S6B)。
宏蛋白质组的多样性分析显示,治疗后糖尿病小鼠的α多样性较高,而WT和糖尿病小鼠的对照和治疗动物的β多样性显着不同。宏蛋白质组分析还涵盖了消化道的典型蛋白质,其中大多数蛋白质被SGLT2i 下调,34个下调,3个上调。与肾脏一样,一些减少的蛋白质参与营养转运,包括寡肽的Slc15a1、尿酸盐/外源性分泌转运蛋白 Abcg2和脂肪酸输入的Slc27a4。
由于WT小鼠中SGLT2i改变的许多血浆溶质是芳香族氨基酸的代谢物,因此分析了可以在蛋白质组水平上代谢这些氨基酸的细菌的丰度。对于产生吲哚的细菌,发现表达色氨酸酶以从色氨酸产生吲哚的物种减少(吲哚丙烯酸;图4B)。
使用苯丙氨酸等芳香族氨基酸作为底物可以减少甲酚和苯酚的生成剂(图4B)。粪便代谢组检测表明显示粪便中存在达格列净(图4C)。在达格列净治疗小鼠的这些粪便样本中,色氨酸和苯丙氨酸发酵的代谢物有所减少(图4C)。为了探究达格列净在粪便中的直接作用,将SGLT2i添加到人粪便中。厌氧发酵后,发现吲哚乳酸、色氨酸代谢物和肉桂酰甘氨酸减少(图4D);也就是说,与WT小鼠血浆中SGLT2i 减少的化合物相关的化合物(图3F)。在人体粪便发酵中添加SGLT2i也逆转了这些毒素母体分子的消失,特别是芳香族氨基酸色氨酸、酪氨酸和苯丙氨酸(图4D)。
这表明SGLT2i对微生物群产生较少尿毒症毒素的生理作用也可能涉及SGLT2i对微生物群的直接影响。
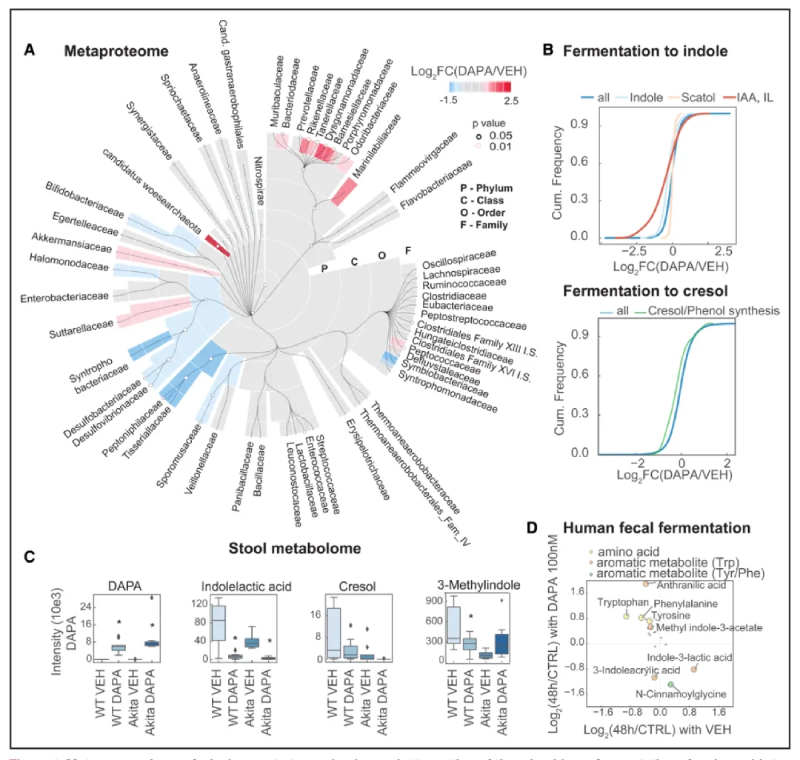
图4-代谢蛋白质组学分析表明,SGLT2i重塑和减弱了氨基酸微生物组发酵为尿毒症毒素的能力
6、SGLT2I对尿毒症毒素代谢产物的净减少不依赖SGLT2
作者进一步检测了还原的代谢物是否独立于SGLT2蛋白的存在,以及这些影响是否在更长的时期内保持。使用了SGLT2 KO小鼠模型(SGLT2 KO)。用SGLT2I(达格列净)对SGLT2 KO和WT小鼠进行了16周的正常饮食治疗,分析了血浆和尿液,并使用保留代谢物小组进行了血浆靶向分析(图5A)。SGLT2 KO小鼠的血糖较低,葡萄糖排泄量较高,食物摄入量较高(图5B和图S6E)。在KO小鼠中,SGLT2i不影响这些措施中的任何一项。
在SGLT2 KO和WT小鼠中,许多代谢物的比率发生了类似的变化,就像在WT小鼠中使用达格列净和溶剂处理一样(图5C左图),这表明SGLT2抑制的后果。在其他方面,葡萄糖比率的下降,反映了尿糖排泄的增加。正如预期的那样,SGLT2的缺失阻断了达格列净对葡萄糖排泄的影响(图5C右图)。另一方面,达格列净显著改变了SGLT2 KO小鼠体内许多代谢物的比例,表明了一种偏离靶点的效应(图5D)。血浆:尿液比例的排名变化显示,达格列净降低了SGLT2 KO小鼠中多种芳香酸代谢物的比例,包括甲酚和马尿酸盐,其次是色氨酸代谢物。血浆水平分析确定了SGLT2i在SGLT2 KO环境中显著改变的5种代谢物,包括PCL硫酸盐和一种修饰的马尿酸(图5E和5F)。该实验表明SGLT2i治疗具有非靶点效应,包括对甲酚、马尿酸盐和色氨酸代谢物。
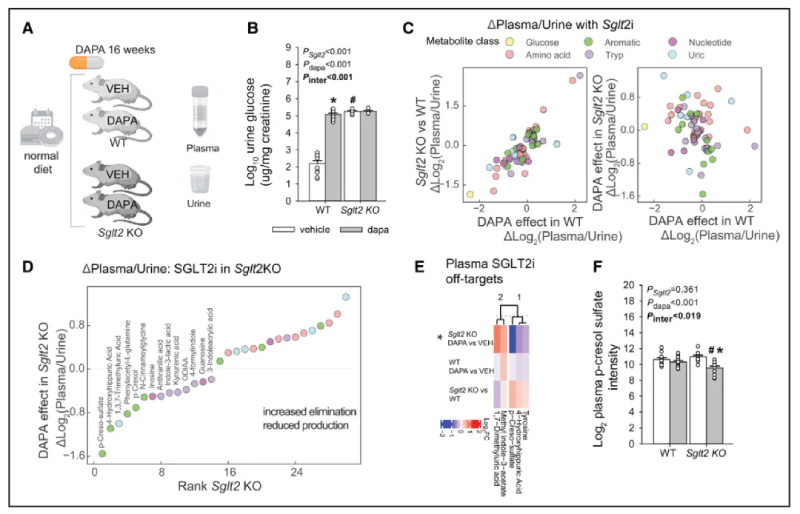
图5-利用SGLT2 KO小鼠探索SGLT2i的代谢脱靶效应
7、SGLT2i的代谢器官通讯效应在人类中是相关的
鉴于肾脏SGLT2相互作用组以及微生物对SGLT2i的反应在小鼠和人类中相似,我们想知道SGLT2i是否会影响循环中的溶质,在纵向数据中与心血管相关。对来自2个独立研究的患者的血浆样本进行了靶向代谢组分析,目标是80个有机阴离子和尿毒症毒素。在第一组>40名患者中,在失代偿性心衰的真实环境中分析了这种影响(图6A)。结果表明,SGLT2i显著降低或钝化了心力衰竭患者血浆中几种有机阴离子的增加,但仅当住院期间添加SGLT2i时(图6B和6C)。包括几种色氨酸代谢物,如ILA、犬尿酸和乙酰色氨酸,以及苯丙氨酸代谢物苯乙酰谷氨酰胺和PCL硫酸盐。分析了在糖尿病患者中使用SGLT2I(依帕列净)的随机对照试验的纵向数据(图6D)。与基线和安慰剂相比,二甲基尿酸和三甲基尿酸的血浆浓度降低,PCL降低,吲哚代谢物增加缓慢(图6E和6F)。在两项临床研究中,降低的溶质大部分来自嘌呤代谢和肠道芳香氨基酸代谢,这与在小鼠身上观察到的代谢器官一致。
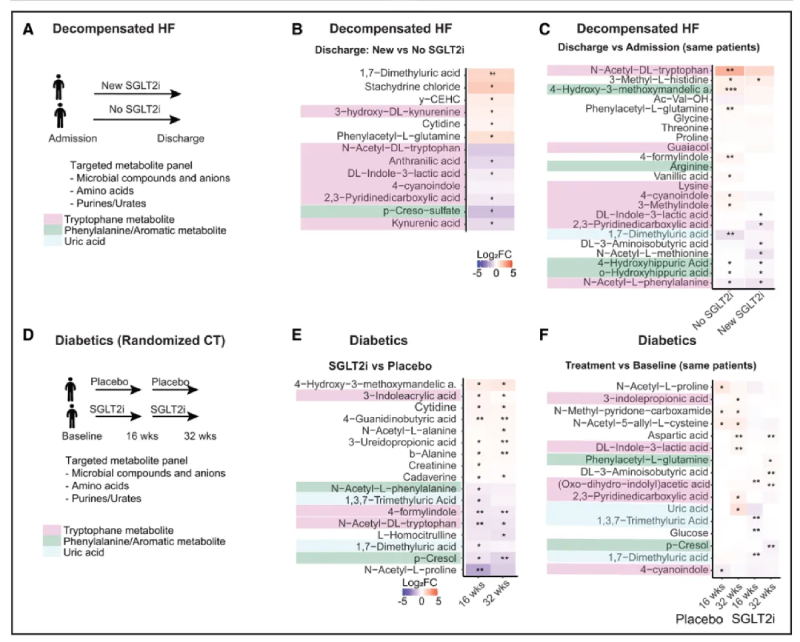
图6-SGLT2i 诱导的尿毒症毒素减少也适用于人类
8、SGLT2i依赖代谢物对甲酚诱导人EHT应激信号
在人类、小鼠(包括Sglt2 KO小鼠)和大鼠研究中的不同循环代谢物之间观察到一致的总体趋势(图7A),在观察到的所有系统中,SGLT2i均一致降低PCL硫酸盐或 PCL。为了分析这种化合物对人体组织的影响,将hiPSC EHT暴露于PCL。PCL在先前报道的患者浓度(300 μM)68,69 下改变了心肌细胞的松弛时间(图7B)。数小时内浓度提高十倍(低mM 范围)显着降低了力和频率(图7C和图S7A),当 EHT 受到频率控制时也是如此(图S7B)。PCL 对 EHT 的影响是部分可逆的,可以通过洗掉化合物来恢复(图7C )。
为了进一步阐明该机制,对用300μM PCL、吲哚乳酸和3种其他芳香族代谢物处理的 EHT 组织进行了蛋白质组学分析(图7D)。观察到最强烈的变化是 PCL 的反应(图7D)。多种蛋白质的增加包括心脏病相关通道TRPM4、 FLNA和生长因子CCN1;减少的蛋白质包括 PPP1R1A,其下调已被报道为人类HF的标志。PCL改变的蛋白质组的一个独特特征是心脏肌节相关蛋白的减少(图S7D),以及应激信号 GDF15的强烈感应(图7E)。考虑到HF患者中该通路的调节,检测了GDF15 水平,发现接受SGLT2i治疗心力衰竭的患者循环 GDF15 减少(图7F)。
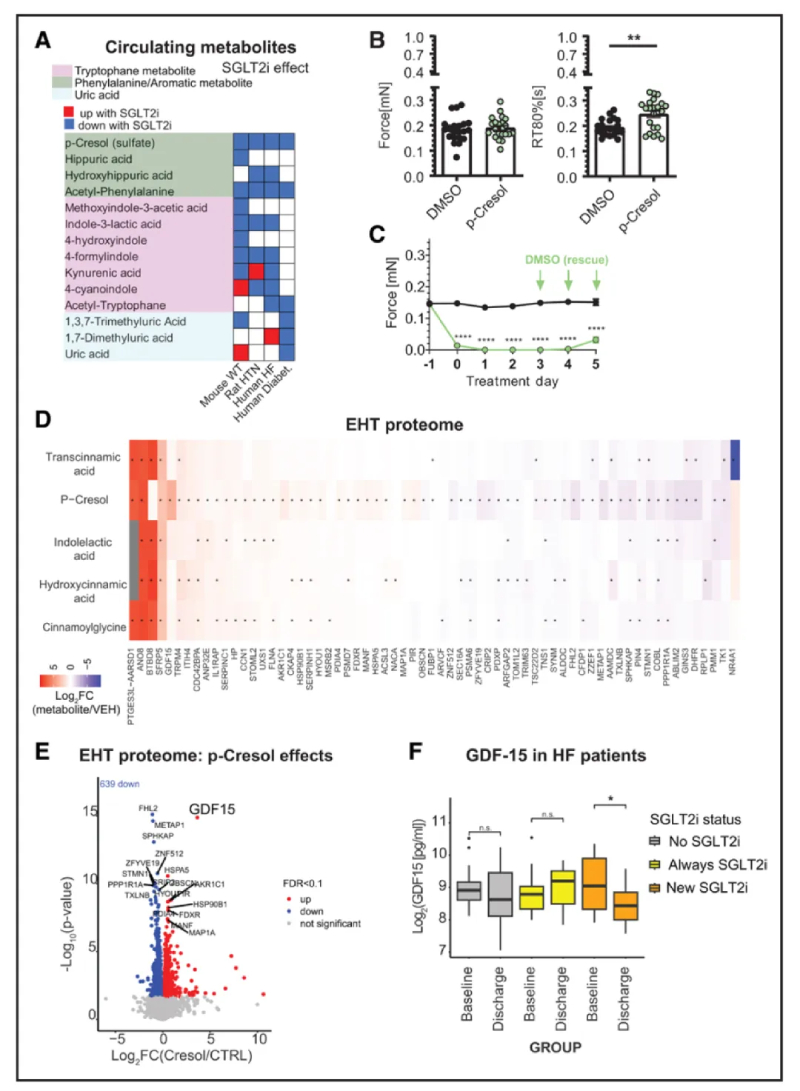
图7-SGLT2i调节的尿毒症毒素对甲酚对人体工程心脏组织的影响
研究总结
该研究通过整合多个代谢器官和体液样品,进行了深入的蛋白质组学、磷酸化蛋白质组学和代谢组学分析,发现SGLT2i减少了尿毒症毒素(如对甲酚硫酸盐)的微生物群形成,从而减少了它们的体内暴露和肾脏解毒的需要,结合SGLT2i对肾脏的直接影响,包括较少的近端小管葡萄糖毒性和对顶端转运体(包括钠、氨基酸和尿酸盐的摄取)的广泛下调,为肾脏和心血管保护提供了代谢基础。该研究提供的资源为更深入地了解SGLT2抑制剂对代谢、肾脏和心脏功能的影响,从而对维持心血管健康提供了新的见解。








 京公网安备 11011302003368号
京公网安备 11011302003368号