
期刊名称:Molecular Plant
影响因子:21.949
发表单位:中国科学院遗传与发育生物学研究所
研究部位:高等植物及绿色生物
研究方法:磷酸化蛋白质组、PRM靶向蛋白组
研究背景
2023年11月27日,中国科学院遗传与发育生物学研究所汪迎春团队在Molecular Plant在线发表了题为GreenPhos, a universal method for in-depth measurement of plant phosphoproteomes with high quantitative reproducibility 的研究论文。论文中报道了一种具有突破性的植物磷酸化蛋白质组学新技术。该技术采用了简化、稳健的工作流程,有效地克服了植物磷酸化蛋白质组分析的主要技术难点,能高灵敏度、高特异性快速地富集植物磷酸肽。利用该技术可定量分析不同植物的磷酸蛋白质组,其分析深度之深、定量重复性之高前所未有,有望成为植物磷酸蛋白组学的通用技术。由于该技术主要面向高等植物及其它绿色生物(如衣藻),且操作简便,极大地降低了实验所需的人力和试剂费用,因此命名为GreenPhos (绿磷)。
蛋白质磷酸化在植物的生长、发育、环境适应以及作物的产量和品质调控中发挥着重要的作用。深度解析磷酸化蛋白质组是全面理解磷酸化如何行使功能的有效手段。然而,与动物相比,植物磷酸化蛋白质组的深度解析在技术上更具挑战性。因为植物细胞具有致密的细胞壁和大量的包括色素在内的次生代谢物,前者极大地增加了蛋白质提取的难度,而后者严重地干扰了磷酸肽富集的效率和特异性。
实验材料
野生型拟南芥(Col-0)幼苗在10%漂白剂中表面消毒,在无菌去离子水中漂洗,然后播种在含有1%琼脂,pH为5.8的半强度Murashige和Skoog (1/2 MS)培养基上。种子在4℃的黑暗条件下发芽2天。幼苗在1/2 MS固体培养基上生长10天,然后转移到1/2 MS液体培养基上,再培养16小时。在盐胁迫实验中,将幼苗转移到添加或不添加(对照) 100mM NaCl的新鲜培养基中,根据需要孵育30 min或120 min。
研究结果
1.GreenPhos的开发——一种稳定高效的纯化植物磷酸肽的方法
从植物组织中高效提取蛋白质是深入分析植物蛋白质组和磷酸化蛋白质组的第一步和关键一步。为此,作者比较了SDS、GdnHCl和SDC等不同变性剂对拟南芥叶片中蛋白质的提取性能。结果发现SDS-和SDC-提取的蛋白的性能相似,但优于GdnHCl。植物样品相较于动物样品含有较低浓度的蛋白质,因此作者优化了磷酸化蛋白质组的提取和富集的方法,即用SDS或GdnHCl缓冲液提取的蛋白质样品,在蛋白质消化和随后的磷酸肽富集之前,必须去除变性剂(图1A)。接着用氯仿-甲醇沉淀提取的样品,去除变性剂和其他干扰生物分子(图1A和1B)。而作者通过实验发现,SDC法提取的蛋白样本不需要经过氯仿-甲醇沉淀,而鉴定到的磷酸化蛋白更多,同时需要的植物材料更少。因此作者认为SDC法更节省成本达到更好的效果,并在番茄、水稻、绿藻等生物中得到验证,从而确定了磷酸化蛋白组学的方法,称之为GreenPhos。
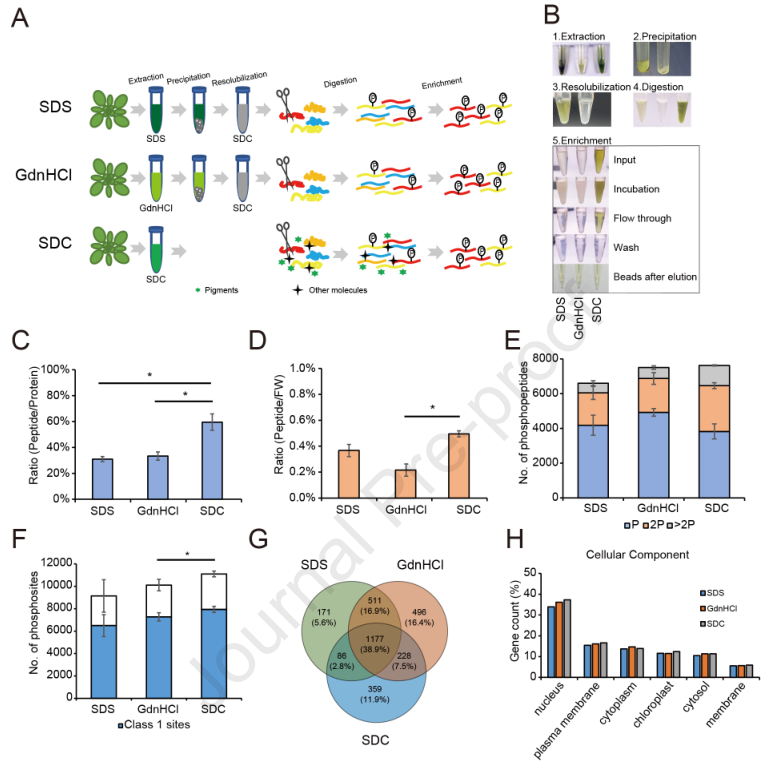
图1 GreenPhos的工作流程
2. GreenPhos与当前磷酸肽富集方法的比较
GreenPhos与当前基于polyMAC的磷酸肽制备方法相比,在上机蛋白等量的情况下,GreenPhos方法平均鉴定出11072个磷酸化位点,而polymac法鉴定出9399个磷酸化位点 (图2B),表明GreenPhos的分析深度比PolyMAC的高18%,并且需要的样本量更少,省去了更多的实验步骤和时间。与此同时,作者发现GreenPhos的富集选择性(92%)也高于PolyMAC的富集选择性(54%)(图2C)。可能原因是次生代谢物的存在影响了磷酸肽对TiO2珠的亲和力,PolyMAC优先富集磷酸化肽,而GreenPhos富集了更多的双重或多重磷酸化肽(图2D-E)。总之,在当前实验条件下,GreenPhos优于基于polyMAC的方法。
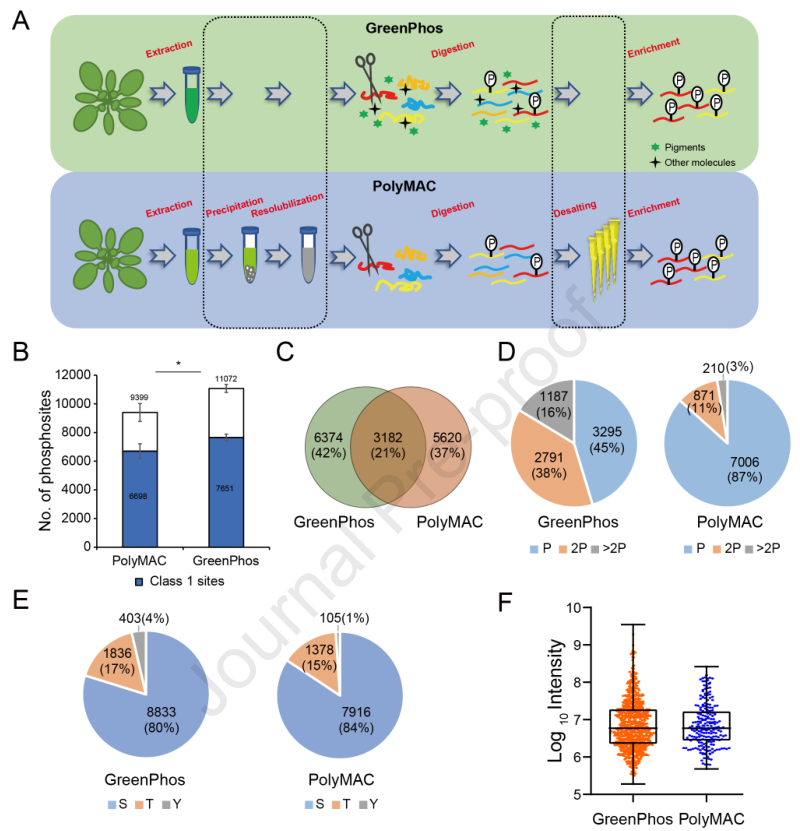
图2 GreenPhos和基于polyMAC的方法的性能比较
为了进一步测试GreenPhos的效率和灵敏度,作者从拟南芥叶片中提取蛋白质(100、300、600和900μg),分别从4个样品中分别富集磷酸肽,并通过LC-MS分析(图3A)。通过比较鉴定出的磷位点和磷酸肽的数量,发现两者都随着上机量的增加而增加,达到600μg后鉴定出的磷酸化位点和磷酸化肽的小幅增加 (图3A和3B)。说明鉴定的磷酸化位点的数量与起始蛋白的数量不存在正相关,因为LC-MS在使用相同的获取参数时是饱和的。
为了评估GreenPhos在定量磷酸化蛋白质组学中的潜力,作者了鉴定的磷酸化肽与上机量之间的定量关系。以900μg为参照,在100、300和600μg中,检测到的磷酸肽强度比与参考中磷酸肽强度比的中位数与理论值具有很好的相关性(图3C)。分析结果表明,GreenPhos与单次LC-MS结合可用于从高达600μg的蛋白质中定量磷酸肽,准确度高。通过5次重复质谱分析,评价了GreenPhos在植物磷蛋白组定量鉴定中的再现性。5个生物重复和5个技术重复的磷酸肽强度的Pearson相关系数平均分别为0.95和0.97 (图3D和3E),表明具有较高的定量可重复性。从5个生物重复中共鉴定出磷酸化位点14063个,其中74%的磷酸化位点至少在2个重复中鉴定出 (图3F)。结果表明,GreenPhos可以在定量和定性上产生高度可重复性的结果。
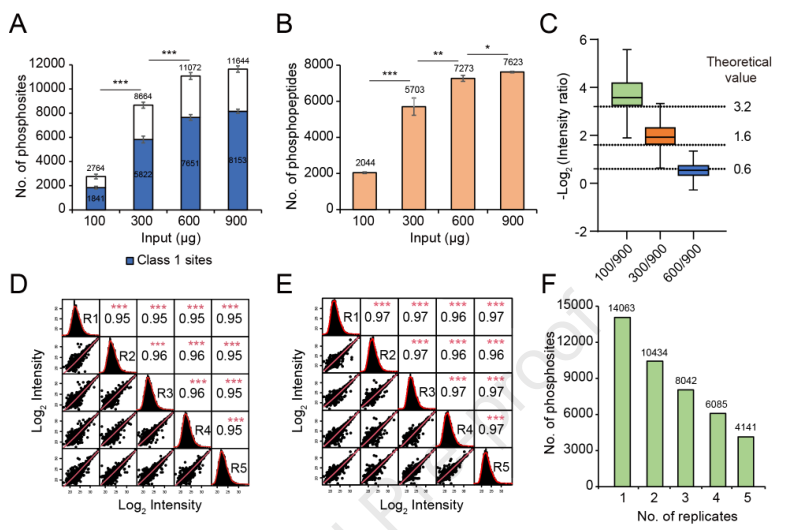
图3 GreenPhos的灵敏度、定量准确度和重现性评价
4. 利用GreenPhos对拟南芥盐胁迫诱导的磷酸化蛋白组分析
为了深入了解拟南芥对盐胁迫响应中蛋白磷酸化介导的信号,作者使用GreenPhos和单次LC-MS检测,分析了100 mM NaCl处理30分钟(T30)和120分钟(T120)或未处理(T0)的拟南芥幼苗的磷酸化蛋白质组学(图4A)。每个处理包括3个生物学重复,每个重复600μg蛋白用于磷酸肽的富集。总共从4316个磷酸化蛋白中鉴定出12908个磷酸肽,含有15889个磷酸化位点。在磷酸肽中,13473个磷酸位点在处理的至少一个重复中包含可量化的信息。
对三个重复中至少任意两个重复中的11128个磷酸位点进行了label free定量。采用p< 0.05筛选不同处理间存在差异的磷酸化位点。聚类分析显示,磷酸化蛋白形成了四个不同的簇,显示了盐胁迫诱导的磷酸化水平在所有处理中表现出显著差异(图4B)。在簇1中,磷酸化水平在盐胁迫30 min后适度下降,在120 min后升高。在簇2中,磷酸化水平在30 min时总体上升,而在120 min后维持在相似的水平。在簇3中,磷酸化水平在30 min时没有显著变化,在120 min时下降。在簇4中,磷酸化水平在30 min盐胁迫下下降,并在120 min时维持在类似的水平。
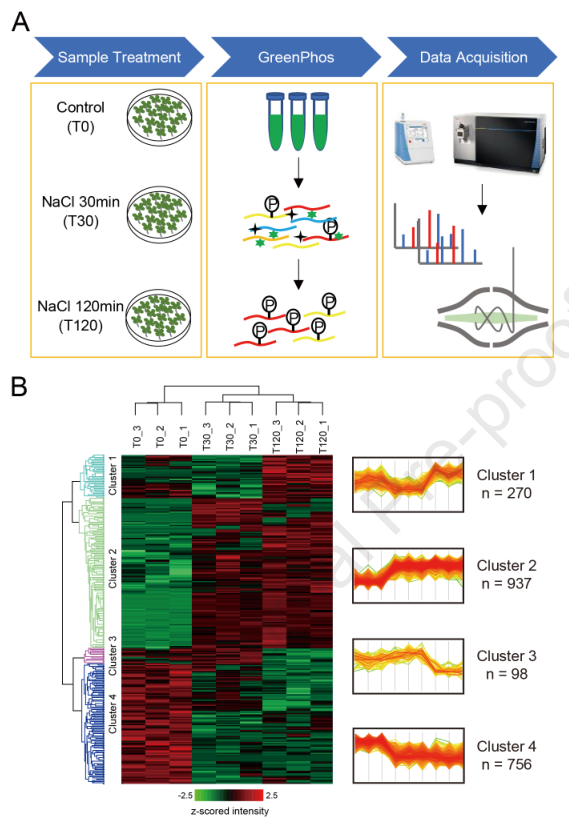
图4 利用GreenPhos定量鉴定盐胁迫下分析拟南芥幼苗磷酸化蛋白组
使用Fisher’s-exact对每个簇中的磷酸化蛋白进行GO和KEGG富集分析(图5)。与报道一致,在细胞组分条目,细胞核、细胞质和细胞膜蛋白在所有簇中被显著富集。在分子功能条目,激酶活性在簇1、2和4中富集,而在簇3中不富集,但是蛋白质去磷酸化的在生物过程条目在簇3中富集。结果表明,激酶的磷酸化激活和磷酸酶的去磷酸化是盐胁迫诱导的重要反应。
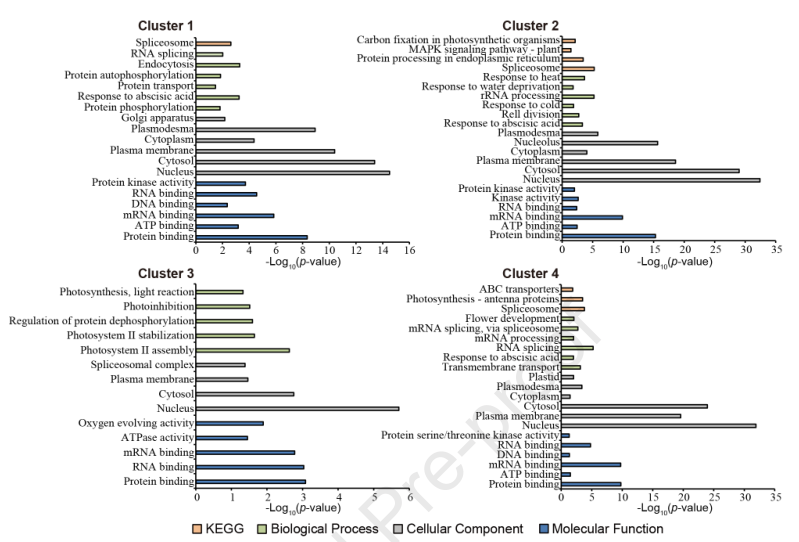
图5 盐胁迫诱导的差异磷酸化蛋白的功能富集
激酶通常通过识别特定的序列motif来磷酸化它们的底物,即磷酸化motif。使用motif-x算法 (https://meme-suite.org/meme/tools/momo)选择在任意两个处理中表现出差异水平的磷酸化位点进行磷酸化motif分析。在处理T30/T0之间显示磷酸化增加的磷酸化位点中,四个motif (SP、SDxE、SDxD和LxxxxS)被过度表达,而两个motif (SP和RxxS)在显示磷酸化降低的磷酸化位点中过度表达(图6A)。同样,在120 min盐胁迫(T120/T0)下,在磷酸化位点中,分别有4个motif(SP、SDxE、SDxD和SxxE)和3个motif(SP、RxxS、SxxE)的水平升高或降低(图6B)。两种处理(T120/T30)的比较显示,在120 min盐胁迫下,两个motif(SP、SD)和motif(SP)在磷酸化位点中被过度表达,分别表现出更高和更低的磷酸化水平(图6C)。
在所有处理中,富含脯氨酸的motif (SP)在上调和下调的磷酸位点中都被过度表达,并且通过PRM进一步验证了β-淀粉酶1 (BAM1)上含有S55的一个motif (图6)。紧接着作者鉴定了5个CDPKs的12个磷酸位点和3个MAPK上的4个磷酸位点,包括MPK19激活环上的一个磷酸位点,这些激酶被认为和盐胁迫相关。综上所述,包括MAPKs和CDPKs在内的多种激酶在盐胁迫中起作用。
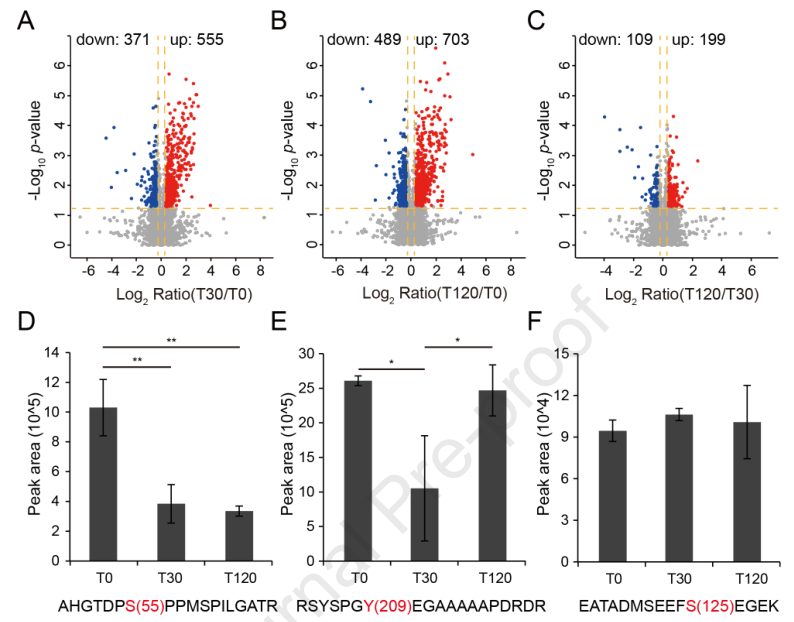
图6 磷酸化对盐胁迫的反应
除了激酶外,在簇1、2和4中剪接体被KEGG通路显著富集 (图5),暗示磷酸化调控mRNA的可变剪接,是植物响应胁迫的关键过程。在盐胁迫下,18个剪接体蛋白上共有28个不同的位点被差异磷酸化 (图7)。利用PRM进一步验证了Y209在SCL30上的差异磷酸化(图6)。据报道,RNA解旋酶及其磷酸化对剪接体的组装至关重要。在盐胁迫30分钟后,Prp5的S210、S442和S444位点磷酸化增加,并在120分钟后保持高水平,Prp19的多个亚基也观察到类似的磷酸化模式(图7)。尽管这些差异磷酸化事件的意义尚未得到明确的证明,但它们可能参与了盐胁迫诱导的mRNA剪接的调控。
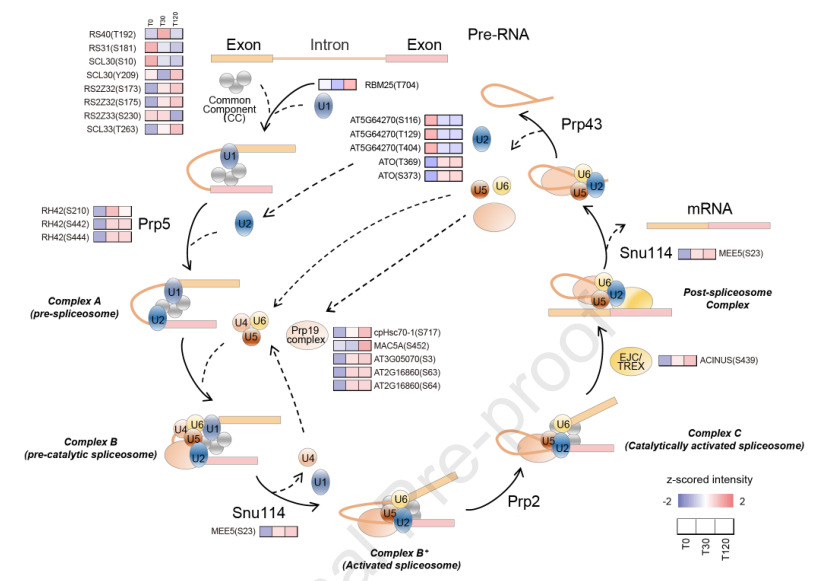
图7 盐胁迫诱导剪接体蛋白的差异磷酸化
研究总结
GreenPhos不仅极大地提高了植物磷酸化蛋白质组的解析效率,而且也显著地减低了实验操作的难度和成本,为更深入地理解蛋白质磷酸化在植物生命过程中的功能提供了强有力的工具。该研究成果将有效推进磷酸化蛋白质组学与植物生物学和农学等领域的交叉融合,在发掘与作物产量、品质以及抗逆密切相关的磷酸化蛋白及其位点中有着广泛的应用前景。
Duan X, Zhang Y, Huang X, Ma X, Gao H, Wang Y, Xiao Z, Huang C, Wang Z, Li B, Yang W, Wang Y. GreenPhos, a universal method for in-depth measurement of plant phosphoproteomes with high quantitative reproducibility. Mol Plant. 2023 Nov 27:S1674-2052(23)00393-3. doi: 10.1016/j.molp.2023.11.010. Epub ahead of print. PMID: 38018035.








 京公网安备 11011302003368号
京公网安备 11011302003368号