前言
1. 适用范围
本指南介绍百迈客 DNA 类组织样品的送样要求及制备方法。采集送样前请详细阅读。
2. 声明
对于危害程度为第一、二类的高致病性样品,只接收提取后的核酸样品,不接收组织 样。对于危害程度为三、四类的致病性或传染性的组织样,必须先通过销售或运营与医学 实验平台负责人沟通,确认无高致病和传染性且能进行后续实验后再安排样品寄送。危害 程度的判定标准具体参见《人间传染的病原微生物名录》 。
3. 提取风险提示
核酸提取质量与物种及组织部位、样本制备、样本交接、提取方法与操作、以及环境 等因素息息相关,故无法完全保证提取质量,望老师知悉理解,并做好组织备份。为保障 获得相对较高质量的核酸,请老师务必按照以下指导原则准备样本。
样本准备前注意事项
1. 取样的代表性
所采集的样本应该通过严格的细胞学、组织学、病理学等相关鉴定,因为这关系到实 验最终结果是否具有科学意义,所以客户须根据实验目的设计相关科学取样方案和取样步 骤。
2. 取样的准确性
正常组织样本中不能含有病变组织,而病理组织样本中也不可以夹带有正常组织。在 条件允许的前提下,争取做到实验组与对照组的样本在取材时间、部位、 处理条件等方面 尽可能保持一致,否则可能会影响实验结果的重复性和可信度。 代表性样本的各种特征数 据必须被准确记录,并按要求采集、制备、储存、运输进行实验处理。
3. 取样的重复性
生物学重复的取样应尽量减少重复间样品的差异。在条件允许的前提下,做到重复样 本在取材时间、部位、 处理条件等方面尽可能保持一致,否则可能会影响实验结果的重复 性和可信度。
4. 取样的及时性
样本质量是影响实验结果的最关键因素,因此用于研究的实验样本,在采集、贮存、 运输和制备的过程中尽可能地做到迅速,最大限度的缩短从样本采集到实验的时间。
5. 取样的低温性
所取样本离体后,经快速清洗和标记等处理后,应立即投入液氮中速冻至少 3 h,之后 保存于-80 ℃ 冰箱或者干冰中,确保在实验操作前样品始终处于-80 ℃,以避免 RNA 的降 解。
组织样送样量要求
DNA 提取组织送样量要求
二代
| SLAF | 重测序 | 甲基化 | |
|---|---|---|---|
| 新鲜动物组织干重 | 0.5g | 0.5~1g | 1~2g |
| 新鲜植物组织干重 | 0.5~1g | 1~2g | 1~2g |
| 全血 | 1.5ml | 1.5ml | 2ml |
| 菌体(干重) | 1~2g | 1~2g | 1~2g |
三代
| ONT-动植物基因组 | ONT-动植物重 测序/甲基化 | PB-动植物基因组 | |
|---|---|---|---|
| 肝脏/肾脏等内脏组织 | ≥3.5g | ≥0.35g | ≥3.5g |
| 肌肉 | ≥5.0g | ≥0.5g | ≥5.0g |
| 哺乳动物血液 | ≥5.0mL | ≥0.5mL | ≥5.0mL |
| 禽类/鱼类血液 | ≥0.5mL | ≥0.1mL | ≥0.5mL |
| 新鲜叶片 | ≥5.0g | ≥0.5g | ≥5.0g |
| 花瓣/茎 | ≥10.0g | ≥1.0g | ≥10.0g |
| 根/种子 | ≥20.0g | ≥2.0g | ≥20.0g |
| 培养细胞(细胞数) | ≥1×10 8 | ≥1×10 7 | ≥1×10 8 |
菌类
| 组织类型/产品类型 | ONT-细菌/真菌 基因组 | PB-细菌/真菌基 因组 |
|---|---|---|
| 细菌 | ≥3.5×10 10 | ≥3.5×10 10 |
| 单细胞真菌 | ≥3.5×10 10 | ≥3.5×10 10 |
| 大型真菌 | ≥10.0g | ≥10.0g |
* 注:不同类型的组织样品,DNA 的提取得率差别较大,像人或哺乳动物的全血中红 细胞没有细胞核,每毫升血液中实用细胞数少,DNA 得率比较低,送样量需相应增加;而 鸟类或鱼类血液中红细胞含有细胞核,DNA 得率会增高,送样量可适当减少。含肌纤维细 胞丰富的肌肉组织以及含多糖多酚较高的复杂植物,DNA 得率会受到影响。真菌的细胞有 含甲壳素(又叫几丁质)为主要成分的细胞壁,提取难度较大,建议尽量多准备一些样品。
核酸送样要求
1.送样要求
1.1 术语及定义
1.1.1 检测项目:
m:总量(Total quantity),DNA 的总质量
c:浓度(Concentration),DNA 溶液的 Qubit 检测浓度
N/Q:Nanodrop 检测浓度与 Qubit 检测浓度的比值
Size:片段大小(Fragment size),指 DNA 分子片段主带大小
OD260/280:Nanodrop 检测中 OD260 和 OD280 的比值,反映 DNA 纯度的指标之一
OD260/230:Nanodrop 检测中 OD260 和 OD230 的比值,反映 DNA 纯度的指标之一
1.1.2 样品质量检测方法:
Nanodrop:使用 Thermo Fisher NanoDrop 2000/8000 Spectrophotometer 进行检测的方法
Qubit:使用 Invitrogen Qubit Fluorometer 进行检测的方法
AGE:Agarose Gel Electrophoresis 即使用琼脂糖凝胶电泳进行检测的方法
1.2 DNA 样品送样量要求
请提供 DNA 样品的相关检测结果,例如以下检测手段中的一种或多种检测结果: Qubit、 NanoDrop、 AGE。请采取适当的纯化方法,以避免多糖、多酚、蛋白或者核酸酶对 DNA 样品的污染,并详细注明溶解 DNA 所使用的溶解液类型。
检测结果说明:
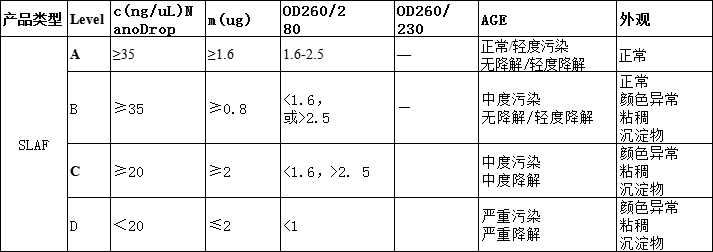
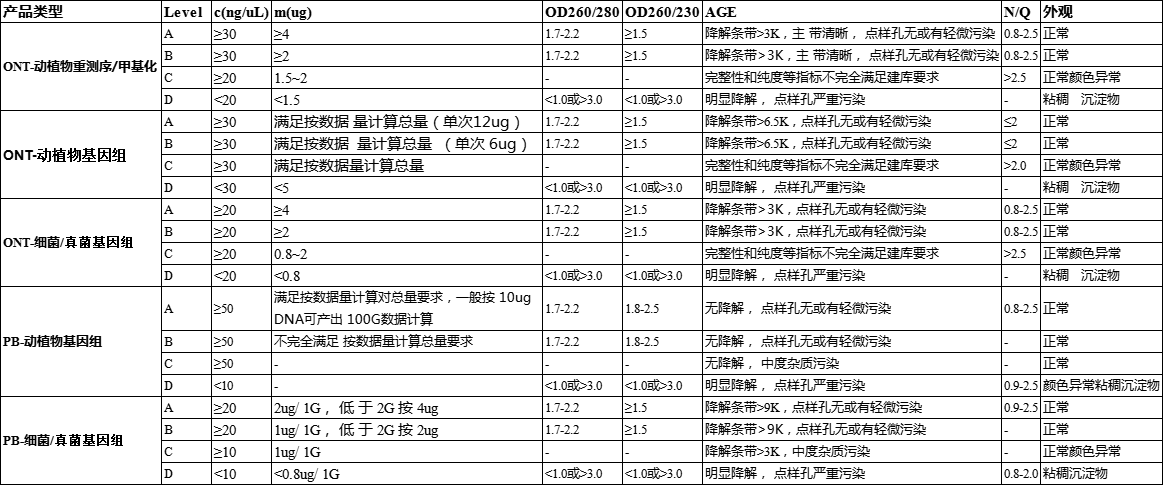
level A:A 类样品,指纯度、片段大小和浓度均合格,总量满足按数据量计算总量要求的 样品。
level B:B 类样品,指纯度、片段大小和浓度均合格,总量不完全满足按数据量计算总量 要求的样品。
level C:质量不完全满足建库要求,可以风险建库但不保证文库大小与测序数据量的样品。
level D:质量完全不满足建库测序要求,不建议使用的样品。
请您按照上述 A 类样品的要求来准备 DNA 样品以确保后续建库测序能够正常进行。如果 您准备的 DNA 样品不能满足 A 类样品指标要求,并且后续不能提供更多的 DNA 样品, 需要提前联系销售人员进行咨询。
2.二代核酸送样要求

3.三代核酸送样要求
样本制备保存指南
1.植物组织
由于老叶或其它组织 DNA 含量可能较低,而次生代谢物含量一般相对较高,因此, 为降低 DNA 提取难度并减少污染物干扰,请尽量选择健康、幼嫩的叶片组织;不建议选 择易带有寄生或共生生物的组织,以及不易清洗和研磨的根、茎等组织致密的器官。另外 藻类组织中的水分会影响提取得率,取样时需将组织样中的水分吸干。新鲜组织样采样流 程如下:
1) 用 70%酒精将材料表面的灰尘及泥土冲洗干净,吸干,再从植物体上取下新鲜组织
2) 样品分割成 50~100 mg 左右的小块,将处理好的组织样本混合均匀后保存于 2 mL 或更大体积的旋盖冻存管中;并标注编号。
3) 迅速置于液氮中冷冻 3~4 h,然后按照顺序依次放入样品盒或者按照一定的规律(例 如 1-10,11-20 等)装于自封袋中,转移至-80 °C 长期保存(禁止乱放,尤其是项目 中样品个数较多时);干冰运输。
*注:
①一定不要使用自封袋常温寄送非干燥组织样,天气炎热,高温下组织样易腐烂变质, 易产生霉菌,导致提取的核酸中混有污染物种的核酸或提取失败,影响公司成本的同时 给客户造成不好的影响。
②干燥样品现在不建议送样,提取成功率低,如果只有干燥样品,使用纸质袋装样,在 外包装自封袋中可以统一装硅胶干燥颗粒。


2.动物组织(不含昆虫和水产类)
1) 活体取下新鲜组织(肌肉、肝脏或其他组织,避免用易于寄生微生物的表皮和肠道、 可能有变异细胞的病变组织),立即剔除结缔组织和脂肪组织等非研究所需的组织 类型。对肿瘤组织的取材,应尽可能准确地判定肿瘤和正常组织,肿瘤组织应将周 围的正常组织切除干净(正常组织也应将周围的肿瘤组织切除干净);
2) 迅速用预冷的 PBS 溶液(RNase free)或 0.9%生理盐水将组织表面的残留血液冲洗干净
3) 如果组织体积较大,应尽量将组织切成长宽高均≤0.5 cm 的小块(即黄豆大小)
4) 将冻处理好的组织样本混合均匀后保存于旋盖的存管中
5) 迅速置于液氮中冷冻 3~4 h,然后转移至-80 °C 长期保存,送样时干冰运输
注:整个样品收集过程保证样品断血后半小时内完成样品制备
3.昆虫
1)昆虫样本,建议进行表面微生物的清洗,较大个体的尽量选取不带肠道部分的组织, 对于较小个体只能用整个个体的,建议进行适当的饥饿处理(但需注意保证昆虫的活 性)。
2)如果组织体积较大,应尽量将组织切成长宽高均≤0.5 cm 的小块(即黄豆大小)
3)将冻处理好的组织样本混合均匀后保存于旋盖的存管中
4)迅速置于液氮中冷冻 3~4 h,然后转移至-80 °C 长期保存,送样时干冰运输
*注:蜜蜂送样时尽量要求老师取胸部肌肉送样,整个蜜蜂送样提取的核酸状态大多数异常, 影响后续实验。不建议送实验室剔除,因为组织速冻过之后再剔除会化冻,提取降解的可 能性较大!
4.水产动物
1)取得活体组织后,用清水清洗,以去除污物,吸干表面液体;
2)如果是甲壳类(如虾蟹等),需解剖活体组织,只取软肉组织,将组织样品割成约 50 mg 的小块(约黄豆大小)
3)液氮速冻后,放入干净的带螺纹旋盖保存管中;
4)转移至-80℃低温保存,送样时选择干冰运输寄送。

5.细胞
一次提取反应所需细胞数≤1 X 10 7 个,以 3 X 10 6 -1 X 10 7 个为宜,可以将细胞经裂解 液裂解后冻存运输。
1) 从培养箱中取出贴壁培养的细胞或悬浮培养的细胞,显微镜下观察细胞,确定生长 状态良好(正常细胞 confluence 在 80 %左右)
2) 弃去培养基,用 PBS 缓冲液快速洗一次,除去 PBS 缓冲液,贴壁细胞可用细胞刮 将其刮下
3) 收集的细胞转入 1.5 mL 的 EP 管中用液氮速冻后置于-80 °C 保存,一管装一次提 取的量,可以将备份样品单独装,禁止将一个样品多次提取的细胞装到一个管中, 干冰运输
注:由于细胞量少,干冰运输务必保证细胞处于冷冻环境,防止环境温度增加细胞降解; 同时因样本少易降解,务必备注信息单微量样本液氮交接
6.全血样本
1) 用医用抗凝管或已装有抗凝剂(选用柠檬酸钠或 EDTA 抗凝剂,不可用肝素)的 旋盖管收集全血样本
2) 上下轻轻颠倒混匀十次后,分装到常规 EP 管中,转移至-20 或-80 °C 长期保存(实 际根据采血管的说明要求操作)
3) 干冰运输
注:
①血液采集管请尽量不要用需专门对应提取试剂盒的采血管,以防送样后我们因无 对应试剂盒影响提取时间(尽量送样前沟通)
②采集完血液之后需将血液转移至 EP 管中,玻璃材质采血管冷冻之后易碎不规范送样玻璃管破碎 规范送样

7.细菌
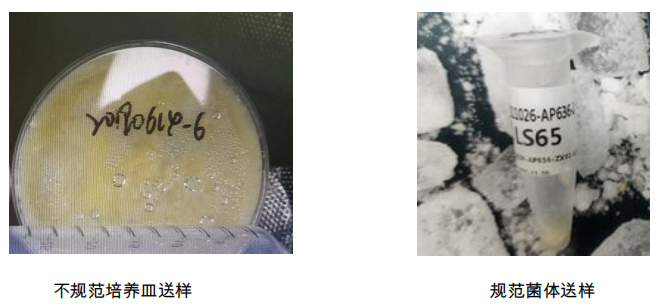
注意:所有菌类样品必须分离好菌体或菌丝送样,切勿连带培养基一起寄送,带培养 基的菌体无法提取。
1)显微镜下观察细菌生长状态,最好收集生长期处于对数期的细菌。
2)将适量体积的菌液转移至 2 mL 旋盖尖底离心管(无菌,无核酸酶)中,于室温下 14000 ×g 离心 1 min。
3)弃掉培养基,将细菌菌体沉淀迅速置于液氮中冷冻 1-3 h 以上(冻存时间视组织量 而定,保证样品冻存充分),然后转移至-80 °C 长期保存。
4)将样品管置于管架上固定好后埋在干冰箱的中间部位,大体积干冰运输。
8.真菌
真菌的形态多样,一般分为单细胞和多细胞真菌,酵母菌属于单细胞真菌,而霉菌和 蕈菌(大型真菌)都属于多细胞的真菌。
8.1 单细胞真菌
单细胞真菌以酵母菌为代表。一次提取反应所需酵母菌的量需≤1×10 7个,以 5×10 6-1× 10 7个为宜。您要做的项目要求送样量较大时,可以将样品按上述数量要求分装后单独保 存。
1)显微镜下观察酵母菌生长状态,最好收集生长期处于对数期的酵母菌。
2)将适量体积的酵母菌液转移至将 2 mL 旋盖尖底离心管中(无菌,无核酸酶),于 室温下 14000×g 离心 1 min。
3)弃尽培养基,将酵母细胞沉淀迅速置于液氮中冷冻 1-3 h 以上(冻存时间视组织 量而定,保证样品冻存充分),然后转移至-80 °C 长期保存。
4)将样品管置于管架上固定好后埋在干冰箱的中间部位,大体积干冰运输。
8.2 大型真菌
大型真菌因种属差异,生长形态差异很大。在制备大型真菌样品时,可参考上述 1.1 植物组织制备方法。
核酸样本
1) 第一种方案是提取完成后的 DNA 溶液直接放入-20 °C 冰箱中进行保存;第二种方案 是采用醋酸钠乙醇沉淀法沉淀 DNA,并且将样品直接放入-20 °C 冰箱中进行保存; 第三种方案是向沉淀后的 DNA 固体中直接加入 1 mL75 %的无水乙醇,并且将样品 直接放入-30 °C 冰箱中进行保存;第四种方案是提取完成后的 DNA 样品使用低温冷 冻仪冷冻成干粉(可常温运输)
注:推荐用第一种方案
2) 样品运送前保存在-20 °C 冰箱,干冰运输








 京公网安备 11011302003368号
京公网安备 11011302003368号