
期刊名称:PNAS
影响因子:12.779
合作单位:斯坦福大学
研究部位:根、茎、叶、枝条
研究方法:转录组、代谢组、体外酶活
研究背景
2021年6月,斯坦福大学 Elizabeth S. Sattely 团队在国际顶尖学术期刊《美国国家科学院院刊》PNAS发表一项重要研究成果,题为:A metabolic regulon reveals early and late acting enzymes in neuroactive Lycopodium alkaloid biosynthesis。研究通过代谢组学和转录组学的方法,确定了一组发育受控的生物合成基因,或潜在的调节子,用于调控石松生物碱的生物合成。
植物合成了许多能影响哺乳动物中枢神经系统的小分子化合物,成为治疗神经系统疾病药物先导的重要来源。一些重要神经活性植物代谢物是赖氨酸衍生的生物碱,但植物合成这类化合物的机制在很大程度上仍未被阐明。为了更好地理解植物如何合成这些代谢物,作者团队聚焦于传统草药石松(Club moss)Phlegmariurus tetrastichus中石松生物碱(Lycopodium alkaloids)的生物合成研
究。迄今已报道发现了数百种石松生物碱,包括乙酰胆碱酯酶抑制剂石杉碱甲(Huperzine A,HupA),其作为阿尔茨海默症(Alzheimer’s disease,AD)治疗药物引起了科学家广泛的研究兴趣。
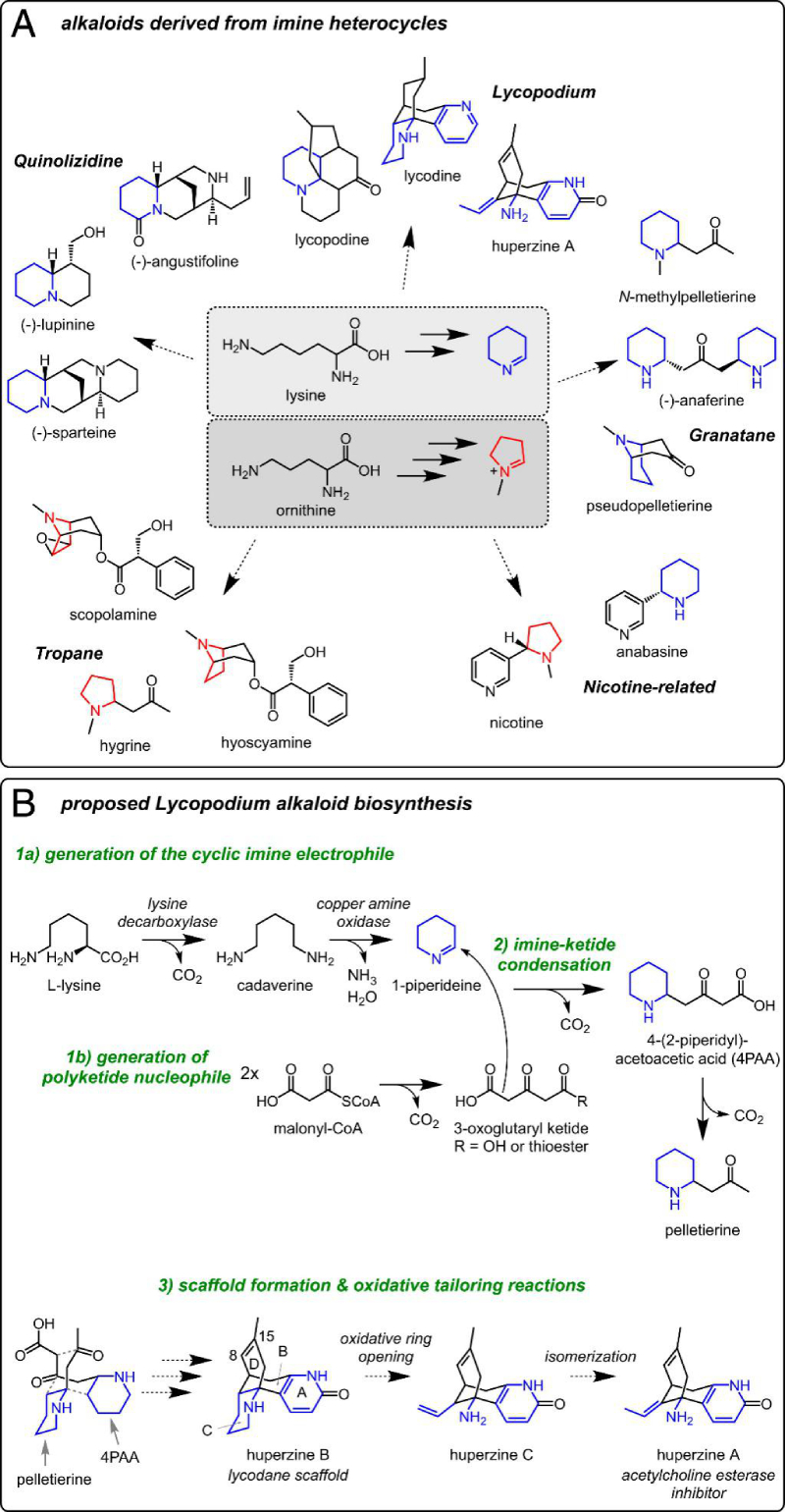
图1 杂环亚胺的脂肪族生物碱的合成逻辑
实验材料
Phlegmariurus属(以前被归类为石杉属)的品种:P. brassii,P. carinata,P. goebelli,P. salvinoides,P. squarrosus和P. tetrastichus,所有植物均在室温和光照下生长,并偶尔通过去离子水(DI)喷洒其根部来浇水。每周一次,向植物提供直接施用于根部的营养液(Ionic Grow for Soil 3-1-5,Hydrodynamics International)。用于异源基因表达的本氏烟草植株在实验室环境温度下,在生长灯下以 16/8 小时的光/暗循环在 PRO MIX HP 菌根土壤(Premier Tech Horticulture)中生长。选择植物在萌发后 4 至 5 周进行
农杆菌介导的转化。
1、转录组实验
取根、茎、叶、枝条,每组3个重复。
2、代谢组实验
取根、茎、叶、枝条,每组3个重复。
研究结果
1. 转录组分析——石松生物碱生物合成研究
为了指导对石松生物碱生物合成的研究,作者重点关注 HupA,因为它已知具有作为 AChE 抑制剂的活性和作为药物的潜力。HupA 由石松属内的物种产生,但这些物种的 HupA 积累水平差异很大。作者推断物种中 HupA 的增加可能与上调的生物合成基因表达有关。因此,检测了石松属的几个物种的 HupA 含量,结果发现P. tetrastichus(图 2A)积累了 HupA 到最高水平。因此,后续的研究将集中在该物种上。之前的研究表明,从头 HupA 生物合成对P. tetrastichus枝条的新生长具有特异性,接着作者通过氘同位素标记实验得到验证,并且发现与茎相比,HupA标记在叶中更广泛分布,表明这里的生物合成基因表达富集(图2B)。因此,作者对对该物种的多个组织进行了RNA-seq分析,揭示石杉生物碱生物合成基因在活性组织中的积累机制。
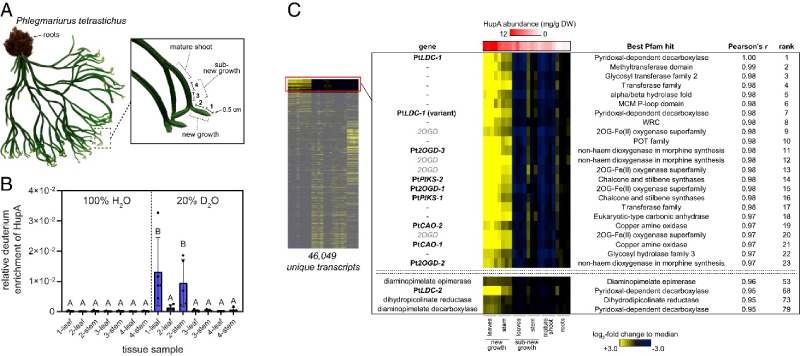
图2 石杉碱甲的植物的代谢组学和转录组学
为避免从头转录组组装的技术局限性,作者利用PacBio单分子实时(SMRT) 测序获得了从 P. tetrastichus组织中分离的RNA的全长互补DNA(cDNA)序列,从而生成参考转录组,然后对多个植物组织进行转录组测序。
2.转录组分析——哌啶基-酮化物中间体合成基因发现
植物中杂环亚胺的产生,例如石松生物碱的 1-哌啶前体,涉及 Lys/Orn 氨基酸的脱羧,然后是所得多胺的氧化,这两者几乎是植物中常见的代谢过程。赖氨酸脱羧酶 (LDC) 酶和铜胺氧化酶(CAO) 是该途径早期步骤的基因,作者进一步研究LDC和CAO基因的代谢机制。
通过转录组数据的分析,作者发现了两个LDC 同源基因(PtLDC-1和PtLDC-2)(图 2C)和两个CAO基因(PtCAO-1和PtCAO-2),并且发现PtCAO基因与 PtLDC基因具有强烈共表达,说明它们参与了相同的代谢途径,可能与石松生物碱的生物合成相关。
为了验证PtLDC和PtCAO基因的功能,在烟草叶片中单独和共转化。然后通过液相色谱-质谱(LC-MS)分析叶提取物,以评估代谢物积累的变化。结果显示,两种 PtLDC 同源基因都显著升高了尸胺水平(图 3)。PtCAO同源基因与PtLDC同源基因的共表达导致生成的尸胺消耗和1-哌啶二聚体和三聚体的产生(图3)。并且发现同源基因的功能是冗余的,因此在所有后续实验中使用PtLDC-2和PtCAO-1产生1-哌啶聚合物。
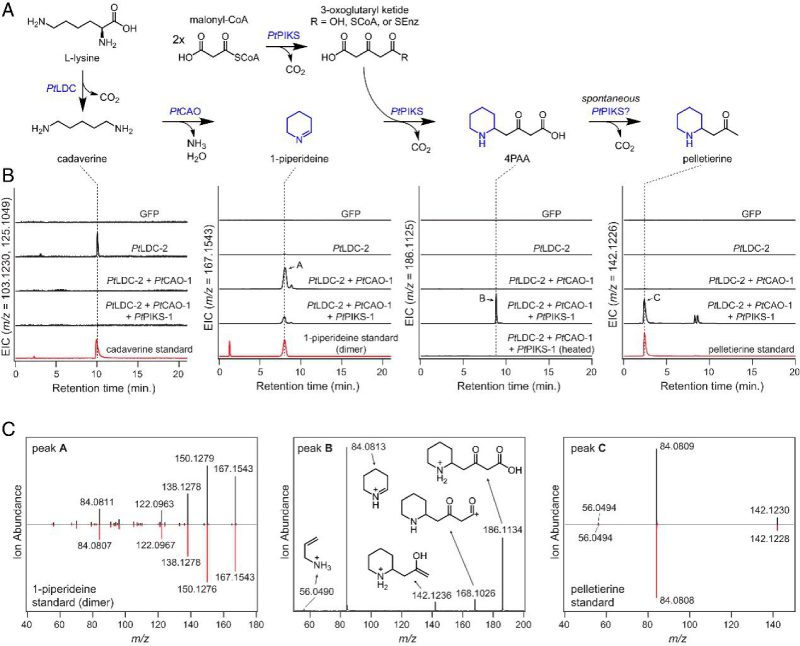
图3 一种用于1-piperideine生物合成的重组途径
3.转录组学分析——石松生物碱生物合成中形成 4PAA 和 peletierine 关键酶基因发现
接下来,推测通过向 1-哌啶聚合物中添加丙二酰辅酶 A 衍生的聚酮链以产生 4-(2-哌啶基)乙酰乙酸(4PAA),该酸可以脱羧产生peletierine(图 1B)。聚酮底物的产生表明聚酮合酶(PKS)酶参与催化这种亚胺-酮缩合反应,并在石松生物碱的生物合成中起作用。进一步分析揭示了两个PKS候选基因(PtPIKS-1和PtPIKS-2),与PtLDC-1共表达基因之一(图2C)。PtPIKS-1 PtPIKS-2与PtLDC-2 和PtCAO-1在烟草叶片中的瞬时共表达导致1-哌啶代谢物的消耗和几种新化合物的产生。其中一种化合物具有与假定的石松生物碱前体peletierine相对应的精确质量数 ([M+H]=m/z
142.1226),并通过与合成标准品的比较来验证这一点(图 3)。此外,作者观察到与4PAA质量数相同的化合物的产生([M+H]=m/z 186.1125),其结构分配由串联质谱(MS/MS)碎裂支持(图3)。作者认为 4PAA(一种β酮酸)的自发脱羧会导致pelletierine的产生,烟草实验也验证这一点(图 3)。综上所述,PtPIKS-1和PtPIKS-2可能是石松生物碱生物合成中形成 4PAA 和peletierine的关键酶。
为了更好地了解这种亚胺-酮缩合的机制,获得了两种PtPIKS同源基因的纯化蛋白用于体外分析。与我们在本式烟草中的结果一致,当添加 1-哌啶和丙二酰辅酶 A 作为底物时,PtPIKS-1和PtPIKS-2在体外测定中都产生了4PAA和pelletierine(图4 A和B),此外还有其他几种未知化合物。虽然当单独孵育 1-哌啶作为底物时没有观察到明显的产物,但仅向PtPIKS-1添加丙二酰辅酶 A 会导致 3-氧代戊二酸的积累(图 4 C 和 D)。3-氧代戊二酸的积累表明,PIKS能够催化两个丙二酰辅酶A单元缩合成硫酯连接的3-氧代谷氨酰基团,并且该聚酮酸从硫酯键上酶促或非酶水解。
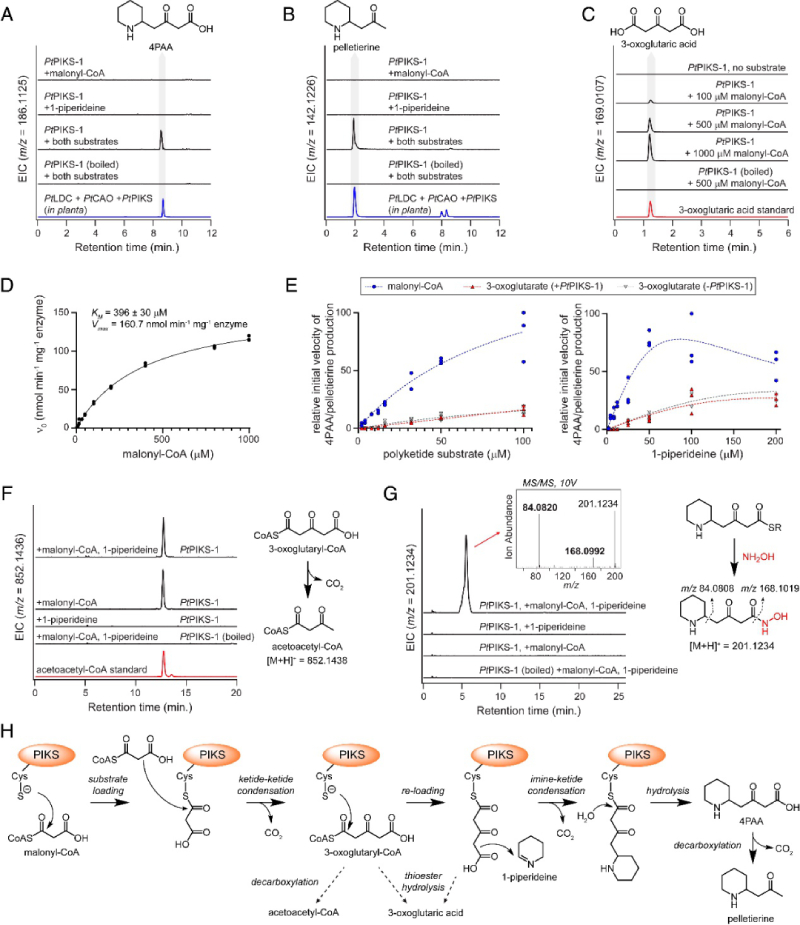
图4 PtPIKS催化的亚胺-酮缩合反应的体外分析
4.代谢组学分析——石松生物碱生物合成中代谢物合成机制
研究报道指出,在石松属和托烷生物碱生物合成中观察到的亚胺-酮缩合是通过 3-氧代戊二酸与环亚胺共底物的非酶促脱羧缩合发生的。尽管这种非酶缩合是可能的,但作者想进一步评估3-氧代戊二酸作为生物合成中间体的相关性。为此,比较了在含有PtPIKS-1的体外反应中将3-氧代戊二酸或丙二酰辅酶A与1-哌啶配对时 4PAA/peletierine生产的反应速率。虽然观察到1-哌啶和3-氧代戊二酸在低水平下自发缩合,但当丙二酰辅酶A作为与1-哌啶的共底物时,产物形成速率显着增加(图4E)。此外,在测量的底物浓度(2至200μM,图4E),而丙二酰辅酶 A 和 1-哌啶之间的缩合显然是酶依赖性的(图4A和B)。因此,虽然1-哌啶和3-氧代戊二酸之间的自发缩合可以在低水平下发生,但这些数据支持一个model,其中PIKS催化的缩合发生在1-哌啶和源自丙二酰辅酶A的聚酮硫酯之间。为了支持这一结论,当丙二酰辅酶A作为PtPIKS-1的底物在体外被纳入时,可以检测到累积的乙酰乙酰辅酶A(图4F)。乙酰乙酰辅酶A的积累虽然是间接的,但表明会产生一种3-氧代戊二酰辅酶A代谢物,该代谢物会迅速发生脱羧。作者无法直接检测3-氧代戊二酰辅酶A,并推测这是由于这种中间体的瞬时、不稳定性质所致。有趣的是,乙酰乙酰辅酶A与1-哌啶发生酶非依赖性缩合,产生peletierine。然而,这种缩合不会产生4PAA,因此其在石松生物碱生物合成中的相关性尚不清楚。
通过LC-MS分析无法检测到与4PAA-CoA硫酯有关的代谢物。因此,作者考虑了将 3-氧代谷二酰基部分重新加载到PtPIKS催化的半胱氨酸上之后发生亚胺-酮缩合的可能性。为了研究是否存在与PtPIKS-1的催化半胱氨酸结合的任何酰基中间体,作者用羟胺处理体外酶促反应,羟胺已被用于捕获硫酯中间体作为相应的异羟肟酸衍生物。当丙二酰辅酶A和1-哌啶作为底物时,作者注意到与4PAA的异羟肟酸相对应的质量的羟胺([M+H]=m/z201.1234,图4G)。这一观察结果,以及无法检测到 4PAA-CoA代谢物,表明存在瞬时酶结合的4PAA硫酯。
总的来说,这些数据支持了这种亚胺-酮缩合的暂定机制(图4H):
1) 将丙二酰辅酶A加载到PIKS的催化半胱氨酸上;
2)第二个丙二酰辅酶A与酶结合的丙二酰基的克莱森缩合,从而形成3-氧代戊二酰辅酶A;
3)将3-氧代谷氨酰基部分重新加载到酶上;
4)酶结合的聚酮与1-哌啶的脱羧缩合,产生酶结合的4PAA;
5)硫酯水解生成4PAA,在温和条件下可自发脱羧生成pelletierine。
虽然需要更多的实验来揭示该反应的精确事件顺序和机理细节,但这些数据证明了PIKS在催化石松生物碱生物合成中的亚胺-酮缩合中的关键作用。
5.代谢组学分析——HupB的后期氧化反应
目前研究尚未证实 HupA 生物合成中的任何下游中间体,但从各种苔藓物种中分离生物碱可能与两个含8碳哌啶的亚基掺入石松生物碱的生物合成相关(图 1B)。但是详细的代谢合成机制还不清楚。作者通过与4PAA/peletierine生物合成的 3 个高度共表达基因分析,作者发现了富集最显著的一类酶:Fe(II)/2-氧代戊二酸依赖性双加氧酶(2OGDs)(图2B,C)。作者将这些高度共表达的2OGD作为下游石松生物碱代谢途径中的强候选基因。
与 HupA 天然共存的多种石松生物碱,包括石杉碱B(HupB)和石杉碱C (HupC),推测是其生产的逻辑途径中间体,因此可能是潜在的前体(图 1B)。尽管这些分子之前都没有被验证为HupA前体,但在P. tetrastichus的新生长组织中都可以检测到HupB和HupC,支持了它们作为植物中潜在代谢中间体的结论。HupB的转化需要C环哌啶部分的氧化裂解(图1B)。因此,作者推测2OGD 以及细胞色素P450(CYP)和含黄素的单加氧酶(FMO)参与催化合成HupB。根据与PtLDC、PtCAO和PtPIKS基因的高共表达基因作为上述基因家族的候选基因,然后通过体外表达候选基因验证酶的活性功能。结果显示,一种 2OGD酶(Pt2OGD-1) 消耗HupB并产生HupC,而第二个2OGD(Pt2OGD-2) 消耗HupC产生 HupA (图5)。综上所述,一对2OGD酶负责通过逐步氧化环裂解和中性双键异构化的氧化还原在石松生物碱生物合成中将HupB转化为HupA。此外,之前的研究报道HupB 和HupC在生产HupA的植物中一直存在,但它们在HupA生物合成中的途径尚未研究,因此作者的研究结果证明了它们在该途径中的中间体作用。
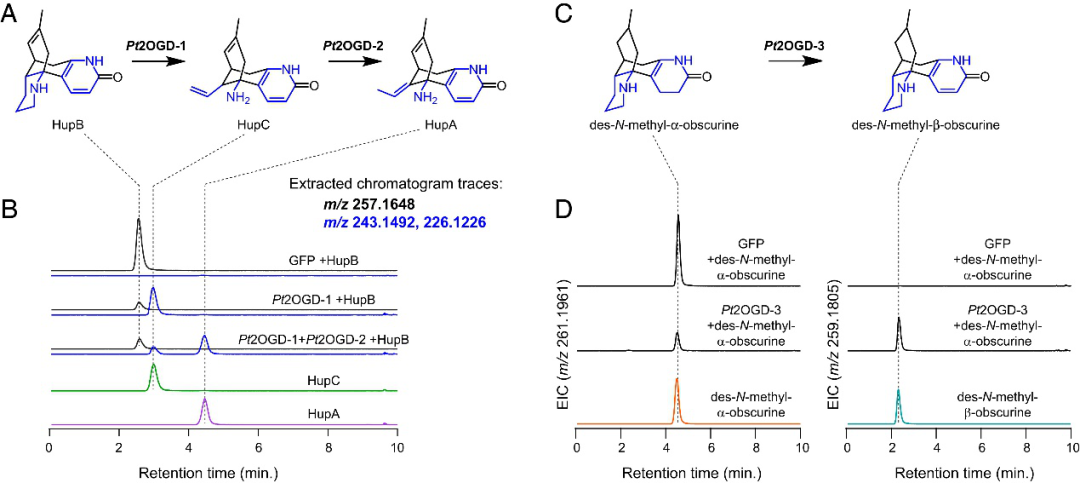
图5 三种 2OGD 酶催化 HupA 生物合成中的关键转化
6. 代谢组分析——HupA生物合成途径下游基因的解析
为进一步研究其他下游生物合成途径。特别是,两种石松生物碱,des-N-methyl-α-obscurine(DNMAO)和des-N-methyl-β-obscurine(DNMBO),与HupB共享相同的碳骨架,可能是HupB的前体(图 5)。因此作者通过与上述已知基因的高共表达分析及体外酶活验证实验发现另一种独特的2OGD酶(Pt2OGD-3)能将DNMAO转化为DNMBO(图5),从而形成最终在HupA中发现的吡啶酮环。并且发现Pt2OGD-1和Pt2OGD-2可以依次作用于DNMBO,以产生假定的HupC和HupA的8,15-二氢同系物。Pt2OGD-1不作用 DNMAO,表明在DNMBO和HupB中发现的吡啶酮环的存在对Pt2OGD-1底物结合和/或催化活性至关重要,但是参与其中的去饱和酶尚未被发现。
本研究中鉴定的所有三个2OGD均与已发现的PtLDC-1高度相关(图2C)。这些结果进一步说明了共表达分析可以作为鉴定石松生物碱生物合成调节基因的方法,并且这些鉴定的基因很可能在同一代谢途径中起作用。总体而言,通过联合使用代谢组学和转录组学分析,作者确定了石松生物碱代谢基因的紧密共表达模块,从而使我们能够在HupA的生物合成中发现几种生物合成酶(图6)。
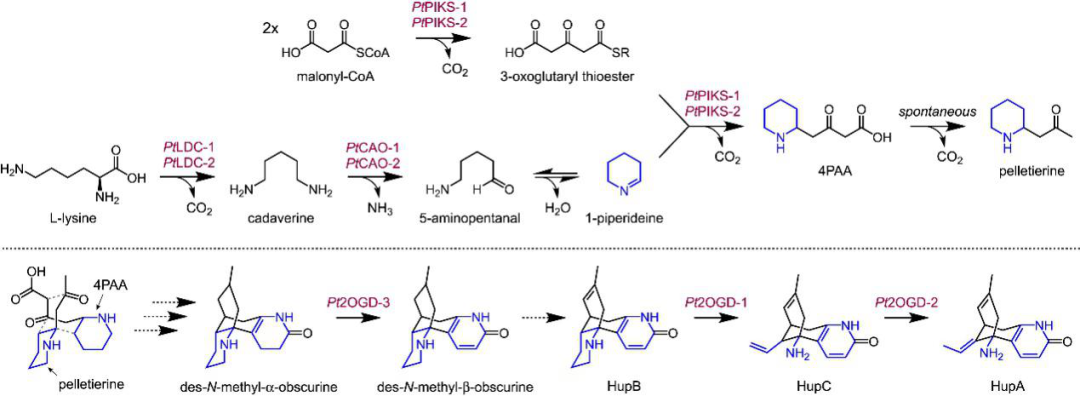
图6 表征的HupA生物合成反应的总结
研究总结
本研究揭示了新生长组织中的特异性代谢物生物合成活性以及转录组数据表明石松生物碱生物合成的发育控制。植物生物碱的组织和细胞特异性,并且在新生长组织中生物活性生物碱的产生可能增强了这些易感的新组织免受食草动物的侵害方面的抗性作用。石松科物种的生长缓慢和难以培养,因此通过解析石松生物碱合成途径,有助于在体外进行大规模代谢物生产。总的来说,对HupA生物合成的转录和生化基础的深入了解为未来对石松生物碱以及植物产生的许多其他神经活性脂肪族生物碱的研究提供了基础性的理解。






 京公网安备 11011302003368号
京公网安备 11011302003368号