
期刊名称:Plant Biotechnology Journal
影响因子:13.263
合作单位:海军军医大学
研究部位:丹参根、茎、叶、花
研究方法:代谢组学、体外酶活、分子对接等
研究背景
2024年1月16日,海军军医大学陈万生与张磊团队合作在植物学领域国际一流学术期刊《植物生物技术》Plant Biotechnology Journal发表一项最新研究成果,题为:Versatile CYP98A enzymes catalyse meta-hydroxylation reveals diversity of salvianolic acids biosynthesis。本研究以富含丹酚酸的代表性重要药用植物丹参为研究对象,阐明了丹酚酸生物合成的多样性,为CYP98A酶在间位羟基化反应中催化特异性的通用性提供了新的见解,同时也证明CYP98A酶是利用代谢工程策略提高丹酚酸含量的理想操作靶点。中药丹参为唇形科鼠尾草属植物丹参(Salvia miltiorrhiza Bge.)的干燥根和根茎,是我国常用中药。丹参药用历史悠久,始载于中国传统医药学典籍《神农本草经》,具有祛疲止痛、活血通经、清心除烦之功效。丹参作为复方丹参滴丸、复方丹参片、丹红注射液等药物的原料,广泛应用于心、脑血管疾病的治疗,丹参药材的年使用量超万吨,属于大宗常用中药材。丹参有效成分主要包括脂溶性的丹参酮类化合物和水溶性的丹酚酸类化合物。
实验材料
本研究中使用的是具有稳定的RA和SAB含量的S. miltiorrhiza f.alba,由中国科学院植物研究所赠送。
物质简称
丹参酸(SA)、迷迭香酸(RA)、丹参素(DSS)和丹酚酸B(SAB);迷迭香酸合酶(RAS)
研究结果
1.代谢组分析——验证唇形科和紫草科植物SA生物合成途径的喂养实验
丹参中酪氨酸衍生的途径从未被报道过,丹参素(DSS)是否参与SA生物合成仍然未知。SA的生物合成可能是多样化的,作者在同位素标记的喂养实验去验证这一结论。含有同位素标记的 L-苯丙氨酸和 L-酪氨酸浸润3个月大的丹参叶子中。从不同时间点收集的叶片中提取SA,并使用UPLC-Q-TOF/MS进行分析。结果显示,在p-CA、CA、4-HPL、DSS、SAB和RA及其前体(包括4C-4′-HPL、4C-3′、4′-DHPL和Ca-4′-HPL)均被检测出标记(图1b)。这些结果验证了作者的推测,即不同的酰基供体,包括4C-CoA和CA-CoA以及含有4-HPL和DSS的酰基受体参与SA的形成。SA的生物合成途径是多种多样的。
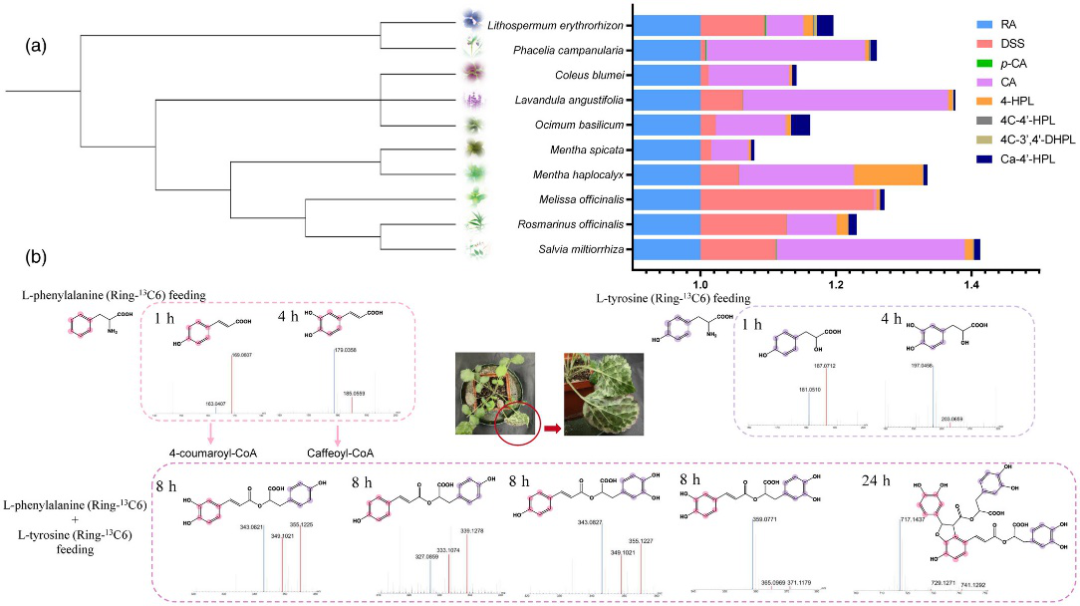
图1 通过同位素标记的摄食研究验证了SA的生物合成途径
2.基因分析——SmCYP98A酶在丹参中的特性
从SmCYP98A亚家族中鉴定出4种酶,分别是SmCYP98A75、SmCYP98A76、SmCYP98A77和SmCYP98A14。SmCYP98A家族酶能催化羟基肉桂酸酯的间羟基化形成RA,说明它们属于4-香豆酰酯3-羟化酶(C3H)家族。通过邻连接树(NJ树)分析,SmCYP98A酶与C3H之间的系统发育关系(图2a)。结果表明,SmCYP98A75与SmCYP98A14和CbCYP98A14具有更显著的序列同源性。而SmCYP98A77与其他CYP98A成员同源性较低。四种SmCYP98A 酶的氨基酸序列包含 P450 单加氧酶的几个特征基序,例如 PERF 基序、血红素结合半胱氨酸基序和含苏氨酸的结合口袋(图2b)。
为了分析4种SmCYP98A酶在丹参中的表达谱,收集了来自不同器官的组织,包括根、茎、叶和花。结果表明,两个基因均在所有器官中均有表达,且SmCYP98A75在花和叶中的表达水平较高,SmCYP98A76的在茎中表达较高,SmCYP98A7在花和叶中含量高,SmCYP98A14在根含量高(图2c)。SA主要在叶和根中积累,SmCYP98A酶在这两个器官中的高表达水平表明它们可能参与SA的生物合成。
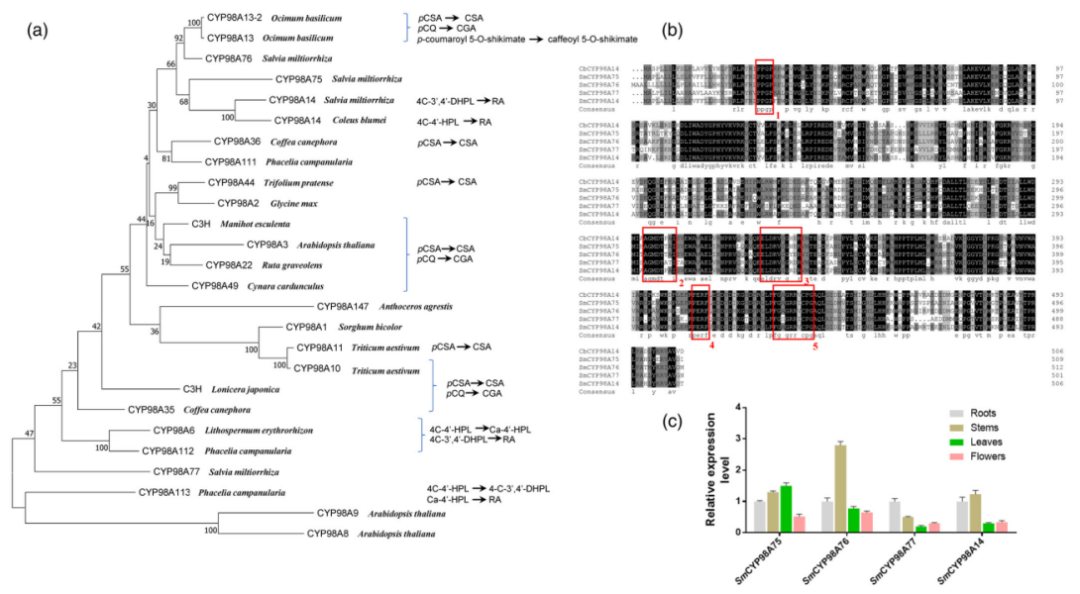
图2 SmCYP98A酶与CYP98A家族成员的序列分析、表达模式研究和系统发育分析
3.体外酶活实验——SmRAS催化RA形成的前体
在富含SA的植株中测定了4C-4′-HPL、4C-3′-DHPL和Ca-4′-HPL等几种酰基供体和受体及其酯形成产物,表明RAS可能在RA及其前体的形成中发挥关键作用。因此,作者接下来验证SmRAS在催化不同酰基供体和受体中的催化活性功能。体外异源表达SmRAS蛋白,并与酰基辅酶 A 供体(4C-CoA 和 Ca-CoA)和酰基受体底物(4-HPL 和 DSS)一起孵育,这些底物存在于丹参的迷迭香酸生物合成中。采用UPLC-Q-TOF/MS检测反应混合物,对产物进行分析。结果表明,SmRAS与4-HPL和DSS催化4C-CoA和Ca-CoA,形成4C-4′-HPL、4C-3′、4′-DHPL、Ca-4′-HPL和RA(图3a、d)。
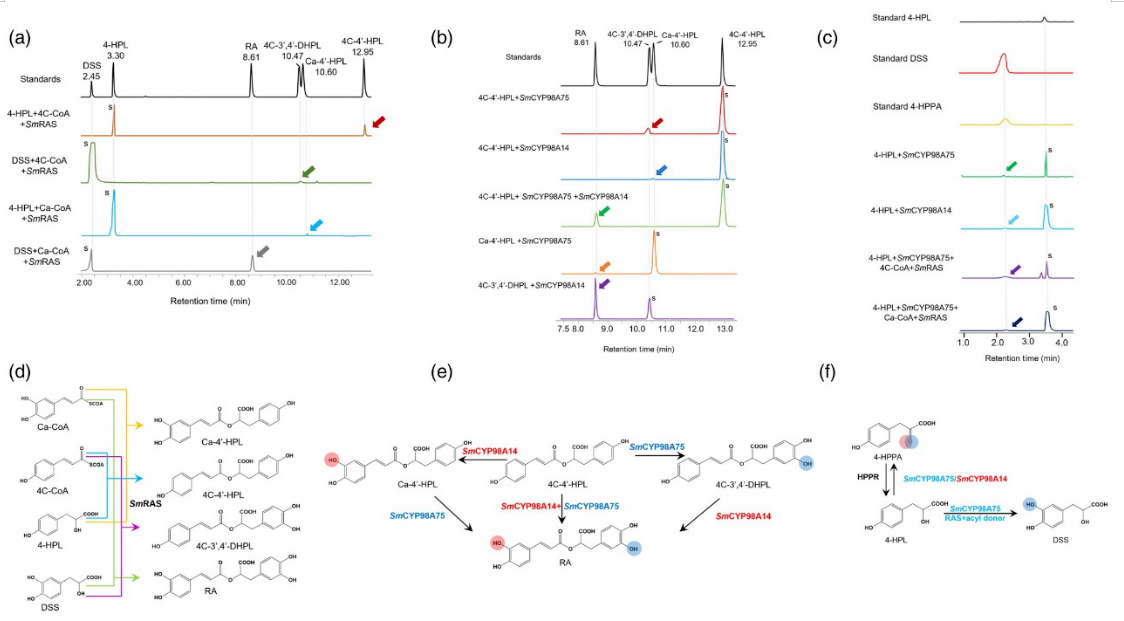
图3 SA生物合成中SmRAS和SmCYP98A酶催化反应的UPLC-Q-TOF/MS谱分析
4.体外酶活实验——SmCYP98A75和SmCYP98A14参与RA的生物合成
将SmCYP98A75、Sm CYP98A76、Sm CYP98A77 和 SmCYP98A14共转化到酵母中,对4C-4′-HPL、4C-3′,4′-DHPL和Ca-4′-HPL三种底物进行表征试验。使用UPLC-Q-TOF/MS分析产物。结果表明,SmCYP98A75可以将4C-4′-HPL转化为4C-3′,4′-DHPL和Ca-4′-HPL转化为RA,表明SmCYP98A75催化了酰基受体衍生酚环的C-3′羟基化。SmCYP98A14可以催化4C-4′-HPL为Ca-4′-HPL,4C-3′,4′-DHPL为RA,然而,它不能直接将4C-4′-HPL转化为RA,表明SmCYP98A14催化酰基供体芳香环的C-3羟基化。此外,当反应体系中存在SmCYP98A75和Sm CYP98A14时,4C-4′-HPL 被催化为RA,表明Sm CYP98A75和SmCYP98A14参与RA的生物合成(图 3b、e)。此外,SmCYP98A76和SmCYP98A77在上述催化反应中缺乏活性。
5.体外酶活实验——CYP98A75参与DSS的生物合成
上述研究表明SmCYP98A75负责RA生物合成中酰基受体部分的 C-3′羟基化,因此作者推测SmCYP98A 酶可能在丹参素DSS形成中发挥重要作用。体外酶活实验表明,当SmCYP98A75或SmCYP98A14与4-HPL一起孵育时,在产物中检测到4-HPPA,说明这两种酶表现出将4-HPL的侧链羟基直接氧化为酮的能力。然而,在两个反应系统中均未检测到DSS。作者认为植物内部生物合成环境是复杂的,包括许多代谢途径和催化酶,在反应体系中加入酰基供体和SmRAS,以模拟丹参的DSS生物合成。与SmRAS和4C-CoA或Ca-CoA孵育后,仅在SmCYP98A75催化的反应中产生DSS(图3c,f)。
6.转基因实验——SmCYP98A75和SmCYP98A14在丹参中的体内功能
为了进一步研究SmCYP98A75和SmCYP98A14在SA生物合成中的作用,作者利用CRISPR/Cas9技术生成了SmCYP98A75和SmCYP98A14单突变体和双突变体。纯合突变体用于分析SA积累(图4a,b)。与WT相比,突变体显示出更低的SA积累。SmCYP98A75 和SmCYP98A14 突变体的DSS、RA和SAB水平降低,尤其是SmCYP98A75突变体中几乎检测不到DSS。与WT相比,双突变体中DSS和RA几乎检测不到,表明CYP98A成员在SA生物合成中都起着重要作用(图4c-e)。进一步检测SA生物合成途径中关键酶的表达水平,包括SmPAL、SmC4H、Sm4CL、SmTAT、SmHPPR和SmRAS在突变体毛根中的表达。结果表明,与WT相比,SmCYP98A75 和SmCYP98A14单突变系和双突变系中SmPAL、SmC4H、SmTAT和SmRAS 的转录水平显著降低。
进一步超量表达SmCYP98A7 或SmCYP98A14基因。过表达材料表现出更高的SA、DSS、RA和SAB积累,表明这些酶可能参与了增加SA含量的代谢调节(图4f,g)。RT-qPCR验证了过表达材料中SmCYP98A75、SmCYP98A14和SA生物合成途径中关键酶的表达水平。结果显示,与WT相比,SmCYP98A75 和SmCYP98A14过表达材料中SmPAL、SmC4H、SmTAT 和SmRAS的转录水平显著升高。
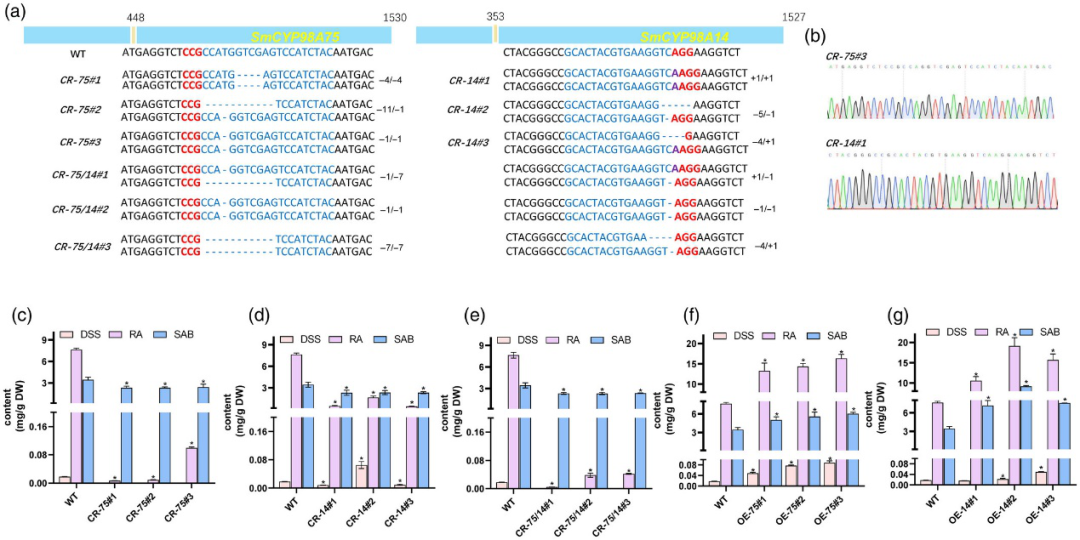
图4 从SmCYP98A75 和SmCYP98A14 敲除和过表达转基因毛根中测定SA含量
7.亚细胞定位分析——SmCYP98A75和SmCYP98A14的亚细胞定位
为研究SmCYP98A75和SmCYP98A14在亚细胞水平上的定位模式,构建了SmCYP98A75-GFP和SmCYP98A14-GFP融合蛋白,并在本式烟草叶片中瞬时表达。结果表明,在细胞膜和线粒体中观察到SmCYP98A75-GFP和SmCYP98A14-GFP融合蛋白的荧光信号,与CYP蛋白定位特征一致。此外,CbCYP98A14-GFP的定位模式与两种SmCYP98A酶一致。
8.基因结构与基因对接分析——SmCYP98A75和SmCYP98A14中的结构识别
SmCYP98A75和SmCYP9814底物特异性的差异为研究底物识别和代谢的结构特征提供了机会。使用在线SWISS-MODEL进行同源建模。SmCYP98A75和SmCYP98A14的整体结构模型高度相似,表明两种SmCYP98A的底物识别和代谢是保守的。SmCYP98A75的整体结构模型包含22个α螺旋和8个β链,SmCYP98A14的整体结构模型包含20个α螺旋和6个β链,与 SmCYP98A14 高度相似(图5a)。在结构模型中观察到血红素分子与两个 SmCYP98A 的活性结合口袋。通过与口袋内残基的多次相互作用,它被稳定在正确的位置。两种SmCYP98A和CbCYP98A14的血红素包围基序和关键催化氨基酸是高度保守的(图5b)。基于与已知 P450 的叠加,通道 1 可能容纳底物进入和产物,而通道 2 可能使血红素能够进入水和质子。
SmCYP98A75和SmCYP98A14分别催化RA芳环的 C-3′和C-3羟基化。此外,DSS仅在SmCYP98A75的反应体系中检测到,而在SmCYP98A14的反应体系中未检测到。为了探究两种SmCYP98A选择性的潜在分子机制,进行了分子对接。观察到Ca-4′-HPL分子与SmCYP98A75的活性口袋结合。通过与口袋中的关键残基 His391、Glu224、Trp113 和 Ala300 的多次相互作用,将其稳定在正确的位置(图 5c)。SmCYP98A14活性口袋与4C-3′,4′-DHPL 分子结合,并通过与口袋中残基 Asp301、Thr302、Ala297、Ser100 和 Lys103 的多次相互作用稳定(图 5d)。在CYP的多序列比对中,具有关键残基的区域高度保守,这反过来表明这些区域与底物识别相关(图5e)。此外,Glu224(Sm CYP98A75)、Ser100 和 Lys103(SmCYP98A14)定位的两个关键基序被鉴定为底物选择和结合区域(SbC4H1 中的F/G 环)。SmCYP98A14和CbCYP98A14中两个关键基序的残基几乎相似,这表明这两种蛋白质可能具有相同的底物选择偏好(图 5e)。与残基Thr301、Ala 297、Trp113、Ala101等多次相互作用,稳定了SmCYP98A14活性口袋中的4C-4′-HPL和4C-3′,4′-DHPL分子。
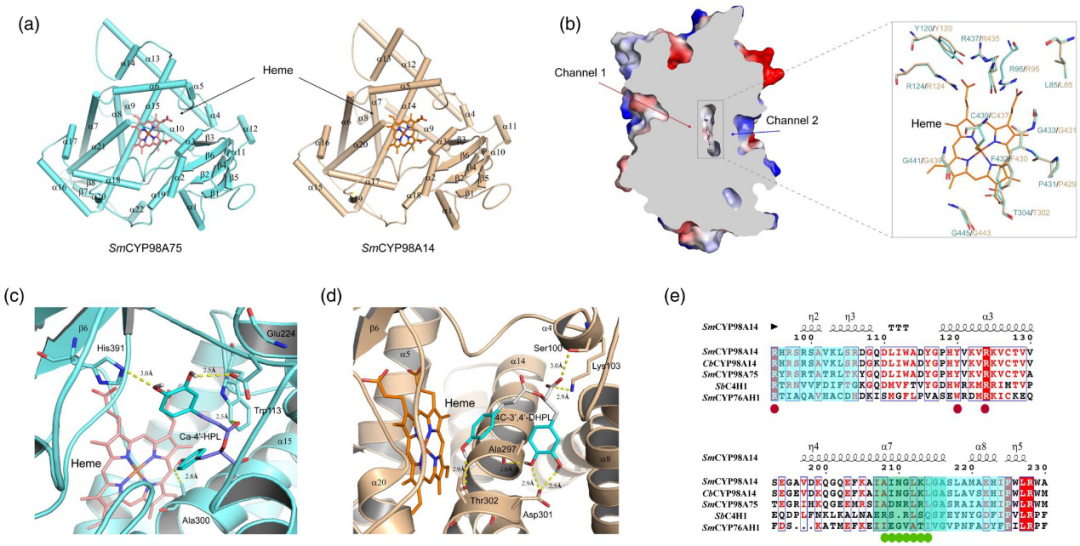
图5 SmCYP98A75和SmCYP98A14的结构分析
研究总结
在多种食品和医疗行业应用中显示出巨大的潜力,这推动了全球对SA一代的关注。SA的生物合成途径已在多个物种中报道,几乎所有研究都认为只有一个酰基供体和受体参与SA的形成。本研究研究强调,各种酰基供体和受体参与酯形成反应,CYP98A酶负责SA生物合成中的不同间羟基化。在这里,以S. miltiorrhiza为例,阐明SA生物合成的多样性(图6)。这些研究大大加深了对酚酸生物合成途径中SA的理解,并增强了我们克服具有多种药理活性的工程复合SA的合成生物学挑战的能力。
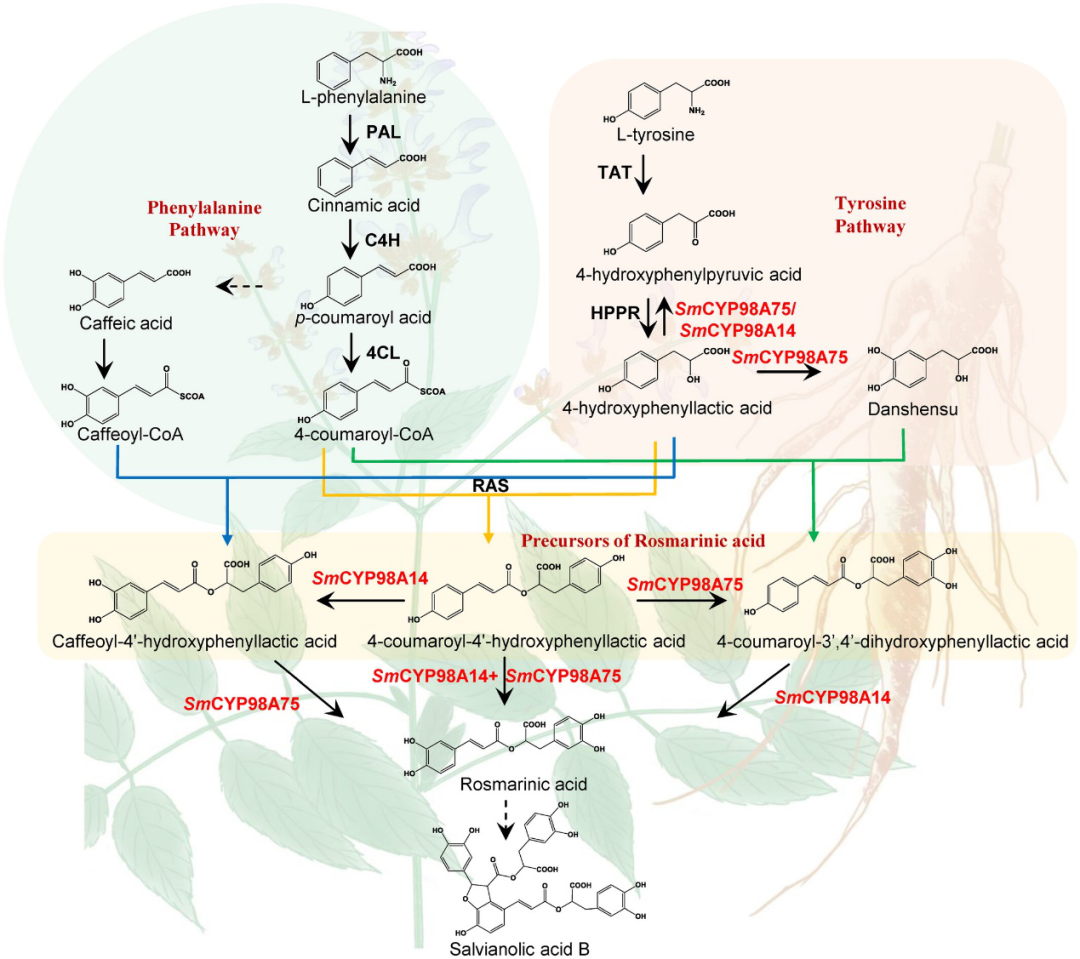
图6 SA在丹参中的生物合成途径







 京公网安备 11011302003368号
京公网安备 11011302003368号