导读
非酒精性脂肪性肝病(NAFLD)的3D基因组和基因组变异在很大程度上是未知的,尽管它们在细胞功能和生理过程中起着关键作用。在正常和NAFLD小鼠的肝脏上进行高通量染色体构象捕获(Hi-C)、ONT测序和rna测序(RNA-seq)测定。生成高分辨率3D染色质相互作用图,通过Hi-C检测不同的3D基因组层次结构,包括A/B区室、拓扑相关结构域(TADs)和染色质环,并检测结构变异(SVs)和拷贝数变异(CNVs)的全基因组测序。在正常和NAFLD小鼠间,发现了基因组中数千个区域在3D染色质组织和基因组重排方面的变化,并揭示了基因调节异常经常伴随这些变化。在NAFLD中发现了候选靶基因,受基因重排和空间组织破坏的影响。作者的数据为NAFLD研究提供了高分辨率的三维基因组相互作用资源,揭示了遗传重排、空间组织破坏和基因调控之间的关系,并确定了与NAFLD发病机制中这些变异相关的候选基因。这些新发现为NAFLD的发病机制提供了新的见解,并为NAFLD的治疗提供了新的概念框架。
背景介绍
非酒精性脂肪性肝病(NAFLD)是一种常见的慢性肝脏疾病,与肝脏脂肪堆积有关。鉴于NAFLD发病机制的复杂性,个体基因的变异并不能在疾病的发生中起决定性作用。全基因组分析和NAFLD候选基因的披露将提高对NAFLD病理生理学的理解。rna测序(RNA-seq)和全基因组测序(WGS)是目前广泛应用于深入了解疾病的技术。测序技术的重大进步使得RNA-seq和WGS在确定肝脏疾病的分子发病机制方面得以实现。ONT测序作为第三代测序方法,具有较高的测序通量和更长的读取长度,允许对整个基因组进行全面分析,并识别大量的结构变异(SVs)和拷贝数变异(CNVs)。ONT测序广泛应用于“组学”科学,如基因组学、表观基因组学和转录组学,以评估参与疾病过程的单个或多个基因的突变状态。sv通常存在于基因组中,但它们的功能影响往往难以捉摸。SV事件可能伴随着染色体三维(3D)结构的改变,破坏基因结构,导致疾病。
3D基因组的改变可能会影响许多关键的生物功能,它们与疾病发展的机制联系日益明显。在过去的几年里,已经进行了一些关于3D癌症基因组的研究。在一些肿瘤抑制基因中,包括但不限于磷酸酶和紧张素同源物(PTEN)、肿瘤蛋白p53 (TP53)、RB转录辅抑制因子1 (RB1)、notch受体1 (NOTCH1)和神经纤维蛋白1 (NF1),序列或启动子经常会因易位和反转而中断导致失活和随后的癌症发作和进展。这些技术的整合有可能弥合基因组结构和基因功能之间的差距,从而对NAFLD有更深入的了解。
材料方法
无NAFLD小鼠(对照组,C)和有NAFLD小鼠(模型组,M)的肝脏样本。
技术:Hi-C测序、ONT全基因组测序、RNA-seq、qPCR
结果
1、NAFLD小鼠肝脏转录组
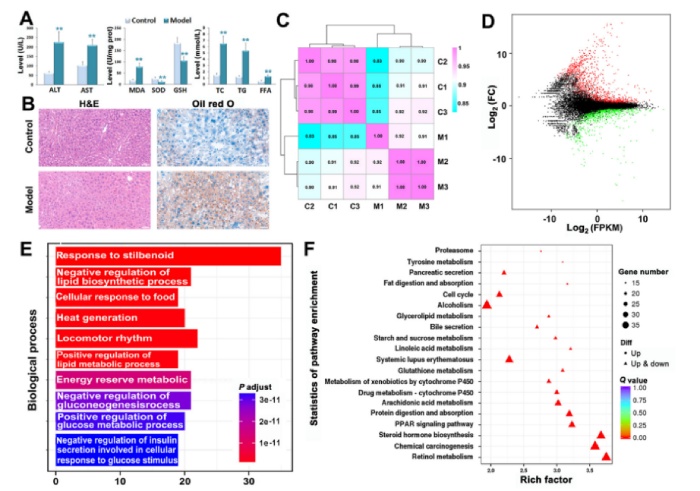
诱导小鼠发生NAFLD,结果显示血清ALT、AST、TC、TG、FFA水平显著升高;MDA、SOD和GSH水平的变化表明模型组小鼠肝脏的氧化应激状态(图1A)。通过H&E染色和油红O染色观察模型组肝组织病理改变和脂质堆积情况(图1B)。
肝脏样本的不同生物重复之间的高度相似性如图1C所示。考虑所有重复,通过FPKM分析鉴定了2163个差异表达基因。在差异表达基因中,2100个基因被用于研究,这些基因可被注释为差异表达基因(DEGs),包括1251个上调基因和849个下调基因在NAFLD小鼠中。利用GO和KEGG数据库对获得的差异表达基因进行富集分析,富集程度*高的前10个GO和前20个KEGG通路分别如图。这些结果表明在NAFLD肝脏转录组中存在很大比例的扰动,其中大多数与糖脂代谢相关的蛋白质编码基因失调。作者选择一个差异表达基因的子集进行qPCR验证所选基因的表达水平结果。
2、绘制三维染色质构象
为了获得三维染色质构象图,作者对肝脏样本的Hi-C文库进行了测序,每组总共获得超过477 Gb的数据。在去除PCR重复位点后,每个样本获得了超过8.02亿对有效Hi-C数据,测序深度为68.56%和68.96%,能够以10 kb分辨率检查C组和M组的相互作用。顺反式相互作用的比例显示,约四分之三的相互作用发生在染色体内,四分之一的相互作用发生在染色体间质(图2A)。,这个频率可以揭示染色体在基因组中的相互作用强度和染色体在细胞核中的相对位置。染色体之间的相互作用频率热图如图2C所示。通过热图颜色由对照组的蓝色变为NAFLD组的浅红色,可以发现染色体Chr2与Chr5之间相互作用频率的差异,提示NAFLD组两染色体之间距离较近,相互作用较强。相比之下,观察到的颜色从红色变为蓝色,表明NAFLD组染色体之间的空间距离更远,相互作用更弱,如Chr 7和Chr 11之间的相互作用。将各组的两个Hi-C库结合起来,进行对照组与模型组的对比分析。根据任意两个bin之间覆盖的Hi-C读对的归一化相互作用信号强度,绘制全基因组相互作用矩阵(图2D),染色体内相互作用矩阵如图所示。
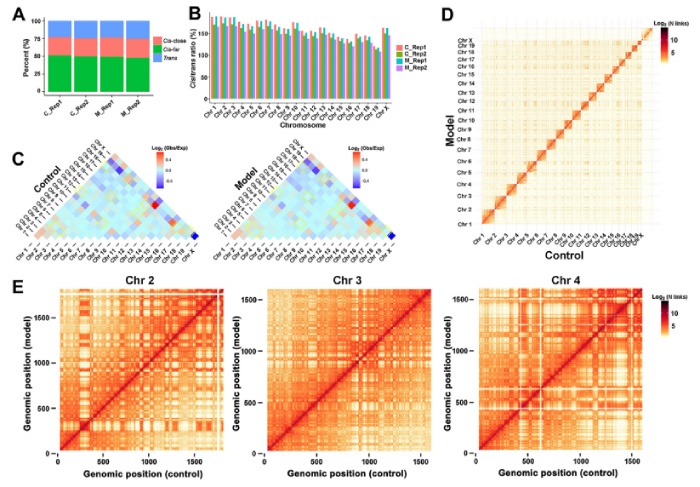
图2 用Hi-C绘制对照组和NAFLD组小鼠肝组织三维染色质构象图。(A)从对照组和NAFLD小鼠获得的Hi-C库中顺式和反式相互作用的分布比例。
3、NAFLD中A/B区和相关DEGs的变化鉴定
Hi-C生成的高分辨率资源可以在多个尺度上探索NAFLD肝细胞中任何基因组位点的物理环境变化,如A/B区室、TAD、染色质环等。通过PCA将染色质分离成A/B区,以了解NAFLD肝脏基因组中染色质相互作用模式的差异。每个样本染色体上A/B区室的分布如图3A。对照组肝脏基因组共鉴定出714个A区(42.93%)和722个B区(49.65%),NAFLD肝脏基因组共鉴定出819个A区(42.64%)和821个B区(49.92%)。正常和NAFLD条件下的区室高度相关,NAFLD诱导后仅2.34%的基因组发生切换(图3E)。A/B开关区在每个染色体中的分布如图3F所示。在所有染色体中共发生447次A/B室切换事件,其中226次A到B切换,221次B到A切换,Chr 9和Chr 13发生的室切换次数*多。将基因表达(RNA-seq)与HiC定义的A/B切换区进行比较,发现A/B区变化与基因表达之间存在相关性(图S4D)。通过筛选实验组之间与A/B室切换相关的38个DEGs,发现NAFLD组中B-A室DEGs上调94.12%,A-B室DEGs下调33.33%。作者筛选了16个与B-A室开关相关的上调deg和4个与A-B室开关相关的下调差异基因。
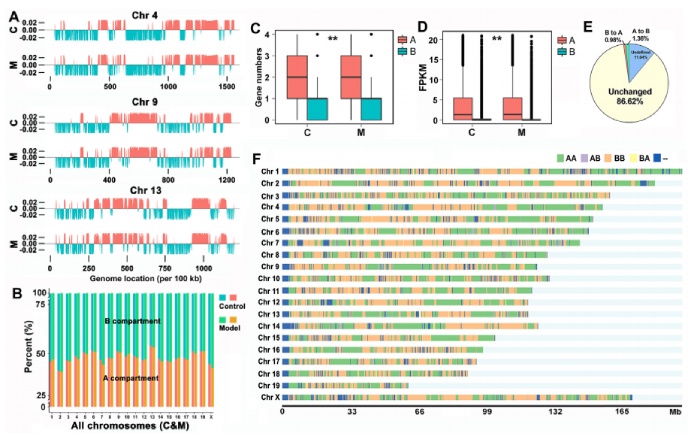
图3通过Hi-C和RNA-seq检测NAFLD小鼠肝脏A/B区及相关DEGs的变化。
4、鉴定TADs和相关deg的变化非酒精性脂肪肝
作者用TadLib软件在20kb分辨率下识别TADs。在对照组和模型组TAD比较中,作者在对照组中发现了8179个TAD,在NAFLD组中发现了7818个TAD,其TAD大小中位数为180 kb。TAD结构分析表明,TADs具有稳定的染色质结构特征。方向性指数(DI)衡量了给定感兴趣区域接触方向的不平衡46,并与TAD边界有关,TAD边界显示出从上游到下游DI的强烈转移特征(图4A)。作者在对照组和NAFLD中分别识别出9390和9246个TAD边界,其中538个为特殊控制边界,394个为模型组边界)。TADs在对照组和NAFLD组之间高度相关,只有大约5%的TAD边界在NAFLD发展过程中发生改变。TADs在基因表达调控中发挥重要作用,绘制了与差异TAD边界相关的DEGs,并分析了它们的数量。图4E所示为各组唯一TAD边界及两组不变边界相关的deg。NAFLD的基因表达受到TAD边界变化的影响,如图4F中红色阴影的染色体区域,以及图4F中蓝色阴影所示区域的交替。鉴定出42个上调基因和30个下调基因(支持信息图S5和表S11)。这些结果表明,由于与NAFLD发展相关的新的TAD边界的形成和消失,转录谱发生了改变。
5、染色质环及其相关变化的鉴定NAFLD中的DEGs
除了短程染色质相互作用外,3D基因组组织中的远程环带来了两个线性分离的位点之间的物理接近。作者通过Hi-C接触矩阵使用改进的HICCUP方法注释染色质环,分辨率为10 kb。结果显示,与NAFLD发展相关的环的总数减少(从39,670到38,469,图5A),而环的大小没有变化(环的中位数长度为70 kb,支持信息图S6A。每条染色体的环分布如图5B和C所示,Chr 1上的环分布*多,对照组和模型组分别有3193个和3099个环(图5B)。
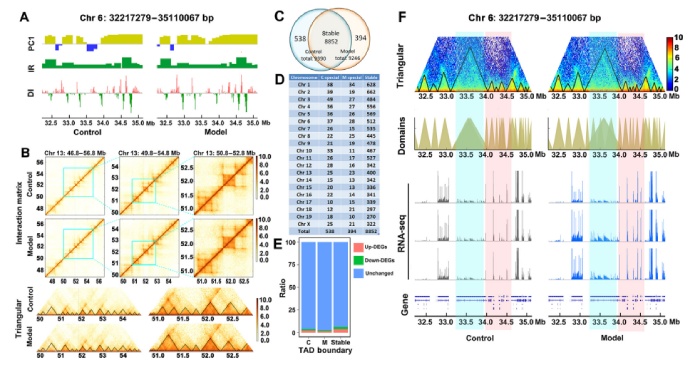
图4 Hi-C和RNA-seq检测NAFLD小鼠肝脏中TADs及受TADs影响的DEGs的变化
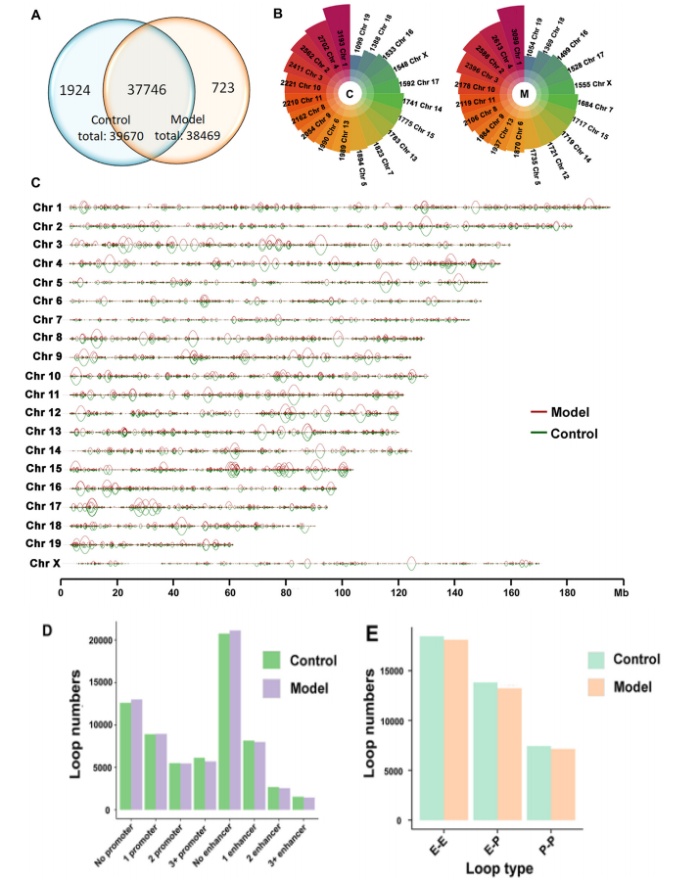
图5 Hi-C和RNA-seq检测NAFLD中染色质环及相关DEGs的变化
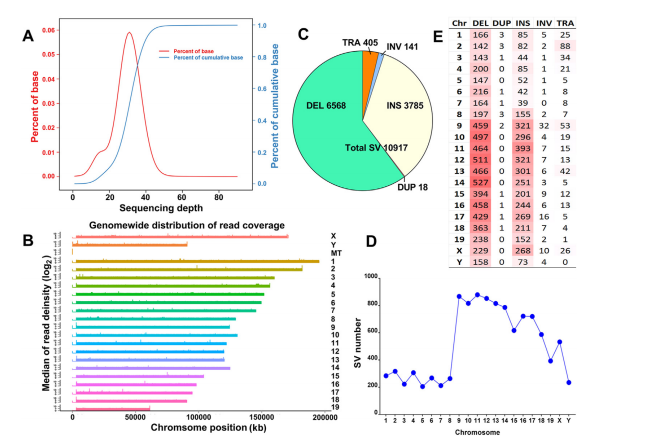
图6ONT测序鉴定的NAFLD结构变异(SV)变化。
经分析,与对照组相比,NAFLD组无启动子和增强子的环数增加,在增强子和启动子上有锚点的环数减少(图5D和E)。作者确认对照组有1924个特异性环,模型组有723个特异性环,FDR阈值为0.1(图5A和支持信息表S12)。结合RNA-seq数据研究了环变异与基因表达之间的关系,98个已映射的DEGs被染色质环变异调控,包括48个上调基因和50个下调基因。对这些环路影响的DEGs进行GO富集和KEGG分析,确定了参与新生脂肪形成的标志性基因,如酰基辅酶a去饱和酶1 (Scd1)和超长链脂肪酸蛋白6 (Elovl6)的延伸,它们在NAFLD中的表达下调。另一方面,在作者的研究中,形成异源二聚体并促进胆固醇流入胆汁47的atp结合盒亚家族G成员5和8 (Abcg5和Abcg8)以及在晚期NAFLD45中报道的Fgfr2的水平在NAFLD中上调。这些发现表明染色质环在NAFLD细胞代谢事件中的潜在作用。
6、通过ONT测序鉴定NAFLD中的SVs
ONT测序用于对NAFLD小鼠基因组变异进行测序。经过质量控制,从对照和模型样本(每组n z3个)中获得643.97 Gb清洁数据,平均清洁数据量为107.33 Gb。N50值为9.89 kb,读取的平均长度大于6.95 kb(支撑信息表S14)。根据参考基因组,每个样本的映射率均在99.04%以上。测序深度和读取覆盖率的分布显示了可接受的测序随机性(图6A和B,支持信息图。S7B和S8)。实验组中,有381个deg与差异sv重叠,其中与DEL重叠201个deg,与INS重叠99个deg,与INV重叠188个deg(辅助信息表S17)。基于基因功能,作者发现14个svv影响的DEGs参与脂质运输和代谢(Acaca、Acsl5、Cbr3、Ces1f、Ces1g、Cryl1、Dgka、Dgkb、Dgkk、Idi1、Nlgn1、Nlgn3、Sugct和Hao2), 8个svv影响的DEGs与能量产生和转换相关(Bckdhb、Me1、Hao2、Mt-co3、Mt-nd4、Nnt、Slc1a1和Slc1a2)。一些sv影响的DEGs与NAFLD相关,这些结果暗示SVs通过影响基因调控和染色质组织参与NAFLD的发展。
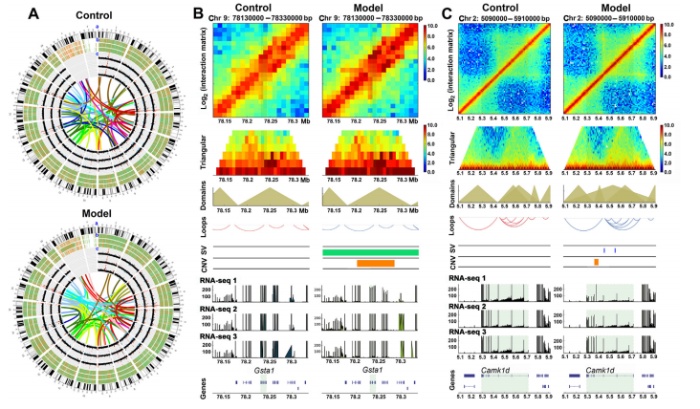
图7通过Hi-C、Nanopore、RNA测序综合分析,Gsta1和Camk1d为染色质结构重组引起NAFLD的候选致病基因。
7、通过ONT测序鉴定NAFLD中的CNVs
DNA片段的删除或复制导致拷贝数变异(CNVs),这是基因组中正常和致病变异的重要来源。每个样本中发现了大约150个CNVs,包括损失、增益和扩增。结合RNA-seq结果鉴定了对照组和NAFLD组之间的差异CNVs, 22个具有差异CNVs的deg(包括12个上调基因和10个下调基因)与NAFLD有关。在比较sv影响的DEGs时,同时鉴定出Cntnap2、Mrgpra2b、Hist1h4n、Hist1h2br、Hist1h2ao、Pde4b、Gsta1、Gm3776、Kcnh1和Camk1d中的CNV变异。在Gsta1位点发现CNV差异,在NAFLD组中表达增加。由此可见,NAFLD的基因调控机制与染色质微环境的差异有关。
8、NAFLD中染色质结构重组引起的致病基因候选
将Hi-C、Nanopore数据与NAFLD中的DEGs进行整合,并通过RNA-seq、Hi-C和Nanopore测序结果的综合分析筛选出所有受3D无序或重排影响的DEGs。与A/B区SVs、TAD、染色质环和/或CNV相关的DEGs。在基因本体注释中筛选出了与NAFLD发病机制相关的、存在基因组结构变异的DEGs作为潜在的候选基因,这些基因可能有助于NAFLD的发生。Elovl6下调与TAD和loop中3D结构的重组相关。Camk1d表达下调,并受到CNV和SV、染色质环、结构域和相互作用矩阵的改变的全面影响。这些结果表明了三维基因组层次结构各个层次的功能相关性,三维基因组的建立提供了多个调控层来改变NAFLD发展中的基因表达。
结论
1、NAFLD的肝损伤伴有基因表达的改变和肝脏转录组的潜在重塑。证据表明不同的3D基因组层次结构具有功能相关性,3D基因组组织提供了多个额外的调控层来控制基因表达。
2、TADs是染色体的基本单位,是保守于组织和物种之间的自我接触结构域。在NAFLD中,在绘制TADs图时,大多数TADs是保守的,然而大约5%的TAD边界在NAFLD诱导下被破坏。筛选到变化的TADs的DEGs,并观察到参与新生脂肪形成的标志基因Elovl6的下调与NAFLD的TAD变化有关。Plxnb1,一种肝脏肿瘤形成的抑制因子,在NAFLD中是taimpimpacted下调的DEG。
3、确定了两组之间染色质环的差异和98个与环变化相关的DEGs。受tad影响的基因Elovl6和Plxnb1也受到染色质环变化的影响。环挤压可能是导致TADs的一个机械方面。
考虑到以上因素,本研究采用了一种长读的ONT测序方法。作者鉴定了基因组中的所有SVs和cnv,并检索了与NAFLD中差异SVs和cnv相关的deg。确定了381个sv影响的和23个cnv影响的与NAFLD发展相关的DEGs, Camk1d、Pde4b和Gsta1基因的调控异常是由于sv和cnv在其位点上的存在。此外,包括Plce1、Plxnb1、Fgfr2、Grm8、Kcnma1和sugt在内的DEGs位点周围的基因组重排(SV或CNV)伴随着不同3D基因组层次结构的破坏。这表明在三维染色质构象、基因组和转录调控中存在共同的机制,并可能影响NAFLD的肝细胞表型。
展望
目前的工作有一些局限性。三维基因组在NAFLD核过程中的调控作用有待进一步阐明。未来需要进行基因组编辑研究,以确定打乱各种3D组织特征的功能后果,以阐明3D基因组破坏导致NAFLD的机制。此外,破译由组蛋白修饰、DNA甲基化和非编码rna介导的表观遗传机制的组合是√确定遗传重排和空间组织破坏所必需的,并可能揭示NAFLD的新机制和确定新的治疗靶点。
如果您对该研究思路感兴趣,欢迎点击下方按钮联系我们,我们将免费为您设计文章思路方案










 京公网安备 11011302003368号
京公网安备 11011302003368号