ATAC-seq+RNA-seq联合分析,可以获得ATAC检测到的染色质高度可及性区域与对应转录本表达的相关性,以及对应转录本相关基因的上游调控序列,构建TF结合后的基因表达调控机制,从而整体分析该特定时空下从DNA到RNA的调控网络,并且相互验证,进一步结合基因功能分析、实验表型进行讨论,清晰展现从表观调控——基因表达——基因功能——表型的生物学过程。百迈客拥有完善的ATAC-seq与转录组联合分析流程,云平台配套专业丰富的分析工具,轻松满足您的个性化分析需求!接下来,小编以一篇文献为例带领大家深刻认识ATAC-seq与转录组联合分析方案。
文章信息
中文标题:ATAC-seq+RNA-seq联合分析揭示了斜带石斑鱼性逆转过程中染色质的可及性
英文标题:Integration of ATAC-seq and RNA-seq Unravels Chromatin Accessibility during SexReversal in Orange-Spotted Grouper (Epinephelus coioides)
影响因子:6.208
期刊:International Journal of Molecular Sciences
研究目的
采用ATAC-seq和RNA-seq联合分析斜带石斑鱼(雌雄同体)性腺在性逆转过程中的开放染色质区域和TF结合位点,以探究斜带石斑鱼性逆转的分子机制。
研究亮点
- ATAC-seq+RNA-seq联合分析构建TFs及其靶基因的复杂网络、探索性逆转过程的潜在机制。
- 整体分析斜带石斑鱼性逆转过程中从DNA到RNA的调控网络,为斜带石斑鱼的基因组分析以及其他表观遗传学信息分析奠定基础资料。
- ATAC-seq+RNA-seq+实验验证,清晰展现从表观调控-基因表达-基因功能-表型的生物学过程。
研究背景
石斑鱼(Epinephelus)是雌雄同体的鱼类,在其生活史中经历了从雌性到雄性的性别变化,是研究性别分化和性别逆转的良好模型。斜带石斑鱼是亚洲重要的经济石斑鱼物种,其在自然条件下,于大约4-5龄时会改变性别。然而,斜带石斑鱼的性逆转的分子机制仍不清楚。以往的研究表明,许多转录因子,如sox(性别决定区Y-box)、wnt(无翅基因/整合基因)、dmrt(dsx和mab-3相关转录因子)和nanos,在性逆转过程中发挥着重要作用。然而,对性逆转过程中的转录变化仍缺乏全面的了解。
染色质结构在维持基因表达的调控中起着关键作用,可接近的染色质区域是转录因子(TFs)和顺式元件的结合位点。因此,来自这些开放区域的信息将增强我们对TF结合、染色质状态和基因表达调控之间关系的理解。ATAC-seq是2013年开发的一种新方法,已在许多研究中广泛应用于检测开放染色质区域。该文首次在斜带石斑鱼性逆转期间使用ATAC-seq对性腺的原始细胞核进行检测,揭示不同发育阶段染色质可及性的差异,以便从一个新的角度探索性逆转的机制。作者采用ATAC-seq与RNA-seq联合分析,以确定性逆转过程中几个途径中的TFs网络和核心基因。此外,在这一过程中还发现了一组与性别相关的基因。
研究方法
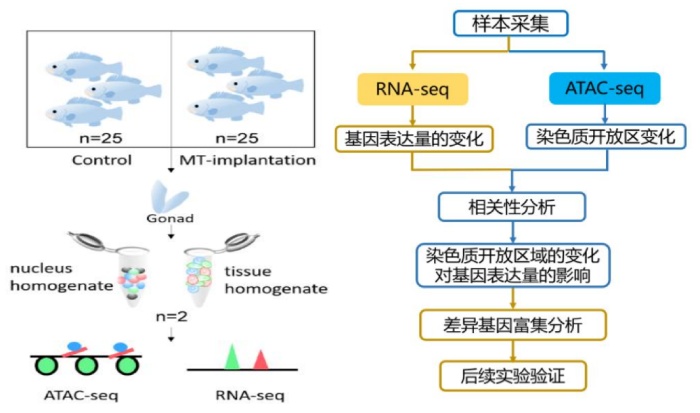
材料:斜带石斑鱼(体重1.90±0.65kg,体长43.75±9.25cm)分为两组,对照组(n=25)和MT植入组(10mg/kg;n=25)(广东大亚湾渔业发展中心),水池养殖(T:22.7–27.8◦C)。
实验方法:MT诱导的性逆转:在植入前(第0周),随机获得5条鱼的性腺以确定发育阶段。MT植入后,每周分别从两组中随机抽取5条鱼的性腺组织(每条鱼的性腺切成三部分),实验进行5周。性腺的增殖检测:免疫组织化学IHC分析;胞凋亡的检测:TUNEL分析;组织定量表达:RT-qPCR;基因定位:原位杂交ISH。
测序策略:ATAC+转录组
研究结果与分析
一、斜带石斑鱼的人工性别逆转以及性逆转过程中性腺的增殖检测和胞凋亡的检测
MT处理前,石斑鱼仍处于初级生长卵母细胞(PO)和皮质肺泡期卵母细胞(PVO)丰富的阶段(图1a)。在整个实验过程中,对照组石斑鱼的性腺也保持在同一阶段(图1b、d、f)。相反,MT植入组的石斑鱼从雌性变为雄性。在组织学上,MT植入后一周,性腺中的卵母细胞退化,新的生精囊肿增生,这被定义为性逆转的早期阶段(第1周;图1c)。植入后三周,性腺进入性逆转中期,其特征是大量精原细胞(SG)和精母细胞(SCs)以及数量有限的卵母细胞(第3周;图1e)。植入后5周,性腺进入性逆转后期,拥有大部分雄性生殖细胞,与自然睾丸相似(第5周;图1g)。
为了研究MT诱导的性逆转过程中性腺中的增殖信号,采用免疫组织化学(IHC)检测增殖细胞核抗原(PCNA)的表达。在对照组中,PCNA信号主要位于体细胞中(图2a)。在性逆转早期,在新发育的雄性生殖细胞中观察到PCNA阳性信号(图2b)。在性逆转中期,PCNA信号主要在男性生殖细胞中检测到(图2c)。在性逆转后期,仅在SG和SC中观察到信号(图2d)。此外,作者采用TdT介导的dUTP缺口末端标记(TUNEL)来检测卵母细胞的凋亡情况。结果表明,在正常卵巢中很难检测到TUNEL信号(图3a)。在性逆转的早期,在一些卵母细胞和体细胞中可以发现TUNEL阳性信号(图3b)。在性逆转中期,TUNEL阳性信号更强,仅在卵母细胞中观察到(图3c)。在性逆转后期,信号出现在几个细胞中,这些细胞可能是体细胞或假阳性信号(图3d)。以上结果表明斜带石斑鱼在人工性别逆转过程中,卵母细胞发生凋亡,而雄性生殖细胞则出现增殖。
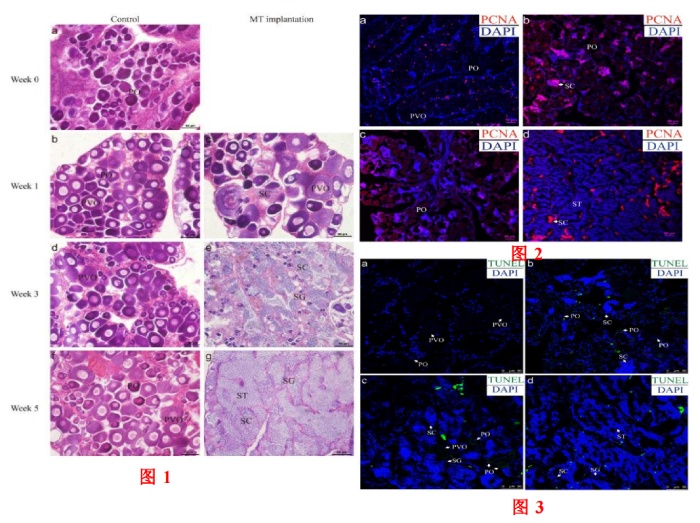 图1+2+3人工性别逆转以及性腺的增殖检测和胞凋亡的检测注:PO:初级生长期卵母细胞;PVO:皮质肺泡期卵母细胞;SG:精原细胞;SC:精母细胞;ST:精细胞。
图1+2+3人工性别逆转以及性腺的增殖检测和胞凋亡的检测注:PO:初级生长期卵母细胞;PVO:皮质肺泡期卵母细胞;SG:精原细胞;SC:精母细胞;ST:精细胞。
二、ATAC-seq和RNA-seq数据结果概述
作者联合ATAC-seq和RNA-seq研究斜带石斑鱼在性逆转过程中可获得的染色质、基因表达谱以及它们之间的关系。斜带石斑鱼性腺组织被分为三组:MT植入一周(中间组I)、MT植入后五周(睾丸组T)和未植入MT(对照组C)。ATAC-seq数据显示平均比对率为73.34%,每个样品有12.7百万个合格片段(图4b)。所有文库片段长度都如预期所示,包括大多数小片段(<200bp,为核小体间开放染色质)和逐渐减少的大片段(≥200bp,系跨越核小体的开放染色质)(图4c)。在ATAC-seq检测到的假定易接近区域中,超过50%位于转录起始点(TSS)上游2kb处,尤其是TSS上游1kb处的启动子,约32%位于远端基因间区域,其余18%位于基因体的内含子、外显子和基因下游(图4d)。此外,确定的可接近区域大多富集在TSS的2kb范围内(图4e),这与斜带石斑鱼这些区域中存在顺式调控元件(启动子、增强子、沉默子等)相一致。
研究发现ATAC-seq峰在几个性别相关基因附近高度富集。hsd17b7(羟基类固醇(17β)脱氢酶7)附近的峰值在睾丸组中显著富集,但在对照组和中间性组中未检测到(图5a)。ATAC分析发现在三个发育阶段的性腺中检测到4552个共同峰和无数特有的峰(图5b)。转录组分析显示在六个样本中检测到534个共有基因(图5c),组间比较结果显示:与中间性组相比,对照组中有1291个上调基因和7个下调基因;与睾丸组相比,对照组共检测到2888个上调基因和326个下调基因;与中间性组相比,睾丸组有984个上调基因和843个下调基因(图5d)。
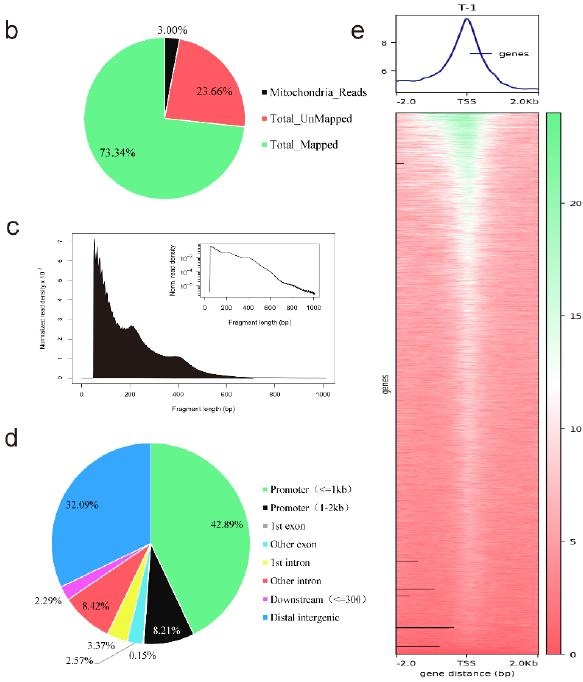
图 4 ATAC-seq 结果概述
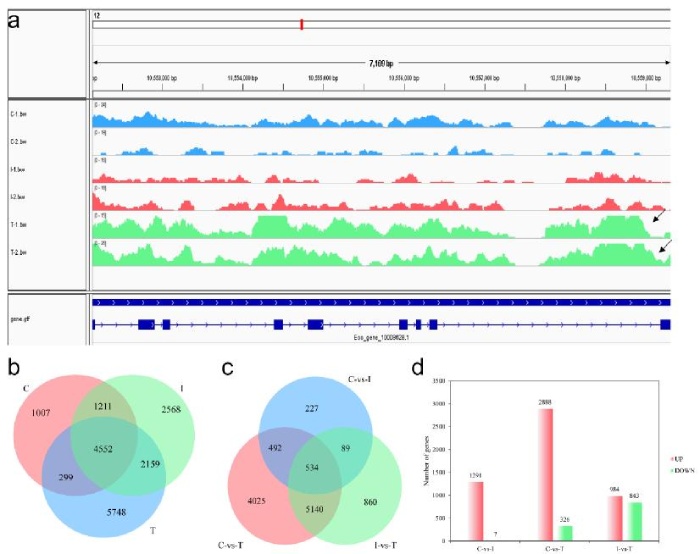
5ATAC-seq和RNA-seq图谱
三、差异可及区域中高度富集的已知基序及其靶基因
为了确定染色质可及性差异的潜在驱动因素,作者筛选出差异可及区域与组成性开放区域相比的前十个上调TF基序的富集情况,并列出了对照组与中间性组中前十个基序的富集和DNA序列(图6a)。其中,*丰富的基序是ZNF263(锌指蛋白263)、SPIB(转录因子)和RFX4(调节因子×4)。在可接近染色质区域聚集的ZNF263全位点附近检测到TF占用的相对清晰的足迹(图6b)。ZNF263与基本细胞过程相关,很少有研究确定ZNF263在生殖方面的作用。该研究结果表明,ZNF263在性逆转过程中调用了大量的性相关基因,暗示ZNF263可能通过对其靶基因的转录调控在性逆转中发挥重要作用。在*丰富基序的目标基因中,许多基因与性逆转相关,形成TF基因网络。研究发现许多TF结合基因参与细胞增殖、细胞分化和类固醇合成,包括zbtb16、dmrt1、sox11、star(类固醇生成急性调节蛋白)和hsd17b7。为了说明潜在的调控网络,作者在对照组和中间性组的比较中绘制了ZNF263、SPIB、ETV2及其靶基因的网络图(图6c)。
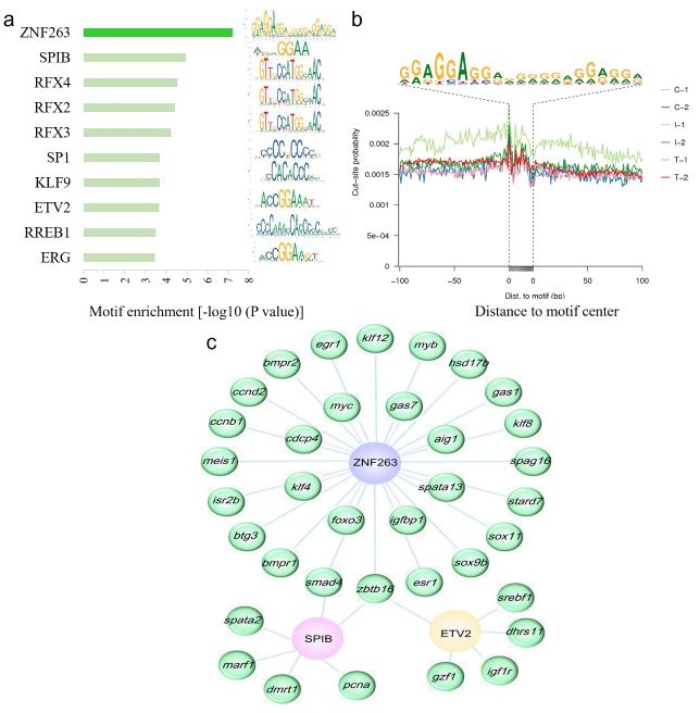
图6高度富集的已知基序及其靶基因
四、性别相关差异表达基因(DEG)的表达水平
研究发现已知的TFs基序以高度性别优先的方式富集(图7)。气泡图显示了与性逆转相关的30个DEG的富集和表达情况,这30个DEG对性腺发育和性调节至关重要,包括bmp15、cyp19a1、daz(l删除活力缺乏精子)、dnd、dmrt1-3、foxl2、nanos2-3、piwil1和sox9。此外,基序出现的时间与相应基因的表达一致。例如,MT植入5周后,dazl和dmrt2及他们结合的基序在性腺中强烈富集。研究还发现dnd、nanog、nanos3和SAL4在卵巢和雌性偏好的中间性腺中显著性表达,而dmrt1、gas8、piwil1和star的表达水平在睾丸中显著。

图7气泡图基于RNA-seqDEG的表达水平和ATAC-seq富集基序
五、RT-qPCR验证数据推断的DEG
在30个DEG中,对12个基因进行RT-qPCR,以验证转录组数据的可靠性,并分析性别逆转期间基因的表达模式。结果表明,这些基因的表达模式与转录组数据基本一致。卵巢中bmp15、dnd、gdf9和nanog的表达显著高于睾丸,并且在性逆转期间其表达逐渐降低(图8a、d、e、g)。睾丸中dmrt1、nr5a2、star(类固醇生成急性调节蛋白)、sox9(性别决定区Y-box9)和rergl(ras相关和雌激素调节生长抑制物样基因)的表达显著高于卵巢,尤其是MT植入后五周的性腺(图8b、f、j、k、l)。
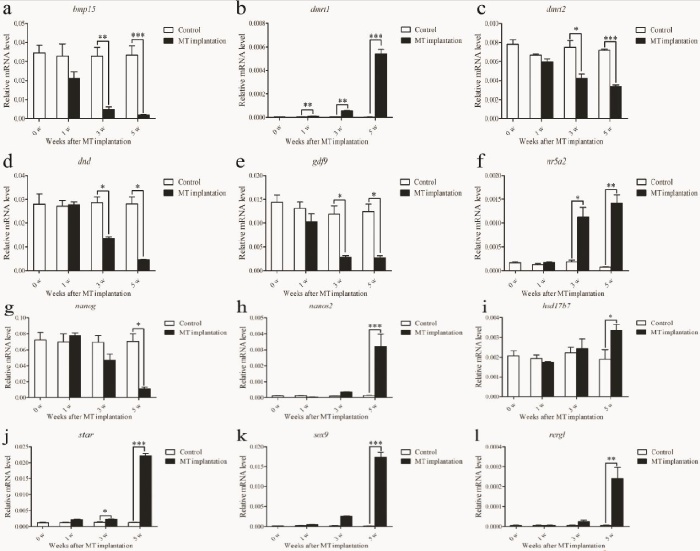
图 8 RT-qPCR 验证性逆转期间所选基因的表达
六、性相关基因的定位
用原位杂交(ISH)技术分析了不同性腺阶段性相关基因(dazl、Dmrt1、star、rergl)的定位。dazlmRNA仅限于斜带石斑鱼的雌性和雄性生殖细胞(卵母细胞、SG和SC)表达(图9a、b),结果表明dazl是一种生殖细胞标记物,在睾丸中高表达,这与其他物种中dazl的表达一致。在自然雌性的卵巢中未检测到Dmrt1信号(图9d)。性逆转后期的性腺有丰富的雄性生殖细胞SG、SC和ST,带有dmrt1阳性信号,而卵母细胞没有dmrt1信号(图9e),因此dmrt1可以被认为是斜带石斑鱼的生殖细胞标记。star作为合成类固醇激素途径中的限速酶,其在雄性斜带石斑鱼的睾丸中特异表达,而在卵母细胞中未检测到star信号(图9g)。此外,发现starmRNA在SG、SC和ST中表达(图9h)。rerglmRNA仅在雄性生殖细胞中检测到(图9j,k),这与RT-qPCR结果一致,暗示其在性别调节中的潜在作用。dazl、dmrt1、star和rergl的杂交探针作为对照实验显示性腺中没有信号(图9c、f、I、l)。
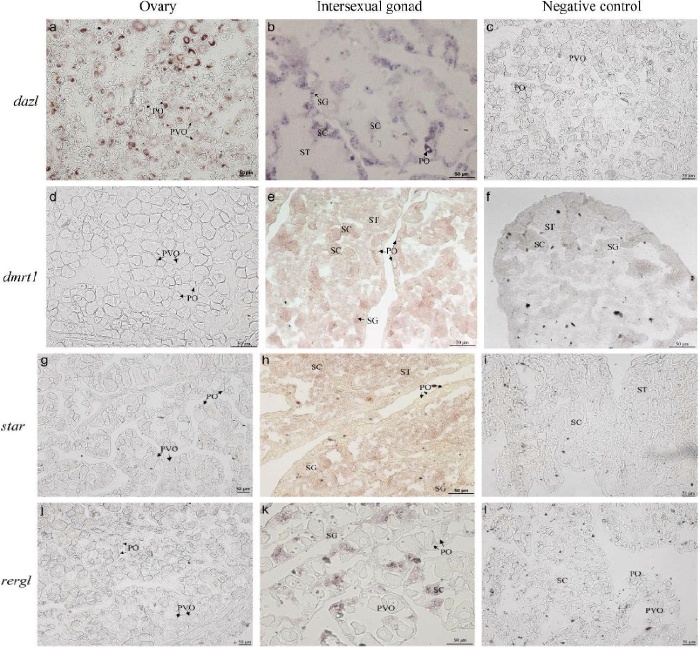
图 9 四个性相关基因的细胞定位
七、根据性逆转早期的RNA序列推断ATAC-seq的核心峰
分析ATAC-seq和RNA-seq的相关性,以探索转录活性的变化,并捕获性逆转早期的关键转录因子。图10a列出了前20个KEGG富集途径,如赖氨酸降解途径、肌动蛋白细胞骨架调节途径等。在雌激素信号通路中,对照组与中间性组相比有17个DEG,比如gnas、grb2、esr2(雌激素受体β)等。在这些基因中,我们在ATAC-seq的相同比较结果中只发现了gnas的峰值,它位于通路的上游。gnas的峰值由ZNF263调节,这表明gnas染色质的变化可能是触发该通路中下游基因差异表达的核心基因。在卵母细胞减数分裂途径中检测到13个DEGs,包括PKA、SMC1和PGR等,然而,在ATAC-seq数据中仅发现ccnb2峰。在人工性逆转过程中,参与类固醇激素生物合成的几种酶,如HSD17B1和CYP19A发生了显著变化。除CYP21A外,大多数DEG的表达均低于对照组(图10b)。CYP21A是将类固醇转化为皮质醇的关键酶,据报道,海葵鱼的皮质醇在性转变期间表达达到峰值,这表明皮质醇在性逆转中起作用。然而,本研究结果表明雌激素和雄激素的合成受到抑制,而在人工诱导的性逆转过程中,肾上腺皮质酮的合成上调,这为斜带石斑鱼的性逆转提供了新的见解。
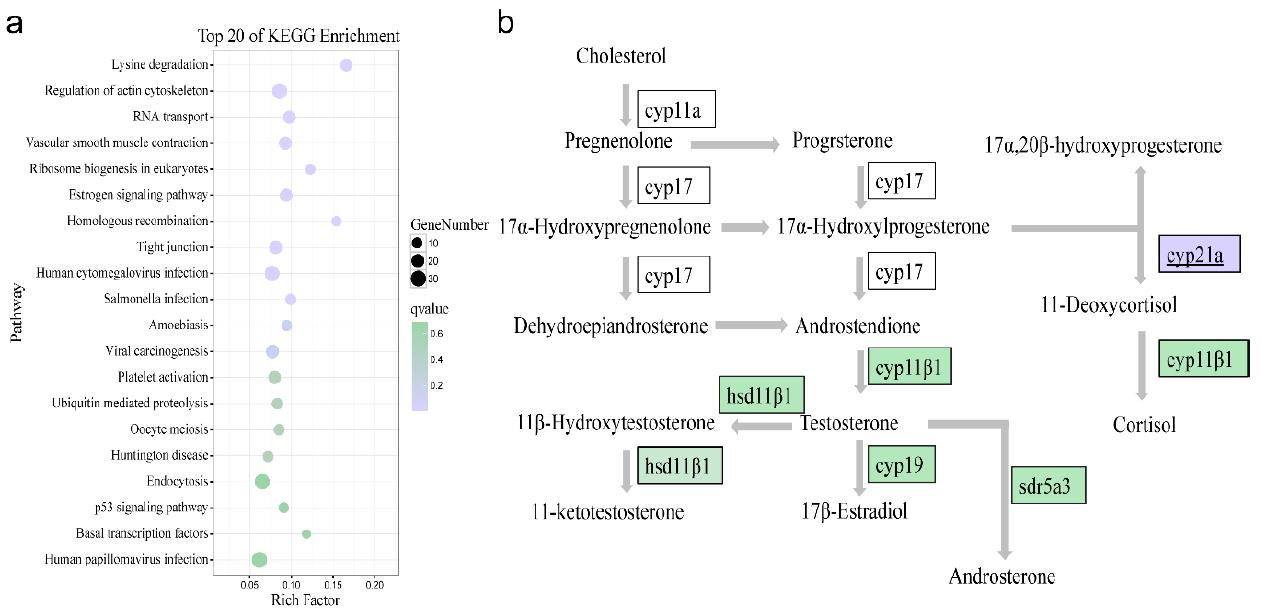
图10重要途径中的核心峰
总结
该研究首次采用高灵敏度的ATAC-seq方法对性逆转期间的斜带石斑鱼进行了开放性染色质分析。这项技术可以定位潜在的基因调控区域。通过ATAC-seq和RNA-seq联合分析,我们确定了许多不同发育阶的新的性别相关基因。对ATAC-seq鉴定的开放染色质区域的进一步挖掘揭示了重要TFs与下游基因的网络,以及染色质可及性的变化,这些变化可能在性逆转中起重要作用。本研究为今后的研究提供了重要的数据集和多种新的研究途径。
参看文献:
XiWu,YangYangandChaoyueZhongetal.,IntegrationofATAC-seqandRNA-seqUnravelsChromatinAccessibilityduringSexReversalinOrange-SpottedGrouper(Epinepheluscoioides)[J].Internationaljournalofmolecularsciences,2020,21(8):2800








 京公网安备 11011302003368号
京公网安备 11011302003368号