文章信息
英文名; Interaction Between the Intestinal Microbial Community and TranscriptomeProfile in Common Carp (Cyprinus carpio L.)
期刊:Frontiers in microbiology
影响因子:5.64
研究背景
近年来,肠道微生物对宿主生产性能的影响受到广泛关注。宿主的生产性能可以通过调节肠道微生物结构来调节,而肠道微生物结构又主要受遗传和饲料的影响。肠道微生物也能影响宿主的基因表达和甲基化水平。研究发现约 10%的宿主转录组受微生物调节,主要包括免疫、细胞增殖和代谢功能相关基因。肠道微生物与宿主基因表达之间的相互作用机制会影响饮食行为、消化过程、免疫功能和其他生理现象。一天中微生物的活动会改变宿主的生物节律、表观遗传学和代谢产物。当微生物群落内稳态的节律被破坏时,宿主的正常染色质和基因表达水平将发生变化,肠-肝轴基因表达的新机制将被激活。上述肠道菌群与宿主的相互作用主要通过脑和肝的远程控制模式实现。因此,作者运用转录组和微生物多样性联合分析来解析新黄河鲤品种的肠道微生物群通过调节肠道基因表达影响其生长性能的方式。本研究可以为黄河鲤新品种的选育提供参考。
研究目的
通过比较新鲤鱼品系第 4 代(实验组)和传统黄河鲤鱼(对照组)在收获时的生长性能、肠道细菌结构和转录组谱,探究基因表达水平与肠道细菌丰度之间的关系。
研究方法
材料:黄河鲤新品系(中国水产科学院淡水渔业研究中心)和传统黄河鲤,水池中单独喂养。
实验方法:生长性能测定:养殖 5 个月后,随机抽取 366 只黄河鲤(对照组 180只,实验组 186 只)。体重(hBwt)用电子秤测量(准确度:0.1 克),而体长(hBlen)、体宽(hBwid)和体高(hDep)用塑料尺测量(准确度 : 0.1 厘 米 )。 Student’ t 检 验 用 于 检 验 实 验 组 和 对 照 组 之 间 的 差 异(P<0.05)。
测序样品:养殖 5 个月后,随机各抽取 3 条鱼(饥饿 24 小时),将肠分为前肠、中肠和后肠段,并用镊子挤压将每个片段的内容物收集到无菌的 2ml 收集管中(DD4 指对照组样本,SS4 指实验组样本)。对应的同一样本肠道组织用于转录组测序(CT 指对照组样本,ST 指选择组样本)。
测序策略:16S rRNA 基因 V3-V4 区扩增子测序:Illumina MiSeq 平台,每组 3 个重复。RNA 测序:Illumina Hiseq 2500 平台,每组 3 个重复。
研究结果
肠道细菌群落结构与生长性能的关系
测量了黄河鲤新品四个生长性能参数(体重、长度、宽度和深度)(图 1)。对照组的所有参数均比对照组显著提高:重量 14.58%,深度7.14%,宽度 5.04%,长度 5.07%。
为了评估黄河鲤新品种的生长性能是否与其肠道菌群有关,将实验组和对照组在相似的生长环境中进行培养,并探讨其肠道细菌群落结构的差异。多样性分析结果显示实验组的平均 OTU 丰富度(322.80±67.87)高于对照组(303.00±53.00)。实验组和对照组共鉴定出 94 个共有的细菌类群(图 2B)。PCA 分析和系统发育树将所有样本分为两部分(图 2C,D),表明实验组和对照组是可明显区分的。因此,我们可以从其遗传亚种的选择性微生物群落结构特征来部分估计该新品种的肠道细菌结构。在属水平上对细菌组成(相对丰度)进行分析,结果表明气单胞菌(Aeromonas)是对照组的优势类群,其次是厚壁菌(Firmicutes)和玫 瑰 单 胞 菌 ( Roseomonas )( 图 2E ), 而 实 验 组 中 , 玫 瑰 单 胞 菌(Roseomonas)是优势类群,其次是厚壁菌(Firmicutes),然后是气单胞菌(Aeromonas)。结果表明这两个群体的细菌群落结构是不同的。这意味着宿主(黄河鲤鱼新品种)基因组与微生物组相互作用,以选择某些微生物类群,暗示肠道菌群组成会影响鲤鱼的生长性能。
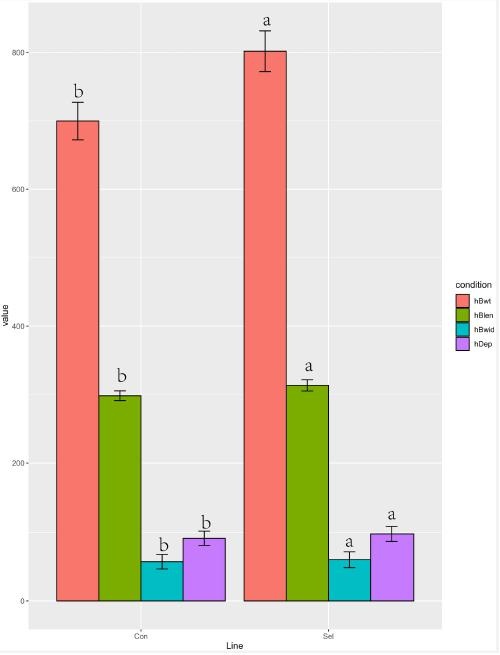
图 1 黄河鲤新品种与对照组生长性能比较
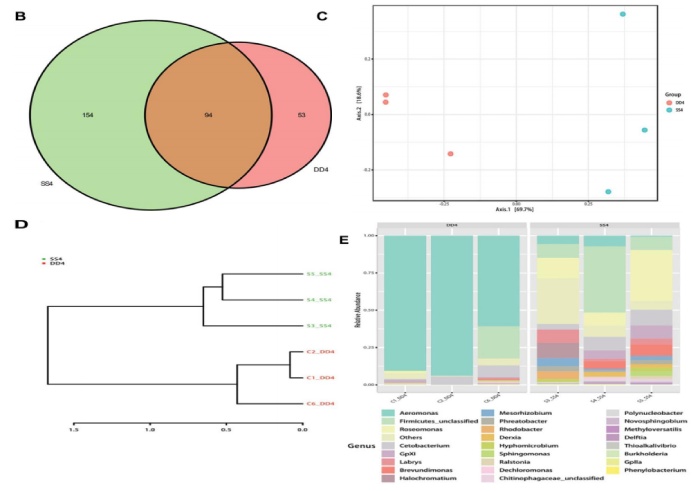
图 2 黄河鲤新品种与对照组的细菌组成分析
实验组和对照组之间的差异基因表达
使用与 16S 测序相同的样本对黄河鲤新品种(实验组)和对照组中的转录组进行测序并鉴定差异基因(DEG)。在 249 个显著 DEGs 中(如图 3A),194 个基因表达下调,55 个基因表达上调。通过 GO 注释,这些基因被分为以下功能类别:生物调节、细胞过程、解毒作用、发育过程、免疫系统进程等(都属于生物过程);细胞、细胞部分、胞外区域、胞外区域部分、大分子复合物等(细胞成分);抗氧化活性、结合活性、催化活性、分子功能调节器上等(分子功能)。聚类分析表明,实验组和对照组具有不同的特征,DEG 分为四个部分(图 3B)。这些基因的GO 注释包括生物学过程中的 13 个类别,细胞成分中的 8 类和分子功能类别中的 7 类(图 3C)。KEGG 注释将这些基因中的大部分分配到免疫相关途径(图 3D)。
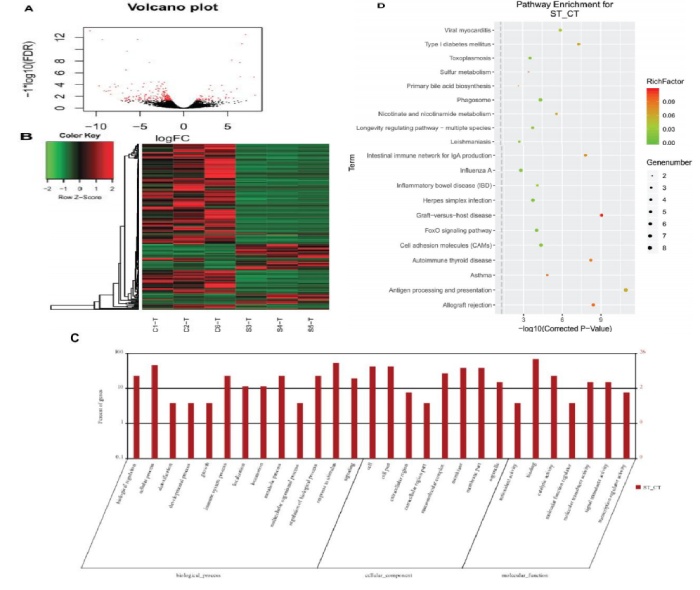
图 3 黄河鱼新品与对照组肠道转录组 DEGs 分析
与肠道细菌群落组成相关的差异表达基因
Pearson 相关性用于推断微生物属级群落组成与 DEGs 之间的关系(表 2),共探索了 2892 对,包括 245 个基因和 256 个属。图 4A 列出了与细菌群落具有属级关系的前 10 个候选基因。其中许多参与免疫反应,如 H-2 类组织相容性抗原、类 E-Sβ链(H2-Eb1)、类胸苷磷酸化酶(TYMP)、干扰素诱导蛋白 44(IFI44)和主要组织相容性复合物 I 类相关基因蛋白样(MR1)。其他已鉴定的基因具有广泛的功能。纤毛和图 3 黄河鱼新品与对照组肠道转录组 DEGs 分析鞭毛相关蛋白 54(Cfap54)是纤毛和鞭毛组装和功能所必需的。碳水化合物硫转移酶 14(Chst14)将硫酸盐转移到硫酸皮肤素中 N-乙酰半乳糖胺残基的 C-4 羟基中。DNA 修复蛋白 RAD51 同源物 4(Rad51d)、ETS 易位变异体 5、转录本变异体 X2(Etv5)和着丝粒蛋白 Spc24(Spc24)与细胞分化和生长性能相关。这些基因可能在黄河鲤鱼新品种更好的生长性能中发挥关键作用。总而言之,肠道细菌可以影响肠道中的基因表达,其中优势种或细菌结构可能反映宿主黄鲤鱼新品种的遗传特征。肠道的细菌-基因表达谱有助于宿主肠道的健康和性能。
通过与基因频率配对确定的前 10 个属为:Bordetella, Lutispora, Methylocystis,Ohtaekwangia,Roseomonas,Shewanella,GpVI,Desulfovibrio, Candidatus_Berkiella and Azorhizobium。其中,Methylocystis 数量最多,在甲烷循环中起作用。
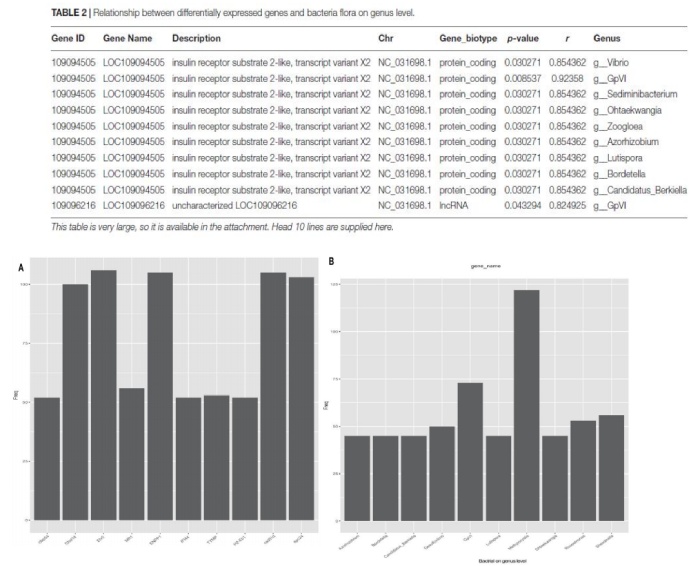
图 4 黄河鲤新品种和对照组 DEGs 与细菌(属水平)的关系
总结
该研究提出了肠道细菌群落与基因表达相互作用的证据。共探索了2892 对(属级基因和细菌),包括 245 个基因和 256 个属。作者发现大多数基因涉及免疫学、细菌群落和细胞分化,其中大多数位于免疫相关信号通路中。研究表明黄河鲤新菌株生长性能的改善可能与其免疫反应的改善及其在肠道细菌结构中的相互作用有关。
参考文献
Su S, Jing X, Zhang C, et al. Interaction Between the Intestinal MicrobialCommunity and Transcriptome Profile in Common Carp (Cyprinus carpio L.)[J]. Frontiers in Microbiology, 2021, 12.








 京公网安备 11011302003368号
京公网安备 11011302003368号