2022年8月,中国科学院国家纳米科学中心聂广军教授和赵潇教授团队在《Advanced Materials》(IF:32.086)发表了研究成果“Engineered Bacterial Outer Membrane Vesicles as Controllable Two-Way Adaptors to Activate Macrophage Phagocytosis for Improved Tumor Immunotherapy”,报道了纳米药物工程细菌外膜囊泡通过激活巨噬细胞刺激抗肿瘤免疫机制,百迈客生物为该研究提供了转录组测序分析服务。
文献研究背景
细菌衍生的外膜囊泡(OMV)是高免疫原性纳米囊泡,已经成为肿瘤免疫治疗常用的传递载体;巨噬细胞作为肿瘤微环境(TME)中的抗原递呈细胞,可以处理被吞噬的肿瘤细胞,并将肿瘤抗原呈递给T细胞,从而激活抗原特异性免疫反应,肿瘤细胞表现出CD47“don’t eat me”信号的高表达,阻碍了巨噬细胞的吞噬作用;肿瘤相关巨噬细胞(TAM)与免疫抑制性M2极化巨噬细胞非常相似,与肿瘤免疫逃逸和肿瘤进展有关,TAMs的jing q高效激活是一种非常有前景的肿瘤免疫治疗方法。
文献材料方法
材料设计
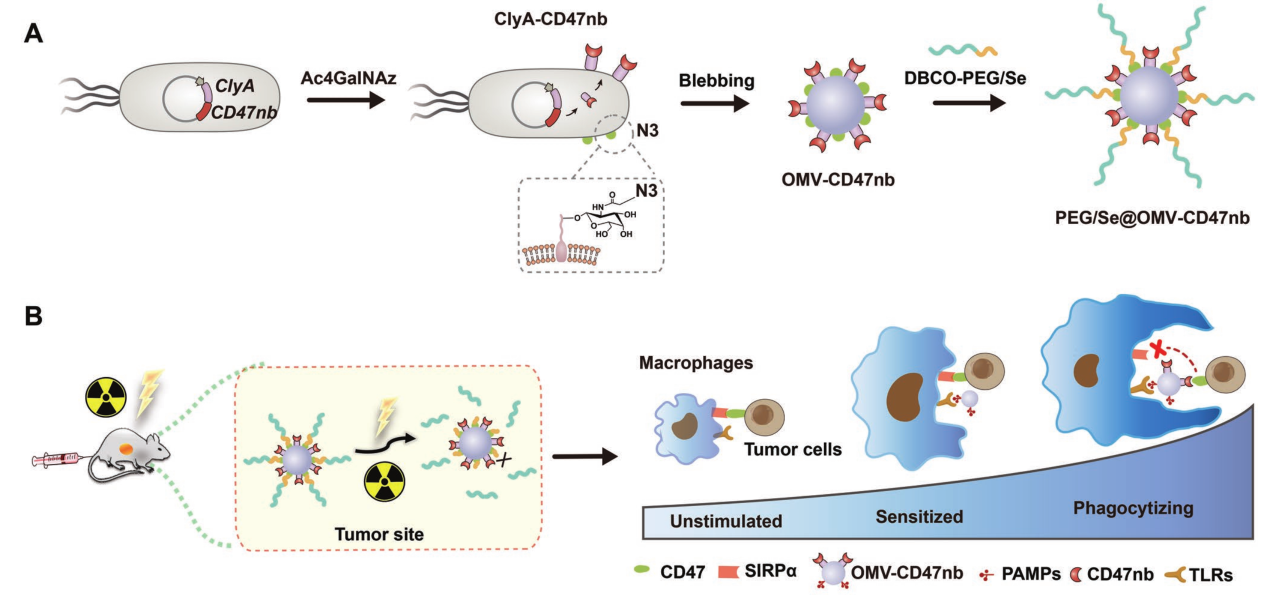
CD47纳米抗体(CD47nb)融合到OMV表面(OMV-CD47nb),OMV-CD47nb可以同时与肿瘤细胞的CD47和TAMs的TLRs结合;外表面涂有含有二烯酰胺键(PEG/Se)的聚乙二醇(PEG)层,形成PEG/Se@OMV-CD47nb,PEG/Se层的修饰可以减轻了OMV-CD47nb的免疫原性,显著提高给药剂量;
分组设计
构建PBS、PGE/Se@OMV-CD47nb+RA和anti-CD47处理的皮下成瘤小鼠模型,利用流式细胞术FACS分选巨噬细胞,进行RNA-seq。
文献研究思路
研究结论
- 改造的纳米药物工程细菌OMV-CD47nb在肿瘤部位进行局部放射治疗时,可以安全有效地精准释放到TME中;
- OMV-CD47nb通过多种途径激活TAM吞噬作用,包括诱导M1极化和阻断“don’t eat me”信号;
- TAM的激活通过有效的抗原呈现来刺激T细胞介导的抗肿瘤免疫。
文献主要研究结果
1、OMV-CD47nb对体外巨噬细胞的影响
分别用PBS、OMVs、OMVs+CD47nb混合物、OMV-CD47nb和anti-CD47,处理B16-GFP细胞2h(绿色荧光蛋白的小鼠黑色素瘤细胞 B16-GFP),然后将处理后的细胞与M0型BMDMs、M1型BMDMs共培养。结果显示,OMV-CD47nb共培养2h后,M1型BMDMs组中GFP+细胞比例大于M0型BMDMs组(图1C, D),表明M1型BMDMs与M0型BMDMs相比具有更高的吞噬活性,荧光成像也观察到吞噬突触(图1E);OMVs+CD47nb混合物没有诱导巨噬细胞吞噬作用,表明OMV-CD47nb能有效介导巨噬细胞和肿瘤细胞的相互作用。
OMVs和OMV-CD47nb处理,显著提高了M0型BMDMs和M2型BMDMs中CD86+、MHC Ⅱ+、CD40+细胞比例(M1型巨噬细胞标记物),显著抑制了M1型BMDMs和M2型BMDMs中CD206+细胞比例)(M2型巨噬细胞标记物)(图1F);ELISA实验结果证实,OMVs和OMV-CD47nb处理后的M0型和M2型BMDMs,促进了促炎细胞因子如IL-1β、TNF-α、IL-12和IL-6的表达,抑制了抗炎细胞因子IL-4的表达(图1G)。以上结果表明,OMVs和OMV-CD47nb能够促进体外巨噬细胞的M1型极化。
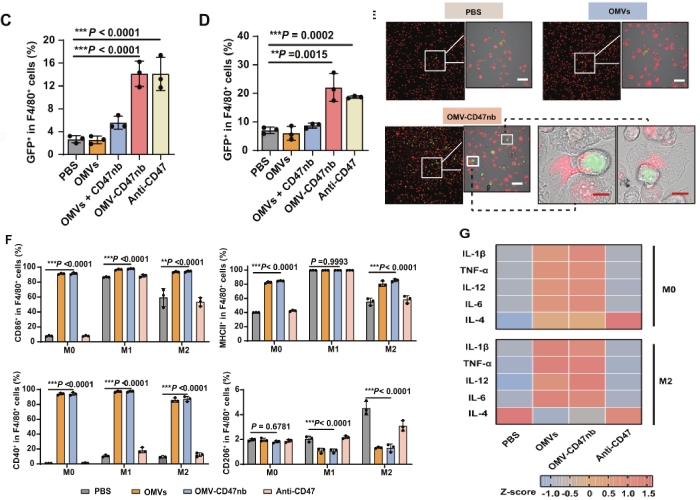
图1 OMV-CD47nb在体外对巨噬细胞的多重激活
2、PEG/Se@OMV-CD47nb具有抗肿瘤和TME重塑作用
分别构建PBS、PEG/Se@OMV-CD47nb、RA(局部放射治疗)、PEG/Se@OMV+RA、PEG/Se@OMV-CD47nb+RA、anti-CD47处理的MC38-OVA皮下成瘤小鼠模型(表达卵清蛋白的MC38小鼠结肠癌细胞系),评估抗肿瘤效果(图2A)。结果显示,90天后,PEG/Se@OMV-CD47nb+RA组小鼠存活率100%,PEG/Se@OMV+RA组小鼠存活率33.3%,其余组小鼠均全部死亡(图2B);单独RA与PEG/Se@OMV-CD47nb处理没有引起明显的抗肿瘤活性,而RA与PEG/Se@OMV-CD47nb联合显示出显著的抗肿瘤效果,但并且与临床上使用的阳性对照anti-CD47相比,CD47nb的抗肿瘤作用更强(图2C)。
利用流式分选评估治疗后TME中肿瘤浸润性免疫细胞的数量,结果显示,相较于PBS组,PEG/Se@OMV-CD47nb+RA组显著增加了F4/80巨噬细胞与F4/80 CD86 M1型巨噬细胞的比例,并减少了F4/80 CD206 M2型巨噬细胞的比例(图2D);PEG/Se@OMV-CD47nb+RA处理组上调了CD11C+CD80+细胞和CD11C+CD86+细胞的比例,表明激活了TME中树突状细胞DC的成熟(图2E);PEG/Se@OMV-CD47nb+RA组还招募了大量的CD45+CD49B+NK细胞、CD45+CD19+B细胞和CD11B+Ly6G 中性粒细胞进行肿瘤组织。以上结果表明,OMV-CD47nb改变了TAMs的极化状态,并通过招募各种免疫细胞促进TME重塑。
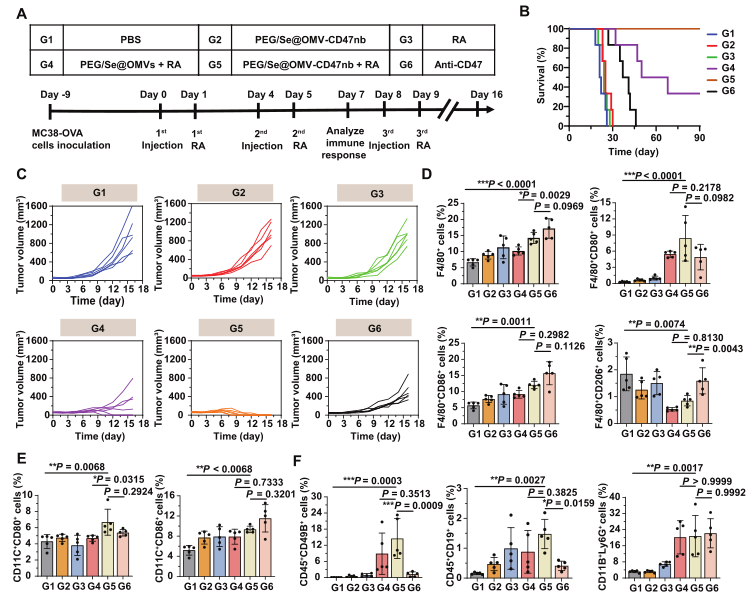
图2 PEG/Se@OMV-CD47nb的抗肿瘤和TME重塑作用
3、RNA-seq分析PEG/Se@OMV-CD47nb治疗后瘤内巨噬细胞表达模式变化
利用FACS分选出PBS、PGE/Se@OMV-CD47nb+RA和anti-CD47处理的皮下成瘤小鼠的瘤内巨噬细胞,进行RNA-seq。分析结果显示,与PBS组相比,PGE/Se@OMV-CD47nb+RA组M1型巨噬细胞maker基因表达水平上调,包括:CD80、CD86、CD38、Marco、FPR2、NOS2、IL-1α、IL-1β、IL-6、IL-18、IL-23a、IL-27、CCL1、CXCL2、CXCL9、、CXCR3、CCL3、CCL4和CCL5,M2型相关的marker基因表达水平下调,包括:Rentla、Mrc1、SOCS2和Ppard,提示与M1型相关趋化因子的表达增加可能是招募免疫细胞进入TEM的原因;PGE/Se@OMV-CD47nb+RA组中M1型极化相关的转录因子IRF-5和Myd88表达水平上调,M2型极化相关的转录因子Rictor、TSC1、Klf4和Prkaa1表达水平下调(图3A); 相较PBS组,PGE/Se@OMV-CD47nb+RA和anti-CD47组中CD47-SIRPα信号通路下游分子SHP2表达水平下调,可能与CD47的阻断作用有关(图3B)。
与PBS组相比,PGE/Se@OMV-CD47nb+RA组中的VEGFA、VEGFB、HGF、PDGFA、MMP2、MMP9、MMP10和MMP11表达水平下调(图3C),这些基因与TAMs促进肿瘤血管生成和转移相关;此外,多种MHC Ⅰ、MHC Ⅱ类分子表达水平显著上调,表明肿瘤细胞的吞噬和抗原呈递可能发生在TAMs中。
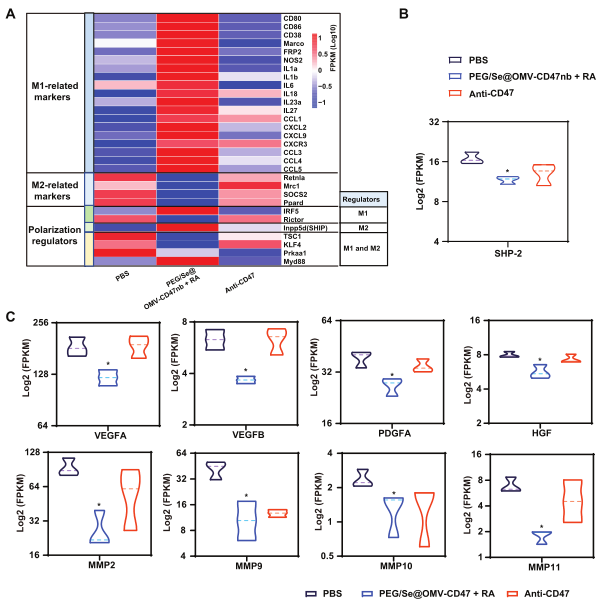
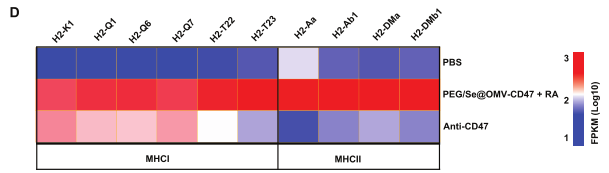
图3 PEG/Se@OMV-CD47nb治疗后瘤内巨噬细胞表达模式变化
4、OMV-CD47n激活了长期的免疫记忆
为了确定通过辐射触发的OMV-CD47nb传递是否能激活免疫记忆,对构建好的PEG/Se@OMVs+RA、PEG/Se@CD-CD47nb+RA处理的MC38-OVA和B16-OVA皮下成瘤小鼠进一步分析(图4A)。结果显示,PEG/Se@OMVs+RA和PEG/Se@CD-CD47nb+RA处理的MC38-OVA小鼠肿瘤没有生长,达到100%的肿瘤抑制率(图4B),但PEG/Se@OMVs+RA和PEG/Se@CD-CD47nb+RA处理的B16-OVA组分别达到了 91.2%和98.2%的肺部转移抑制率(图4C, D);与对照组相比,PEG/Se@OMVs+RA和PEG/Se@CD-CD47nb+RA治疗得小鼠血液和脾脏的中央记忆型T细胞和效应记忆T细胞比例显著上调(图4E, F);PEG/Se@OMVs+RA组中记忆T细胞比例略高于PEG/Se@CD-CD47nb+RA组,这与B16-OVA细胞的肺转移抗肿瘤效果一致(图4D);PEG/Se@OMVs+RA和PEG/Se@CD-CD47nb+RA处理的小鼠脾脏细胞仍然拥有识别肿瘤抗原的能力,表现为OVA抗原重新刺激上调CD3+CD8+T细胞中IFNγ+细胞的比例(图4G)。以上结果表明,PEG/Se@CD-CD47nb+RA治疗诱导肿瘤抗原特异地适应性免疫,激活了肿瘤抗原的免疫记忆,提供了长期的肿瘤预防效果。
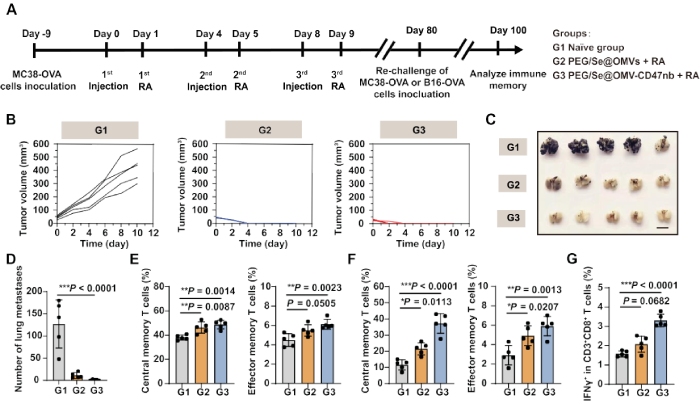
图4 CD-CD47nb诱导适应性免疫
研究小结
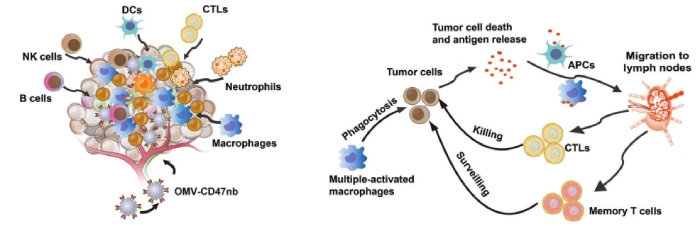
OMV-CD47nb可以同时与肿瘤细胞的CD47和TAMs的TLRs结合,诱导M1极化和阻断“don’t eat me”信号,在肿瘤细胞和巨噬细胞间起到桥梁作用,纳米药物有效吞噬肿瘤细胞;还可以招募各种免疫细胞,包括B细胞、NK细胞、DC细胞、巨噬细胞、中性粒细胞和细胞毒性T淋巴细胞,引起小鼠肿瘤TME重塑;OMV-CD47nb介导的TAMs对肿瘤细胞的吞噬又发了肿瘤抗原的释放,通过有效的抗原呈递刺激T细胞介导的抗肿瘤免疫。
如果您对该研究思路感兴趣,欢迎点击下方按钮联系我们,我们将免费为您设计文章思路方案
参考文献
Feng Q, Ma X, Cheng K, et al. Engineered Bacterial Outer Membrane Vesicles as Controllable Two-Way Adaptors to Activate Macrophage Phagocytosis for Improved Tumor Immunotherapy. Adv Mater. 2022;34(40):e2206200. doi:10.1002/adma.202206200









 京公网安备 11011302003368号
京公网安备 11011302003368号