
2022年8月19日北京中医药大学与电子科技大学合作,在国际期刊JCR Q1区《Frontiers in Pharmacology》(IF:5.988)在线发表了题为“Revealing the Mechanism of Huazhi Rougan Granule in the Treatment of Nonalcoholic Fatty Liver Through Intestinal Flora Based on 16S rRNA, Metagenomic Sequencing and Network Pharmacology”研究成果。该研究通过宏基因组测序,16S rRNA基因测序、网络药理学和分子对接等手段,探讨了HRG(化滞柔肝颗粒)通过肠道菌群治疗非酒精性脂肪肝(NAFL)的作用机制。百迈客为该研究提供了16S rRNA基因测序和宏基因组测序和部分分析工作。

研究背景
非酒精性脂肪肝(NAFL)的发病率呈逐年上升趋势,越来越多的证据表明肠道菌群在NAFL中起着致病作用。化脂柔肝颗粒是临床上常用的治疗NAFL的药物。据报道,它可以降脂保肝,但还没有研究证实该药物的作用是否与肠道菌群有关。因此,研究者从肠道菌群的角度,研究其作用是否与肠道菌群调节有关,以进一步探讨其治疗NAFL的机制。
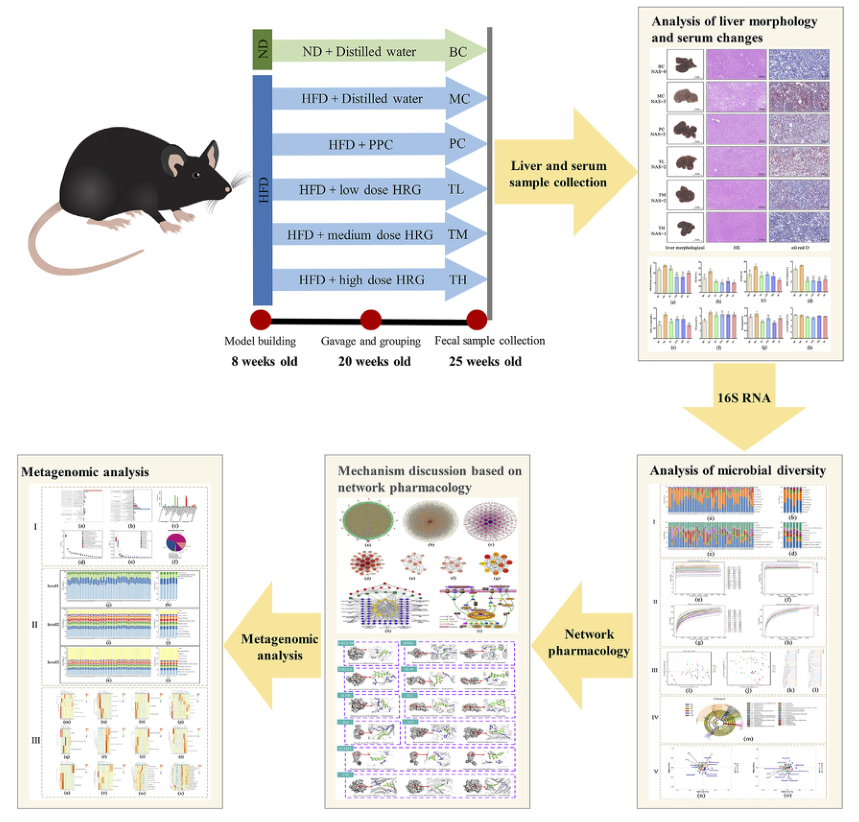
技术路线
主要结果
1.高脂饲料引起的小鼠体内脂质蓄积
如图1所示,与BC组相比,模型组大鼠肝脏脂肪堆积增多,肝脏体积增大,颜色变白,边缘变钝。给药后,各组大鼠肝脏红化程度均有不同程度的改善,尤以TH组为佳。HE和油红O染色结果显示,模型组大鼠肝组织内可见较多的球状变性肝细胞和较多的红色脂肪,而给药组较少。MC组病理程度重,TH组轻,TL组与PC组之间无显著差异。因此,HRG可改善HFD诱导的肝脏脂肪堆积和体重增加,并且可能以剂量依赖的方式改善肝脏损伤。
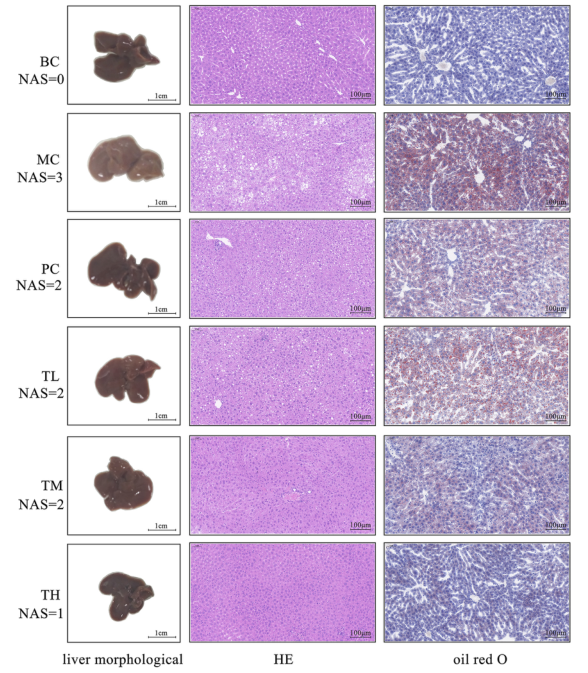
图1.HRG对小鼠肝脏形态、肝组织病理学的影响
2.血清分析
与空白组比较,模型组大鼠肝酶、血脂指标升高,其中TC、HDL-C、LDL-C、AKP、ALT、AST差异有统计学意义,而甘油三酯则无显著差异。给药后肝酶和血脂均低于模型组。丙氨酸氨基转移酶(ALT)、谷草转氨酶(AST)和高密度脂蛋白胆固醇(HDL-C)在MC组和给药组之间有显著差异。各给药组间TC、ALT、HDLc差异无统计学意义。HRG组与PC组比较,AKP、AST、TG、LDL-C差异有统计学意义。
TM组和TH组降低AKP效果优于TL组,TG组降低AKP效果优于TM组。PC组降低AKP的效果优于TL组,但差于TM组和TH组。PC组降低低密度脂蛋白胆固醇的效果优于TM组和TH组,表明高脂饲料可导致大鼠血脂和肝酶代谢异常,高脂高脂颗粒可改善高脂大鼠血脂代谢和肝酶活性。与阳性药物相比,HRG在改善高密度脂蛋白胆固醇、甘油三酯、碱性磷酸酶方面具有优势,且改善程度可能呈剂量依赖性。各组间器官指数无显著差异,HRG对小鼠生化指标和器官指数的影响如图2所示。
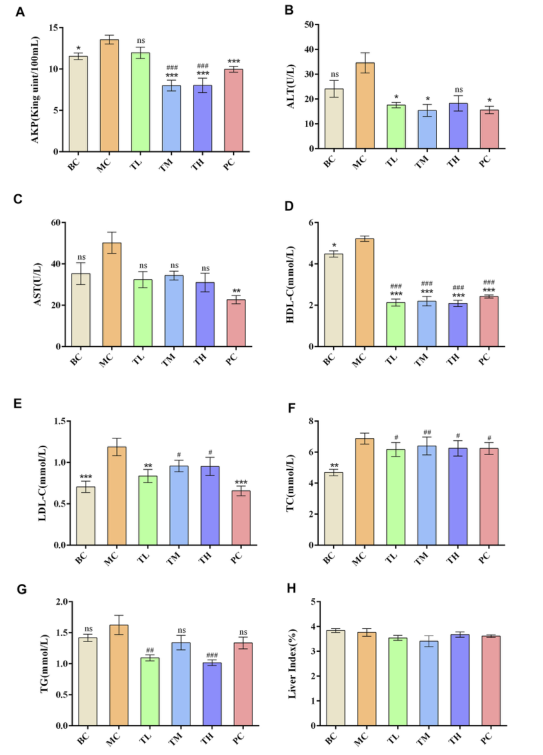
图2.HRG对小鼠生化指标及器官指标的影响
3.微生物多样性分析
对粪便样本进行16s rRNA基因测序分析,在门、纲、目、科和属的水平上对微生物群进行了鉴定和分析,最终共鉴定到17门、26纲、56目、86科、187属。主要物种为厚壁菌门和拟杆菌门,其次是放线菌门、疣微菌门和变形菌门。此外,物种主要分布在uncultured_bacterium_f_Muribaculacea属和lachnospiraceae NK4A136 group,其次是uncultured_bacterium_f_Lachnospirae、Lactobacillus和Akkermansia。
在门水平(图 3A、B),MC 组的厚壁菌门、变形菌门和放线菌门的水平高于 BC 组,而拟杆菌门和疣微菌门的水平较低。与BC组相比,给药组厚壁菌门和变形菌门水平降低,尤其是TH组;放线菌在 TH 和 TM 组中减少,在 TM 组中最显著,但在 PC 和 TL 组中增加。拟杆菌在 TH 和 TM 组中显着高于 MC 组,Verrucomicrobia 在 TH 和 TM 组中增加最显著。与BC组相比,MC组在属水平上乳酸杆菌和脱硫弧菌的比例更高。相比之下,Akkermansia 和 Ruminococcaceae UGG-014 所占比例较低。给药后乳杆菌(TH组下降多)和脱硫弧菌(TH组下降多)减少,Akkermansia(TH组增加多)和瘤胃球菌UGG-014(PC组增加多)增加。给药后乳杆菌和脱硫弧菌减少,阿克曼氏菌增多,尤其是TH组; Ruminococcaceae UGG-014 增加,特别是在 PC 组。因此,初步推测HRG可增加拟杆菌门、疣微菌门、未培养菌f Lachnospiceae和Akkermansia,减少厚壁菌门和变形菌门、乳酸杆菌和脱硫弧菌。HRG可通过改变NAFL小鼠肠道菌群结构改善NAFL。
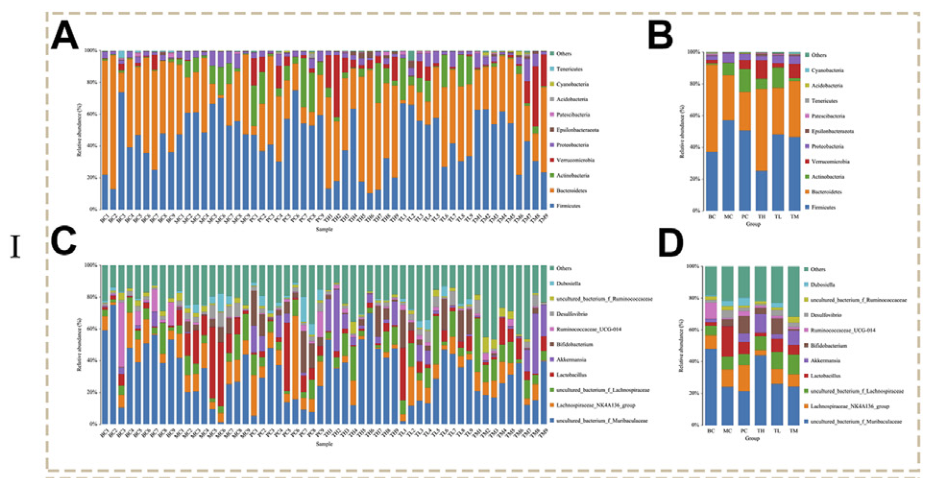
图3 I物种组成分析
肠道菌群聚类显示BC组和MC组样本微生物群落差异明显,给药组、BC组和MC组微生物群落差异显著。此外,Bray-Curtis PCoA 证实了这些发现(图 3J)Curtis PCoA 证实了这些发现(图 3J)。 PC1(15.21%)能较好地区分BC和MC组、MC和TM、TH组微生物群落。这些数据进一步表明BC和MC组在微生物群落结构上存在较大差异,并且HRG施用组和对照组在微生物群落结构上存在较大差异。
进一步通过LEfSe分析寻找表明组间差异biomarker。结果表明,在门水平上差异物种为拟杆菌门、放线菌门、厚壁菌门和疣微菌门在是显着差异物种。在属水平上,差异物种为双歧杆菌、拟杆菌、Alloprevotella、Lactobacillus、Lachnospiraceae_NK4A136_group、Dubosiella、Faecalibaculum和Akkermansiaceae。AFL小鼠和HRG组的优势菌群主要为厚壁菌门、变形菌门、放线菌门和拟杆菌门。在属水平上,差异物种主要为Adlercreutzia和Ruminococcaceae_UCG-013、Sphingomonas等。表明HRG可能通过改变厚壁菌门、变形菌门、放线菌门和拟杆菌门的菌群来改善NAFL。
对肠道菌群丰度和血清指标参数进行 RDA 分析,结果表明,AKP、HDL-C、TC、TG与物种分布高度相关,且呈同向分布。在属水平上,它们与Faecalibaculum、Desulfovibrio、Dubosiella和Lactobacillus呈正相关,与Bacteroides、Akkermansia和Alloprevotella呈负相关。在门水平上,AKP、HDL-C和TG与物种分布高度相关,与厚壁菌门和放线菌门呈正相关,与Epsilonbacteraeota和Verrucomicrobia呈负相关。 Acidobacteria 和 Proteobacteria 与 AKP 和 HDLC 呈负相关,与 TG 呈正相关。拟杆菌与HDL-C呈正相关,与AKP、TG呈负相关。结果表明,这些菌落丰度的变化与NAFL小鼠给药前后肠道菌群的结构变化密切相关。
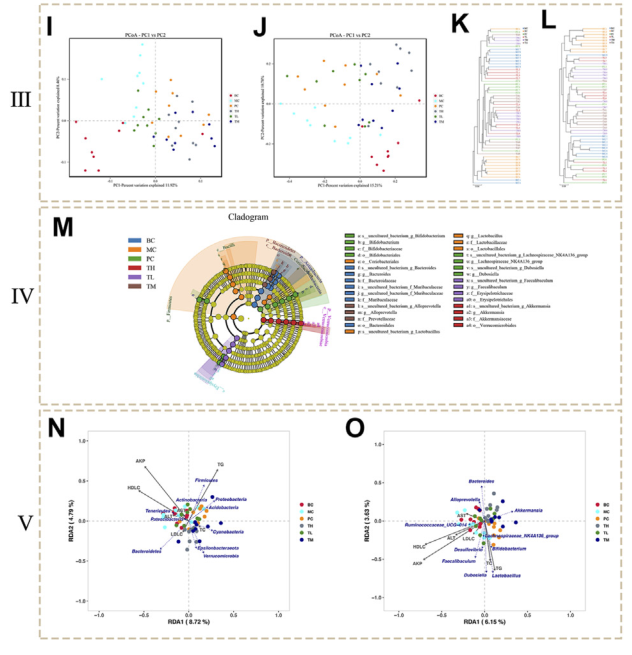
图3 beta多样性分析,LEfSe分析和RDA分析
3.网络药理学
通过对药材中重复成分的筛选和去除,得到249个有效成分。将上述化合物用于靶标预测、校正和重复靶标的删除,共获得1186个靶标的标准基因名称。HRG的“草药-化合物靶点”网络如图4A所示(黄色节点代表药物靶点,绿色节点代表化合物,红色节点代表草药),在20个节点中,高度值的14个化合物被选为关键化合物(表3)。NAFL的PPI网络如图4B所示,IFD的PPI网络如图4C所示。
将与NAFL相关的靶点、与IFD相关的靶点、与化合物对应的靶点同时合并,得到了HRG通过肠道菌群治疗NAFL的靶点(图4D)。对合并后的网络进行模块分析和细胞Hubba分析。模块分析显示模块1(图4E,Score=7.2)和模块2(图4F,Score=7.0),而cell Hubba分析显示前10个目标(图4G)。最终获得了10个潜在的治疗靶点:CXCL10、CXCL8、ICAM1、IFNG、IL10、IL1B、IL2、IL4、IL6、TNF。图4A-F中的节点大小与度值呈正相关。图4B-F中的节点颜色与度值呈正相关。
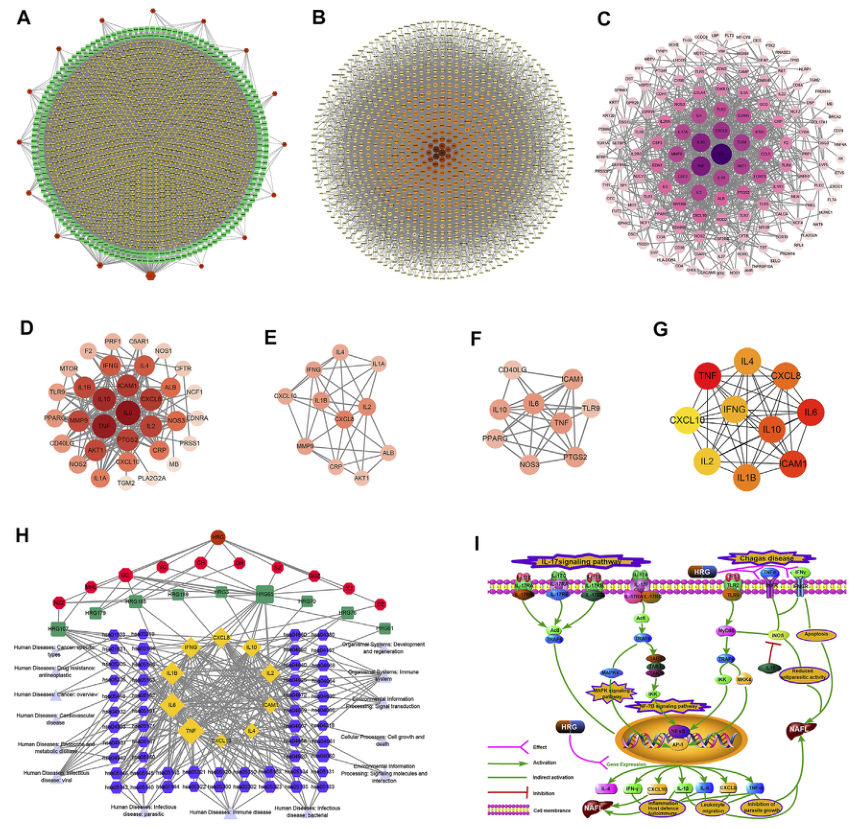
图4.网络构建和关联分析。
(A)HRG药材靶点网络。(B)与NAFL有关的PPI网络。(C)与IFD有关的PPI网络。(D)HRG-IFD-NAFL合并目标的PPI网络。(E)模块1(F)模块2(G)Hub基因。(H)草药-关键化合物-潜在靶向途径网络。(I)关键靶点可能导致的关键生物进展图例。
利用10个关键治疗靶点、14个关键化合物和相关通路,通过Cytoscape构建了“药草-关键化合物-潜在靶点-通路”的网络图(图4H)。排名前三的化合物被选为潜在化合物(槲皮素、木犀草素、山柰酚)。选择前三个信号通路作为关键通路。绘制了 HRG 通过肠道菌群治疗 NAFL 的通路机制(图 4I)。将10个关键靶点与3个潜在化合物进行分子对接,共获得18对对接结果(表4),使用 Pymol 可视化结果(图 5)。
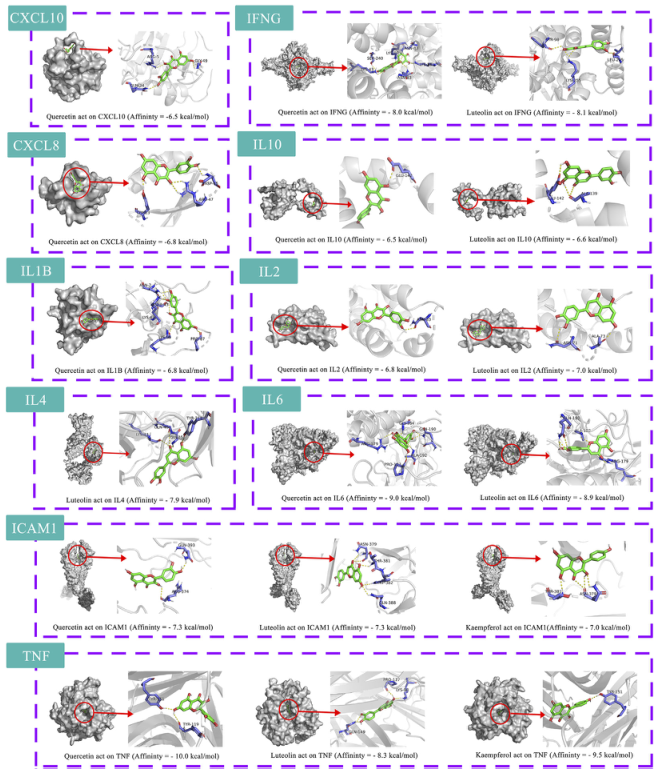
图5. 分子对接模式图
4.宏基因组测序
通过宏基因组测序研究基因功能,基于KEGG(图6A、B)、GO(图6C)、EGNOG(图6D)、CARD(图6E)和CAZY(图6F)数据库进行了功能注释,共注释到了6055个KO(KEGG Ontology)和2104个EC(Ease)。结果表明,相应的复制、推荐、修复和一般功能预测功能基因只占较高的比例。细胞壁/膜/被膜的生物发生和碳水化合物的运输和代谢位居第二。CARD数据库的标注结果表明,四环素类和多药耐药对应的耐药基因相对含量较高,其次为氟喹诺酮类和氨基糖苷类。CAZy数据库的注释结果表明,糖苷水解酶(GH)、糖基转移酶(GT)和非催化糖结合模块(CBM)是前三位的碳水化合物酶。
图6G-L显示了在每个组和样本的不同水平上的KEGG通路的组成。与空白组和模型组相比,模型组3个层级通路的丰度均有不同程度的增加。推测HRG可能通过增加与代谢调节相关的代谢途径来改善NAFL。
进一步用MetagenomeSeq分析检测第 3层级 KEGG的丰度差异(p<0.05),丰度差异图如图6M-X所示。结果表明,MC组蛋白酶体丰度显著高于BC组,MC组倍半萜和三萜生物合成显著低于BC组。与MC组相比,PC组改变了这一趋势。与BC组相比,HRG组降解苯甲酸氟化物和降解甲苯的丰度更高。与MC组相比,HRG组丰度较高的代谢途径包括氨基苯甲酸降解、类胡萝卜素生物合成等。因此,HRG可能通过代谢和细胞过程改善NAFL,代谢相关途径在其中起重要作用。氨基苯甲酸的降解、类固醇的生物合成、倍半萜和三萜的生物合成是重要的代谢途径。
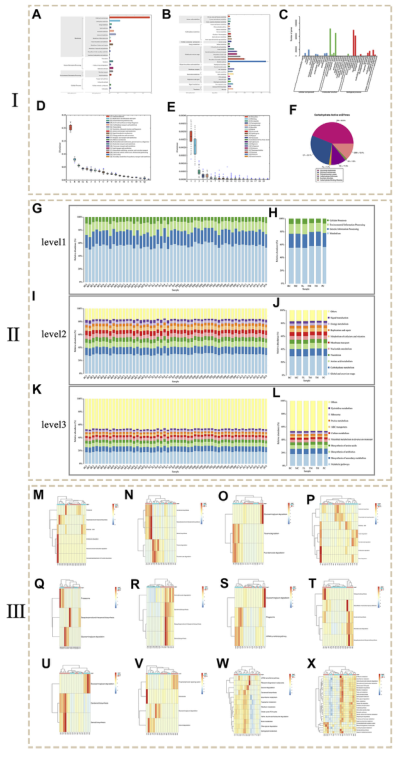
图5.宏基因组测序结果。 (Ⅰ:功能注释分析。Ⅱ:KEGG通路组成和丰度直方图。Ⅲ:metagenomeSeq差异通路丰度热图)。
总结
综上所述,HRG可能通过改变微生物多样性、结构和功能来改善高脂饮食诱导的NAFL。还有可能通过调节肠道相关的代谢途径、炎症反应和免疫反应来改善NAFL相关的脂肪堆积和肝脏损伤。这些结果有力地表明,HRG可能通过预防肠道菌群失调来减轻NAFL。此外,HRG可通过肠道菌群治疗多种成分、多代谢途径、多靶点的NAFL。本研究为NAFL的治疗提供了新的思路,证实了肠道菌群与NAFL之间的关系,提示HRG具有良好的治疗效果。
如果您对宏基因组测序技术感兴趣,欢迎点击下方按钮联系我们,我们将免费为您设计文章思路方案。
参考文献:
Liu Y, Tan Y, Huang J, et al. Revealing the Mechanism of Huazhi Rougan Granule in the Treatment of Nonalcoholic Fatty Liver Through Intestinal Flora Based on 16S rRNA, Metagenomic Sequencing and Network Pharmacology[J]. Frontiers in pharmacology, 2022, 13.
百迈客微生物组学服务
百迈客生物在微生物领域深耕多年, 合作文章见刊于《Nature》、《Cell Host & Microbe》、《Water Research》、《Journal of Hazardous Materials》、《Environmental science & Technology》、《Bioresource Technology》等高水平杂志。百迈客可提供Illumina二代宏基因组、ONT三代宏基因组、PacBio全长微生物多样性、二代微生物多样性、微生物绝对定量等全套测序分析服务,项目经验丰富,累计处理样本数15万+,合作文章数600+,影响因子2500+,合作单位覆盖31个省及直辖市、400+家单位,百迈客致力于提供高质量的组学测序服务,欢迎垂询!









 京公网安备 11011302003368号
京公网安备 11011302003368号